1. 引言
在当今诸多的储能器件中,即使锂金属电池甚至超级电容器的研究已经得到普及,但我们的能源世界仍然可以以锂离子电池(LIBs)的名字命名,这是因为其出色的性能。具体来说,是其便捷轻巧、能量高、循环寿命长,造成的污染小、有着很好的安全性能等优点 [1]。它是绝大多数储能设备的选择,可用于电力系统储能电站、航空航天、军用领域、电动汽车、电子设备、微电网等诸多大型领域。层状三元正极材料LiNixCoyMnzO2(NCM)由于其较高的实际容量 [2],低廉的价格和环境友好性 [3],是目前研究热度最高,发展前景极好,应用极为广泛的锂离子电池正极材料 [4]。其中镍含量较低的NCM材料由于容量受限,不满足日益增长的市场需求,而高镍NCM材料在较低电压下也能得到不错的放电容量,所以,高镍NCM材料是三元材料领域的主要发展方向 [5] [6] [7]。
然而,合成高镍NCM材料是比较困难,并且高镍NCM材料的循环性能和稳定性能都不够好,这些因素阻碍了其商业化。为了解决这些问题,大量的工艺改进方法和改性手段被提出 [8] [9] [10],诸如控制合成材料过程时的煅烧条件,各种金属离子掺杂改性和金属氧化物包覆改性等。本文为了使高镍三元锂离子电池正极材料LiNi0.8Co0.1Mn0.1O2能够达到更好的放电比容量,采用共沉淀法,从配锂源的角度选取氢氧化锂(LiOH∙H2O,分析纯AR,成都市科龙化工试剂厂)、乙酸锂(CH3COOLi∙2H2O,分析纯AR,成都市科龙化工试剂厂)和碳酸锂(Li2CO3,分析纯AR,成都市科龙化工试剂厂)三种不同锂源制备LiNi0.8Co0.1Mn0.1O2正极材料,从物理结构和电化学性能上探究制备LiNi0.8Co0.1Mn0.1O2材料的最佳锂源。对以氢氧化锂为锂源的样品进行ZnO包覆改性,用EDS元素映射分析等手段分析包覆改性效果。
2. 实验部分
2.1. 合成不同锂源的LiNi0.8Co0.1Mn0.1O2正极材料及ZnO包覆改性材料
将Mn(CH3COO)2∙4H2O(锰酸锂,分析纯AR,成都市科龙化工试剂厂)、Ni(CH3COO)2∙4H2O(镍酸锂,分析纯AR,成都市科龙化工试剂厂)、Co(CH3COO)2∙4H2O(钴酸锂,分析纯AR,成都市科龙化工试剂厂)按照Ni、Co、Mn的摩尔比为8:1:1的比例分别溶解于去离子水中,经过搅拌形成澄清溶液,而后将三种金属离子溶液混合得到溶液A。将一定量的去离子水、氨水(NH3∙H2O,分析纯AR,成都市科龙化工试剂厂),水合肼(分析纯AR,成都市科龙化工试剂厂)加入反应容器内,对其进行水浴加热搅拌,当温度升高到合适数值后,按一定流量同时加入澄清溶液A、氢氧化钠(NaOH,分析纯AR,成都市科龙化工试剂厂)溶液和氨水。在搅拌的作用下金属溶液与沉淀剂及添加剂发生共沉淀反应,同时时刻控制好体系的pH值。待所以金属离子沉淀反应完成后蒸发除水,随后将获得的样品放置在干燥箱中于120℃干燥12 h。干燥完毕的样品放入马弗炉中高温煅烧,以分解有机物,煅烧温度为520℃,时间为6 h。最后冷却研磨后得到前驱体粉末。将Ni0.8Co0.1Mn0.1(OH)2前驱体粉体与锂盐在玛瑙中混合。将混合物放入马弗炉中,在480℃的温度下预热至5 h,然后在空气中以900℃烧结15 h,冷却研磨后得到最终样品,由三种不同锂源制备的LiNi0.8Co0.1Mn0.1O2材料,将三种样品直接按锂源的名字称呼(LiOH-NCM、LiAc-NCM、Li2CO3-NCM)。
2.2. 合成ZnO包覆改性材料
将所需比例的无水乙酸锌(Zn(CH3COO)2分析纯AR,成都市科龙化工试剂厂),超声分散在乙醇(C2H5OH,99.7%,成都市科龙化工试剂厂)中,连续搅拌1小时,然后将LiNi0.8Co0.1Mn0.1O2材料加入到混合物中,搅拌1小时,得到化合物转移到内衬聚四氟乙烯的不锈钢高压釜中,在60℃下保持10小时。然后,用乙醇洗涤并干燥产品。随后,混合物在空气气氛500℃的温度下煅烧3 h,得到ZnO包覆的LiNi0.8Co0.1Mn0.1O2样品(Zn-NCM)。本文制备Zn-NCM样品包覆量为0.5%、1.5%和2.5% (与NCM材料的质量百分比),这三种包覆量制备的改性材料分别命名为0.5% Zn-NCM、1.5% Zn-NCM和2.5% Zn-NCM。
2.3. 材料表征
利用扫描电子显微镜(SEM,JSM-7500LV,日本电子公司)扫描样品材料的表面,得到其形貌和尺寸信息 [11]。采用Cu的Ka光源(1.5418 Å)的X射线衍射仪(XRD,DX-2700X,丹东方圆仪器厂)在10˚~80˚的衍射角范围之间照射LiNi0.8Co0.1Mn0.1O2样品获得X射线衍射图谱,对其晶体结构进行分析 [12]。利用元素映射分析包覆改性样品的包覆效果。
2.4. 电化学性能测试
取质量比为8:1:1的LiNi0.8Co0.1Mn0.1O2、导电炭黑、PVDF,添加适量的NMP溶剂研磨成均匀的混合浆料,将其均匀的涂覆在铝箔上,后置于80℃干燥箱中干燥10小时以上,之后用压片机裁片机在20 MPa压力下压制裁剪成直径14 mm的薄电极圆片。把电极片置于水氧含量极低的手套箱中组装成扣式电池。使用LAND测试仪器(CT2001A,武汉胜蓝电子科技有限公司)对样品进行循环性能的表征,在电化学工作站(CHI660E,上海辰华仪器有限公司)上测量样品循环伏安法(CV)曲线 [13] 和电化学阻抗谱(EIS)曲线 [14] [15]。
3. 结果与讨论
3.1. 不同锂源制备的LiNi0.8Co0.1Mn0.1O2材料性能分析
使用乙酸锂,氢氧化锂和碳酸锂三种不同的锂源合成的LiNi0.8Co0.1Mn0.1O2的XRD测试图谱在图1呈现。将它们分别称之为LiAc-NCM,LiOH-NCM和Li2CO3-NCM。从图中可以看出,三种LiNi0.8Co0.1Mn0.1O2样品的主要特征衍射峰位置相似,强度高、形状尖锐、半高宽窄,说明它们的晶体结构大致相同,且结晶度较好,没有其他杂质相。另一方面,在三种样品的XRD谱图中可以看到,目标产物在38˚和65˚左右的衍射角处出现了清晰的分裂峰,即(006)/(102)和(108)/(110)双峰,表明材料形成了完整有序的晶体层状结构 [16]。对应(003)晶面的特征峰代表了层状岩盐结构,而(104)对应了立方岩盐结构,故这两个特征峰的强度比(I003/I104)反应了材料中阳离子混乱排列的程度,一般认为R = I003/I104 > 1.2,c/a > 4.9时材料的阳离子混排小,层状结构好 [17]。通过用MDI jade6.0软件对样品的晶胞参数进行分析,将数据结果制成表1。“a”晶胞参数表示层内金属相邻层之间的距离,“c”晶胞参数表示层间距。可以看到,三种锂源制备的LiNi0.8Co0.1Mn0.1O2材料的c/a值均大于4.9,这说明三种样品均具有良好的层状结构。三种样品中,Li2CO3-NCM样品的a轴和c轴最大,c/a值最小;LiOH-NCM样品的a轴小于LiAc-NCM样品,c轴大于LiAc-NCM样品;LiOH-NCM样品的c/a值最大,表明其六边形层状结构更理想。这有利于充放电过程中Li+的插层和脱层。从(003)和(104)特征峰的强度比(I003/I104)上看,LiAc-NCM、LiOH-NCM和Li2CO3-NCM的(I003/I104)比值分别为1.022、1.101和0.906。说明LiOH-NCM样品中Li+和Ni2+之间的离子无序程度最小。
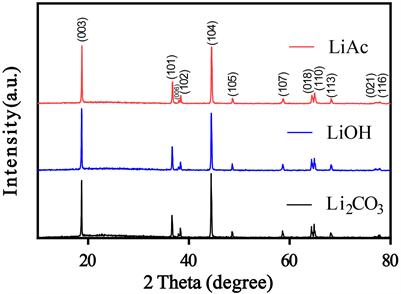
Figure 1. XRD patterns of LiNi0.8Co0.1Mn0.1O2 prepared by three different lithium sources
图1. 三种不同锂源制备的LiNi0.8Co0.1Mn0.1O2材料的XRD图谱

Table 1. Cell parameters and (003), (104) peak intensity ratios of all samples
表1. 所有样品的晶胞参数和(003),(104)峰强度比值
将不同锂源合成的LiNi0.8Co0.1Mn0.1O2材料作了少数几圈(30圈)循环性能的比较。测试条件为在1 C的恒定充放电电流密度,2.7 V~4.6 V的电压窗口下对三种材料进行30次充放电。结果如图2(a)所示。
以LiAc、LiOH和Li2CO3为锂源制备的LiNi0.8Co0.1Mn0.1O2正极材料的首次比放电容量分别为178.4、183.4和176.1 mAh∙g−1。经过30次充放电循环后,比容量分别为150.5、158.1和150.2 mAh∙g−1。实验结果表明,三种不同锂源制备的LiNi0.8Co0.1Mn0.1O2样品的放电性能相似,但也存在一定的差异。经过30次充放电循环后,3种样品的放电比容量均下降了约15%。由于三种过渡金属元素中镍的比例(0.8)较大,Ni含量高,不稳定的Ni3+还原为Ni2+的概率大,阳离子混合的概率大,正极材料的稳定性低。主要表现为充放电循环中容量的损失。图2(b)为初始放电容量与第30次放电容量的对比,三个样品在第30循环的比容量保留率分别为84.4%、86.2%和85.3%。
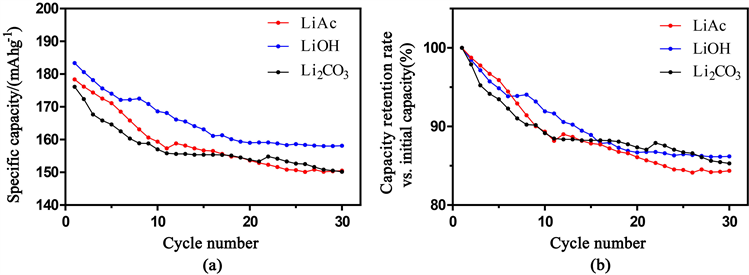
Figure 2. (a) The specific discharge capacity curves of the NCM811 with different sources of lithium from initial discharge capacity to 30th discharge capacity; (b) Normalized capacity-retention rate vs. the first specific discharge capacity
图2. (a) 不同锂源制备的LiNi0.8Co0.1Mn0.1O2样品在30次充放电循环中的放电比容量;(b) 不同锂源制备的LiNi0.8Co0.1Mn0.1O2样品对比第一次充放电的比容量保持百分比率
图3(a)是三种不同锂源合成的LiNi0.8Co0.1Mn0.1O2材料的交流阻抗图。从图3(a)中可以看出,所有样品的交流阻抗图形状均是由一个半圆(对应高频区)和一条倾斜直线(对应低频区)两个部分组成。其中前者对应于界面电荷传递阻抗(Rct),而后者对应了Li+在固相中扩散形成的Warburg阻抗ZW。样品中LiOH-NCM的高频区的半圆曲率小,反映了LiOH-NCM材料有着低的电荷转移电阻(154 Ω),而所有样品位于低频区的直线斜率都很大,反映了它们的离子扩散电阻均较小。图3(b)是对应样品低频区Z'与ω−1/2的拟合曲线图。

Figure 3. (a) EIS curves; (b) Fitting curve of Z' and ω−1/2 in low frequency region of LiOH-NCM, LiAc-NCM and Li2CO3-NCM
图3. LiOH-NCM、LiAc-NCM和Li2CO3-NCM的(a) EIS测试图;(b)低频区Z'与ω−1/2拟合曲线图
以氢氧化锂为锂源的样品表现出了最好的性能,并且在所有充放电循环中比容量都明显高于其他两种锂源,而碳酸锂最差,乙酸锂介于两者之间。这一结果可能与焙烧制备过程中不同锂源的反应方式有关。在反应活性和反应温度方面,氢氧化锂优于碳酸锂。式(1)中的锂源为碳酸锂,式(2)中的锂源为氢氧化锂。
(1)
(2)
产物二氧化碳在反应方程式(1)影响了锂的实际反应比(锂对过渡金属M的摩尔比率)和其他因素。更重要的是,当材料表面有更多的Li2CO3,它分解和在循环过程中产生气体,这些产物被材料表面吸附导致活性物质与电解液接触不良,导致极化增强,循环性能变差。而LiOH-NCM的反应也存在较少类似的问题,性能最优。LiAc-NCM性能介于两者之间。
为了进一步测试LiOH-NCM材料电池内部的动力学过程,在0.1 mV∙s−1的扫描速率,2.7 V~4.6 V的电压范围之间进行循环伏安测试。图4展示了LiOH−NCM样品的循环伏安测试曲线。在图4中,在此电位扫描范围内可以观察到五组显著峰,每一个峰都对应一个变化过程。上曲线为氧化过程,Li+从LiNi0.8Co0.1Mn0.1O2晶格中脱嵌(脱嵌过程),下曲线为还原过程,Li+嵌入LiNi0.8Co0.1Mn0.1O2晶格中(插嵌过程)。材料在3.99 V处出现阳极峰,这代表Ni2+向Ni4+的转变对应着材料由初始的六方相向单斜相的转变(H1→M),这个阳极峰电位比起常规3.7 V左右的电位偏高的原因可能是这是LiOH-NCM材料的首次充放电,此时电极材料与电解液间的固液界面的副反应最为剧烈,另外,电化学极化也是造成这个现象的一个原因。但这个电位仍低于4.0 V,可能表明材料极化程度不太大。在之后的4.25 V出的阳极峰对应了材料单斜相相2第二六方相转变的过程(M→H2)。对于之后的放电过程,材料发生于充电时相逆的转变 [18] [19]。CV曲线中没有观察到接近3.2V的还原峰,说明不存在锰离子的还原(Mn4+/Mn3+) [20]。LiOH-NCM的CV曲线的主要氧化还原峰电位差较小,说明其极化程度较小。
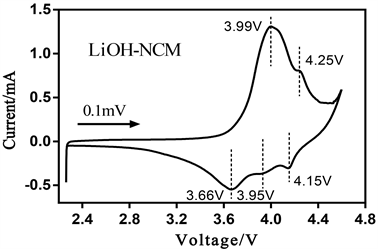
Figure 4. Cyclic voltammetry curves of LiOH-NCM (0.1 mVs−1, 2.7~4.6 V)
图4. LiOH-NCM材料的循环伏安测试图(0.1 mVs−1, 2.7~4.6 V)
3.2. ZnO包覆NCM材料性能分析
图5展示了不同包覆量下的Zn-NCM包覆改性材料的XRD谱图。在图5中,所有ZnO包覆样品的XRD图谱的(108)/(110)峰都观察到明显分裂,对于(006)/(012)劈裂峰,1.5%相比其余两种样品不够明显。总体来讲,微量ZnO的加入对LiNi0.8Co0.1Mn0.1O2的晶格结构破坏不大。从(003)峰的放大图可以看出,1.5% Zn-NCM与2.5% Zn-NCM样品的(003)峰位置重合,而0.5% Zn-NCM样品的(003)峰角度较低,说明较多Zn的加入改变了材料的晶格参数。
表2展示了由XRD图谱获得的三种样品晶格参数。所有Zn-NCM样品都有着大于4.9的c/a值,表明了样品较高的结晶度和很好的层状结构。其中1.5% Zn-NCM样品的c/a值最大,为4.941。I003/I104值随着ZnO包覆量的增加呈先上升后下降趋势,而1.5% Zn-NCM样品的值达到了1.639,表明其阳离子混合程度很低。
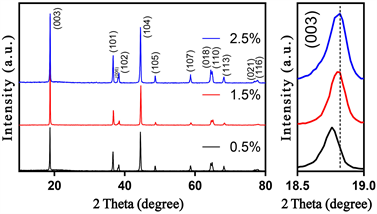
Figure 5. XRD patterns of different Zn-NCM materials
图5. 不同Zn-NCM材料的XRD图谱

Table 2. Lattice parameters and (003), (104) peak intensity ratios of the three materials under different ZnO coating
表2. 不同ZnO包覆量下三种材料的晶格参数和(003),(104)峰强度比值
图6为ZnO包覆NCM811样品的SEM图像。图6(a1)~(c1)分别为0.5% Zn-NCM、1.5% Zn-NCM、2.5% Zn-NCM放大6.5 k倍的SEM图像,图6(a2)~(c2)分别为0.5% Zn-NCM、1.5% Zn-NCM、2.5% Zn-NCM放大20 k倍的SEM图像。6.5 k倍放大图像表明,ZnO包覆后的NCM材料微观形貌仍为直径约十几微米的球状。在三张较高倍数放大的SEM图像中可以明显观察到小球表面模样随着ZnO包覆量的增加的变化。在包覆量较少时,如图6(a2)所示,小球表面布满了许多微小颗粒,但仍有一定数量材料本身一次颗粒间的缝隙被观察到;包覆量增加到1.5%时,材料本身一次颗粒间的缝隙被完全填满,整体呈现了更为光滑的外形;而当包覆量达到实验最大量3.5%时,小球的表面被更多的包覆材料所包裹,已经不易观察到材料本身的一次颗粒,而是许多条块状小块,说明此时包覆层厚度已经很大。
对包覆量为2.5%的样品2.5% Zn-NCM进行EDS mapping测试,所得结果如图7所示。可见ZnO成功均匀地包覆在了NCM811材料上。
将不同ZnO包覆量制备的Zn-NCM材料组装成扣式电池,在2.7 V~4.6 V的电压范围内进行电化学性能测试,电流密度均为0.1 C。图8(a)展示了所有Zn-NCM样品的循环性能。从图8中可以看到,包覆量最大的2.5% Zn-NCM样品在前几次充放电过程中出现了较为严重的衰减。而1.5% Zn-NCM和0.5% Zn-NCM一样衰减程度较低。1.5% Zn-NCM展示了三者中最佳的循环性能。其首次放电比容量达到了205 mAh∙g−1,在之后的充放电循环中衰减缓慢,在150次循环过后放电比容量为172.2 mAh∙g−1,容量保持率为84%。对比之下其余两种样品0.5% Zn-NCM、2.5% Zn−NCM的容量保持率为82%和79%。结果表明:ZnO包覆改善了NCM811材料的稳定性。实际上,ZnO包覆层可以与电解液中的HF反应形成Zn-O-F或Zn-F层,有效地抵抗了HF对活性物质的侵蚀。然而,随着涂层含量的过度增加(如:2.5% Zn-NCM),稳定性回落,这可能是由于ZnO涂层较厚,抑制了Li+的扩散。
图8(b)为包覆量1.5%的Zn-NCM与未包覆的NCM样品在2.7~4.6 V电压范围内0.1 C倍率下的循环性能对比图。我们可以直观地看出通过ZnO的包覆,材料的循环稳定性有了明显的提升。经过50次充放电循环后,包覆材料的容量保持率为94.5%,未包覆材料的容量保持率为87%。

Figure 6. SEM images of Zn-NCM (0.5% (a1, a2), 1.5% (b1, b2), 2.5% (c1, c2))
图6. Zn-NCM的SEM图像0.5% (a1, a2),1.5% (b1, b2),2.5% (c1, c2)

Figure 7. SEM and EDS mapping images of 2.5% Zn-NCM
图7. 2.5% Zn-NCM的SEM图像及EDS元素映射图像

Figure 8. (a) Cyclic performance diagram of Zn-NCM samples with different coating amounts; (b) 1.5% Zn-NCM and uncoated NCM
图8. (a)不同包覆量的Zn-NCM样品的循环性能图;(b) 1.5% Zn-NCM与未包覆的NCM
4. 结论
通过共沉淀法合成了三种不同锂源的LiNi0.8Co0.1Mn0.1O2正极材料。XRD图谱与SEM图像表明所有样品均具有良好的层状结构,结晶程度高,微观形貌无较大差异。循环性能测试结果表明,以LiOH为锂源的LiNi0.8Co0.1Mn0.1O2正极材料性能最好,在1 C的倍率下首次放电容量达到183.4 mAh∙g−1,结果30次循环后容量保持率为86%。交流阻抗的测试结果表明LiOH-NCM样品的电荷转移电阻最小,为Rct = 154 Ω。XRD对于Zn-NCM材料的测试结果表明ZnO的包覆并未对原始NCM811材料的晶体结构有所改变,从SEM图像与元素映射分析结果看,ZnO成功且均匀地包覆在了LiNi0.8Co0.1Mn0.1O2材料表明。循环性能测试结果表明,经过ZnO包覆的NCM材料循环稳定有明显提升,50次循环之后容量保持率上升了7.5%。而ZnO包覆材料的最佳包覆量为1.5%。
致谢
本文作者感谢国家自然科学基金52072250支持。