1. 引言
21世纪以来,社会经济的飞速发展的同时,化石能源等不可再生能源消耗剧增,随之带来的能源危机和环境污染引起了社会的广泛关注。氢气具有极高的能量密度,绿色环保的产物使其成为了未来替代传统化石能源的首选之一 [1] [2]。电驱动水分解制氢气是目前大规模制备氢气的主要方法,符合绿色环保、可持续发展的国家理念。电催化水分解过程,由两个半反应组成,包括阳极发生的四电子转移的析氧反应(OER)和阴极发生的双电子转移的析氢反应(HER)。其中四电子的OER过程中极大的反应能垒和缓慢的电子转移速率使其成为实现整体水分解的广泛应用中的主要瓶颈问题 [3] [4]。催化剂的使用可以有效缓解这些问题。如今,铱(Ir)、钌(Ru)及其氧化物被认为是催化OER最有效的催化剂 [5] [6]。然而,贵金属的自然储量低,使用成本高,大规模的应用会很大程度的增加氢能的生产成本,不利于氢能的发展。因此,开发环境友好,自然储量丰富,价格低廉和高性能电催化剂来替代贵金属催化剂对于电化学分解水的大规模应用具有重要意义。
近年来,廉价过渡金属基催化剂材料由于其优异的催化性能得到了广泛关注。其中,过渡金属层状氢氧化物则被认为是最具有潜力的OER电催化剂之一。α-Ni(OH)2是最早被发现具有OER电催化活性的氢氧化物材料,然而,到目前为止,其催化效率仍受到其较低的电导率和层状结构容易堆积的限制 [7]。随后大量研究工作者在此基础上对其展开了大量的研究,通过多种策略,如元素掺杂、异质复合等对其性能进一步优化 [4] [8]。此外,从材料催化反应界面的微观角度分析来看,高比表面积的材料由于在电解质中能够更大程度上接触电解质,进而具备更多的反应活性位点,也就是具备更高的电化学活性面积 [9] [10]。在各种纳米结构中,具有空心内部和分层纳米片结构的催化材料越来越受到研究人员的关注,因为垂直排列和中空纳米结构可以提供多维电子传递通道在促进质量传递的同时提升电催化反应动力学 [11]。同时,将具有可变氧化态的金属阳离子(如钴、铁、锰等)掺入α-Ni(OH)2中可以有效加速催化反应过程的电荷传递从而提升材料的OER活性 [12]。因此,构建具有精细纳米结构的多元素协同作用的氢氧化物材料被认为是耦合电导率增强和更多反应位点暴露的高效策略。
本文采用简单的ZnO模板法,合成了由Ni(OH)2纳米片组装而成的规则中空纳米管。接着,在合成过程中加入不同种类的第二类过渡金属盐溶液,制备了一系列镍基二元氢氧化物纳米管,其中Co,Fe,Mn的掺入不仅能够很好的维持规则中空纳米管结构,还能有效提高材料的催化性能。电化学测试结果表明,Fe的掺入对Ni(OH)2纳米管OER性能的提升最为显著,但是由于其表面纳米管堆积过于紧密,导致其电化学活性位点无法充分暴露,通过改变合成过程中的Fe源,可以有效的优化NiFe氢氧化物中空纳米管的表面形貌,提升其电化学活性面积,从而提升其OER性能。其中最佳的NiFe-82 LDHs-HNT-S在10 mA∙cm−2的电流密度下具有270.5 mV的低过电位和80.8 mV∙dec−1的Tafel斜率。
2. 实验步骤
2.1. ZnO纳米棒的制备
本研究使用的所有化学试剂和溶剂均为分析级,不需要进行额外的人工处理。首先通过简单的一步水热法合成了ZnO纳米棒。将1 mmol Zn(NO3)2∙6H2O和1 mmol Na2SO4溶于30 mL去离子水中,然后转移到高压反应釜中。随后,在不断搅拌下,滴入5 mL水合肼(80% v/v)溶液,磁力搅拌10 min。将反应釜在180℃的真空电热箱中加热24 h。待反应釜自然冷却至室温后,离心收集沉淀,然后用去离子水和乙醇洗涤3次,在60℃下干燥6 h,获得ZnO纳米棒。
2.2. ZnO@Ni(OH)2,ZnO@NiM (M = Co, Cr, Cu, Mn, Fe, V) LDHs的合成
通过水热共沉淀法,在ZnO纳米棒表面原位生长了Ni(OH)2,NiM (M = Co, Cr, Cu, Mn, Fe, V)氢氧化物纳米片。将1 mmol的ZnO纳米棒在室温下超声处理10分钟,使其完全分散在10 mL乙醇中。将1 mmol的NiCl2∙6H2O或者0.8 mmol NiCl2∙6H2O加0.2 mmol其他金属盐(CoCl2∙6H2O, CrCl3∙6H2O, CuCl2∙2H2O, MnCl2∙4H2O, FeCl2∙4H2O, FeSO4∙7H2O, VCl3)溶于20 mL的去离子水中,在不断搅拌的情况下,将均匀ZnO悬浮液滴加到上述混合溶液中。然后将混合溶液在油浴锅内80℃下加热5 h。冷却至室温后,离心收集沉淀物,然后用去离子水和乙醇洗涤3次,在60℃下干燥6 h。得到不同元素组成的ZnO@NiM LDHs核壳结构纳米管(CST),分别命名为:Ni(OH)2-CST,NiCo-82 LDHs-CST,NiCr-82 LDHs-CST,NiCu-82 LDHs-CST,NiMn-82 LDHs-CST,NiFe-82 LDHs-CST,NiV-82 LDHs-CST。其中利用FeCl2∙4H2O和FeSO4∙7H2O制备的NiFe-82 LDHs-CST分别命名为NiFe-82 LDHs-CST-C和NiFe-82 LDHs-CST-S。
具有不同元素比例的NiFe-LDHs核壳结构纳米管的制备方法与上述方法相同,NiCl2∙6H2O和FeSO4∙7H2O溶解在20 mL去离子水中,得到不同摩尔比的Ni/Fe/溶液(比例分别为9:1,8:2,7:3用于合成具有不同比例的ZnO@NiFe LDHs核壳结构纳米管,分别命名为:NiFe-91 LDHs-CST-S,NiFe-82 LDHs-CST-S,NiFe-73 LDHs-CST-S),同时溶液中金属离子总量相同(Ni2+ + Fe2+ = 1 mmol),然后,在不断搅拌的情况下,将均匀ZnO悬浮液滴加到上述混合溶液中。将上述混合溶液在油浴锅内80℃下加热5 h。冷却至室温后,离心收集沉淀物,然后用去离子水和乙醇洗涤3次,在60℃下干燥6 h。
2.3. Ni(OH)2,NiM (M = Co, Cr, Cu, Mn, Fe, V)氢氧化物中空纳米管的制备
Ni(OH)2,NiM (M = Co, Cr, Cu, Mn, Fe, V)氢氧化物中空纳米管通过模板刻蚀法制备。将制备好的Ni(OH)2-CST和NiM-82 LDHs-CST分别浸泡在4 mol/L KOH溶液中,持续搅拌1 h,离心收集剩余氢氧化物中空纳米管(HNT),然后用去离子水和乙醇洗涤3次,并在60℃下干燥6 h。得到的产物分别命名为Ni(OH)2-HNT,NiCo-82 LDHs-HNT,NiCr-82 LDHs-HNT,NiCu-82 LDHs-HNT,NiMn-82 LDHs-HNT,NiFe-82 LDHs-HNT,NiV-82 LDHs-HNT。其中利用FeCl2∙4H2O和FeSO4∙7H2O制备的NiFe-82 LDHs-HNT分别命名为NiFe-82 LDHs-HNT-C和NiFe-82 LDHs-HNT-S。不同元素比例的NiFe LDHs-HNT-S分别命名为NiFe-91 LDHs-HNT-S,NiFe-82 LDHs-HNT-S,NiFe-73 LDHs-HNT-S。
2.4. 材料结构表征
用XRD射线衍射仪(RIGAKU Miniflex 600 X,Cu-Kα射线,λ = 1.54178,工作电压为40 kV)研究了所制备产物的晶体结构。测试过程中扫描速率为4˚/min,扫描范围为2˚~80˚。通过扫描电子显微镜(FEI, Helios Nanolab 600i)和透射电子显微镜(FEI, Tecnai F20)对样品的表面形貌,微观结构以及元素组成和分布进行了分析。使用X射线光电子能谱仪(XPS, ESCALAB 250Xi)分析了样品的元素组成及价态。
2.5. 电化学性能测试
电解液的配制:本章电化学测试中用到的电解液均为1 mol∙L−1的KOH溶液。将0.1 mol (5.6 g) KOH溶解于100 mL去离子水中,在室温下搅拌均匀后测量其pH值,确定其pH值约为13.5。
工作电极的制备:将2.5 mg制备的催化剂粉末分散在体积比为1:1的水和乙醇的混合溶液中,然后滴加10 μL的Nafion (10 wt%)溶液确保催化剂粉末能很好地附着在电极上。然后将上述悬浮液通过超声波分散30 min后再磁力搅拌6 h以形成均匀的悬浮液。将0.2 mL悬浮液滴加在碳纤维纸上,在60℃的烘箱中烘干后催化剂最终负载量为0.5 mg∙cm−2。
本研究中所有的电化学测量均在CHI 760E电化学工作站(上海辰华仪器有限公司)上采用三电极系统进行,电解液为配制的1 mol/L的KOH溶液,工作电极为制备的负载待测催化剂样品的电极,参比电极为饱和Hg/HgO电极,对电极为碳棒。所有测量的电位相对于Hg/HgO的电位均通过以下等式(1)转换为相对于可逆氢电极(RHE)的电位:
(1)
循环伏安法(CV)用于活化并稳定电极材料,在0~0.8 V vs. Hg/HgO的电压区间以30 mV∙s−1的扫描速率测试CV曲线80圈,直到材料的循环伏安曲线趋于稳定,再进行接下来的测试。在线性扫描伏安法(LSV)测试中,均采用95%的iR自动补偿进行校正,在0~0.8 V vs. Hg/HgO的电压区间以5 mV∙s−1的扫描速率测定LSV曲线。析氧反应的过电位(
)通过公式(2)计算得出:
(2)
塔菲尔斜率(Tafel slope)通过公式(3)计算得出:
(3)
其中η为反应电位,a为常数,b为塔菲尔斜率,j为电流密度。
电化学活性表面积(ECSA)通过循环伏安图(CV)测量,测量的电位范围为0.3~0.4 V vs. Hg/HgO,扫描速率分别为20,30,∙∙∙,80 mV∙s−1。然后,通过绘制0.35 V vs. Hg/HgO的
(其中ja和jc分别为此电压下对应的阳极和阴极的电流密度)与扫描速率的关系图,拟合直线的斜率是两倍的双层电容Cdl,Cdl用于表示所测材料的ECSA。通过ECSA值对LSV图进行归一化,Jspecific由公式(4)计算得出:
(4)
其中I是OER电流,Scatalyst和Sgeo分别是催化剂的实际活性表面积和电极的几何面积,Rf是粗糙因子,通过将Cdl除以60 μF∙cm−2得到。电化学阻抗谱(EIS)是在5 mV的交流电压下,在0.1~100,000 Hz的频率范围内进行测定。
3. 结果分析
3.1. 二元镍基氢氧化物的形貌调控及物相分析
图1 显示了所制备的中空纳米管刻蚀前后的粉末X射线衍射(XRD)图谱。图1(a)中可以观察到,与ZnO纳米棒的标准PDF卡片相比,在Ni(OH)2-CST,NiCo-82 LDHs-CST,NiCr-82 LDHs-CST,NiFe-82 LDHs-CST,NiMn-82 LDHs-CST的XRD图谱中可以观察到典型LDHs的(003),(006),(012)和(110)衍射峰,这表明LDHs在ZnO纳米棒上的成功制备。从图中可以观察到NiCu-82 LDHs-CST和NiV-82 LDHs-CST的XRD图没有目标相的形成。如图1(b)所示,经过高浓度的KOH溶液刻蚀后的材料的XRD图谱中可以观察到ZnO峰的消失,表明ZnO被成功刻蚀。与Ni(OH)2-HNT相比,NiM LDHs-HNT的(003)峰均有不同程度的向较低角度的移动,这是由于其他过渡金属原子取代了Ni(OH)2晶格中的Ni原子所引起的,表明其他过渡金属原子成功的掺入Ni(OH)2晶格中。
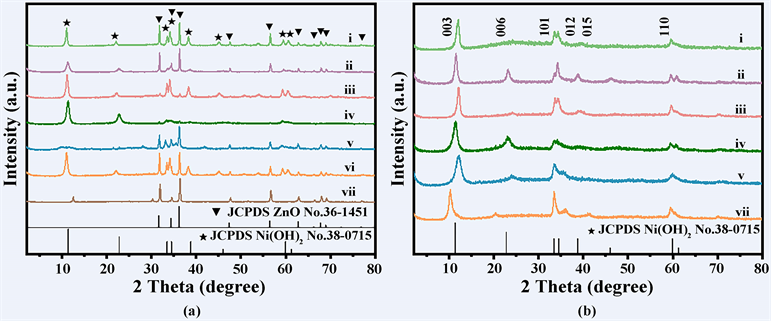
Figure 1. (a) XRD pattern of i) Ni(OH)2-CST; ii) NiFe-82 LDHs-CST; iii) NiCo-82 LDHs-CST; iv) NiCr-82 LDHs-CST; v) NiCu-82 LDHs-CST; vi) NiMn-82 LDHs-CST; vii) NiV-82 LDHs-CST. (b) XRD pattern of i) Ni(OH)2-HNT, ii) NiFe-82 LDHs-HNT, iii) NiCo-82 LDHs-HNT, iv) NiCr-82 LDHs-HNT, v) NiCu-82 LDHs-HNT;vi) NiMn-82 LDHs-HNT
图1. (a) i) Ni(OH)2-CST;ii) NiFe-82 LDHs-CST;iii) NiCo-82 LDHs-CST;iv) NiCr-82 LDHs-CST;v) NiCu-82 LDHs-CST;vi) NiMn-82 LDHs-CST;vii) NiV-82 LDHs-CST的XRD衍射谱。(b) i) Ni(OH)2-HNT;ii) NiFe-82 LDHs-HNT;iii) NiCo-82 LDHs-HNT;iv) NiCr-82 LDHs-HNT;v) NiCu-82 LDHs-HNT;vi) NiMn-82 LDHs-HNT的XRD衍射谱
图2(b)显示了Ni(OH)2-CST的扫描电子显微镜(SEM)图像。相较于原来的ZnO纳米棒(图2(a)),纳米管的直径明显增加,表面整齐且均匀的覆盖了一层鱼鳞状的超薄纳米片。高浓度KOH溶液处理后的Ni(OH)2-HNT的SEM图像如图2(c)和图2(d)所示,高浓度的KOH并没有破坏纳米管的表面形貌。同时,图2(d)中可以通过纳米管的横截面明显观察到其内部的中空结构。可以看出Ni(OH)2-HNT具有较厚的管外壁,且具有直径约为1 μm左右的六边形状中空结构。同时,图3显示了不同元素组成的NiM-82 LDHs-HNT的扫描电子显微镜图像,如图3(a)所示,NiFe-82 LDHs-HNT由花瓣状的氢氧化物纳米片垂直组装而成,相较于Ni(OH)2,NiFe氢氧化物纳米片的厚度明显减小,纳米管的粗糙度明显提升,高浓度的KOH处理同样没有对氢氧化物纳米管的表面形貌造成影响。如图3(b)展示了NiCo-82 LDHs-HNT的SEM图像,NiCo-82 LDHs-HNT表面由六方片状的纳米片堆叠而成,且纳米管的长度和直径明显减小。如图3(d)所示,Mn的掺入对纳米管的形貌的影响较小,NiMn-82 LDHs-HNT和单金属的Ni(OH)2-HNT具有类似的表面形貌。而如图3(c)所示,Cr的掺入完全的破坏了原有的纳米管结构。Ni(OH)2-HNT和NiM-82 LDHs-HNT的EDX谱的元素含量如表1所示,NiCo-82 LDHs-HNT中Ni,Co的比例相较于合成时的原料掺入比相差不大。而Mn的掺入比例较小,所以对纳米管的形貌影响较小。相较于原料掺入比NiFe-82 LDHs-HNT中Fe的比例明显增大。由于FeCl2不稳定容易被氧化成FeCl3,而Fe(OH)3的溶度积(Ksp)较小,相较于Ni2+,Fe3+更容易沉淀,ZnO水解过程中,Fe3+先与氢氧根离子在纳米棒表面形成沉淀,所以产物中Fe的含量明显增多。

Figure 2. SEM image of (a) ZnO nanorod; (b) Ni(OH)2 LDHs-CST; (c) and (d) Ni(OH)2 LDHs-HNT with different magnification
图2. (a) ZnO纳米棒;(b) Ni(OH)2-CST;(c)和(d)不同扫描倍率下Ni(OH)2-HNT的SEM图像

Figure 3. SEM image of (a) NiFe-82 LDHs-HNT, (b) NiCo-82 LDHs-HNT, (c) NiCr-82 LDHs-HNT and (d) NiMn-82 LDHs-HNT
图3. (a) NiFe-82 LDHs-HNT,(b) NiCo-82 LDHs-HNT,(c) NiCr-82 LDHs-HNT和(d) NiMn-82 LDHs-HNT的SEM图像

Table 1. The elemental contents of EDX spectrum for Ni(OH)2-HNT and NiM-82 LDHs-HNT
表1. Ni(OH)2-HNT和NiM-82 LDHs-HNT的EDX谱的元素含量
3.2. 二元镍基氢氧化物中空纳米管电催化OER性能研究
在室温下使用标准三电极系统在1M KOH溶液中研究了所制备电催化剂的OER电催化性能。首先对比了具有不同元素组成的NiM-82 LDHs-HNT的电化学性能,图4(a)展示的LSV曲线结果表明,Ni(OH)2-HNT、NiFe-82 LDHs-HNT、NiCo-82 LDHs-HNT和NiMn-82 LDHs-HNT的过电位分别为463.5 mV、316.5 mV、387.5 mV和402.5 mV。这说明第二元素的掺杂能够有效降低Ni(OH)2中空纳米管的过电位,其中掺入Fe对于OER性能的提升最明显。Tafel斜率可以很好地反映催化剂OER动力学过程,同样是评价催化剂的OER性能的重要参数之一。图4(c)中的结果表明NiCo-82 LDHs-HNT具有最低的Tafel斜率,为91.1 mV∙dec−1,而Ni(OH)2-HNT、NiFe-82 LDHs-HNT和NiMn-82 LDHs-HNT的Tafel斜率分别为150.1 mV∙dec−1、102.3 mV∙dec−1和99.7 mV∙dec−1。电化学交流阻抗谱(EIS)可以进一步反映材料的催化动力学和电导率。图4(d)展示了催化剂的奈奎斯特曲线图,并且通过图4(d)中的等效电路进行拟合,其中NiFe-82 LDHs-HNT展现出最小的半圆直径,表明了反应过程中更快的电子转移。通过图5展示的不同扫描速度下的CV曲线可以得出材料的双电层电容(Cdl),结果如图4(e)所示,NiFe-82 LDHs-HNT的线性斜率为55.74 μF∙cm–2,相较于Ni(OH)2-HNT (91.54 μF∙cm–2)、NiCo-82 LDHs-HNT (73.28 μF∙cm–2)和NiMn-82 LDHs-HNT (81.88 μF∙cm–2)较低,结合其较高的Tafel斜率,说明其虽然具有较低的过电位,但是其动力学却更缓慢,可能的原因是其空间结构不具备优势。为了研究催化剂的固有活性,通过ECSA对LSV曲线进行了归一化,从而排除空间结构对其总体性能的干扰,结果如表2所示。显然,NiFe-82 LDHs-HNT在1.5 V vs. RHE的电位下显示出最高的电流密度(4.53 mA∙cm–2),而Ni(OH)2-HNT、NiCo-82 LDHs-HNT和NiMn-82 LDHs-HNT,在1.5 V vs. RHE的电位下的电流密度分别为0.24 mA∙cm–2,0.44 mA∙cm–2和0.34 mA∙cm–2,表明在排除电化学活性面积的影响之后,NiFe-82 LDHs-HNT具有最高的电化学活性。同时图4(f)中归一化后的LSV图进一步的支撑了这一观点,虽然NiFe-82 LDHs-HNT电化学活性面积较低,但是由于Ni与Fe之间良好的协同作用,单位面积内的活性位点具有更高的固有活性,相较于其他三种中空纳米管具有明显的优势,因此表现出最佳的OER催化活性。
3.3. 镍铁氢氧化物中空纳米管元素比例及空间结构优化
从表1中可以看出,使用FeCl2作为铁源会导致合成材料中的铁元素含量过大,进而导致空间结构受到影响。为了解决这一问题,在制备过程中将铁源换成了更加稳定的FeSO4∙7H2O。图6(a)所示的XRD结果显示两种铁源制备得到的镍铁氢氧化物中空纳米管的结构一致。图6(b)和图6(c)分别显示了NiFe-82 LDHs-HNT-C和NiFe-82 LDHs-HNT-S的SEM图,从图中可以看出NiFe-82 LDHs-HNT-S主要由具有不规则形状的纳米片组成,相较于NiFe-82 LDHs-HNT-C,NiFe-82 LDHs-HNT-S表面的纳米片的堆积更加松散,这样的结构在反应过程中可以提供更多的电化学活性位点,同时更有利于电解质的渗透和气体

Figure 4. Electrochemical measurement results of Ni(OH)2-HNT, NiFe-82 LDHs-HNT, NiCo-82 LDHs-HNT and NiMn-82 LDHs-HNT (a) LSV plots; (b) Overpotential at 10 mA∙cm−2; (c) Tafel plots; (d) Nyquist plots obtained at 1.445 V vs. RHE; (e) Current density differences at 0.35 V vs Hg/HgO plotted against the scan rate; (f) LSV plots normalized by ECSA values
图4. Ni(OH)2-HNT、NiFe-82 LDHs-HNT、NiCo-82 LDHs-HNT和NiMn-82 LDHs-HNT的电化学测量结果(a) LSV曲线图;(b) 10 mA∙cm−2的电流密度下的过电位图;(c) 塔菲尔斜率图;(d) 在电压1.445 V vs. RHE下测得的奈奎斯特曲线;(e) 0.35 V vs. Hg/HgO的电流密度差异与扫描速率的关系图;(f) 由ECSA值归一化的LSV图
产物的扩散。表1中显示了NiFe-82 LDHs-HNT-S的EDS的元素含量,在更换铁源后,纳米管中Ni和Fe的比例与8:2相差不大,表明通过更换铁源,可以有效的解决纳米管制备过程中Fe2+容易被氧化提前沉淀导致纳米管中Fe含量过高的问题。NiFe-82 LDHs-HNT-S的透射电子显微镜(TEM)图像如图6(d)和图6(e)所示,图中可以明显的观察到纳米管具有明显的中空结构,且表面由超薄的纳米片堆积而成,高分辨率透射电镜(HRTEM)图像(图6(f))显示了平面间距为0.197 nm的晶格条纹,对应于NiFe-LDH的(018)晶面(JPCDS NO.40-0215)。同时,图6(f)左上角的选区电子衍射(SAED)图中显示出两个不同的衍射环,分别对应于NiFe-82 LDHs-HNT-S的(012)和(110)晶面。图6(g)显示了NiFe-82 LDHs-HNT-S的元素分布图谱,可以看出Ni,Fe和O元素在整根NiFe-82 LDHs-HNT-S上均匀分布。
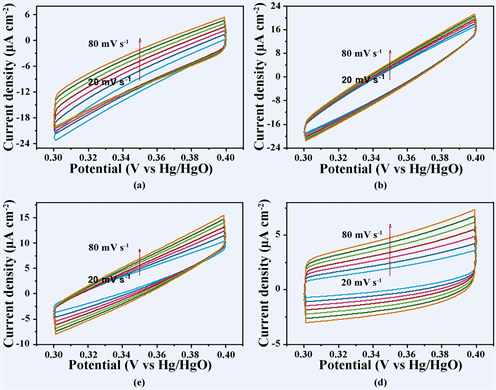
Figure 5. The Cycle voltammograms (CV) curves of (a) Ni(OH)2-HNT; (b) NiFe-82 LDHs-HNT; (c) NiCo-82 LDHs-HNT; (d) NiMn-82 LDHs-HNT at 0.3~0.4 V vs. Hg/HgO
图5. (a) Ni(OH)2-HNT;(b) NiFe-82 LDHs-HNT;(c) NiCo-82 LDHs-HNT;(d) NiMn-82 LDHs-HNT在0.3~0.4 vs. Hg/HgO的电势范围内不同扫速下测得的循环伏安图(CV)曲线
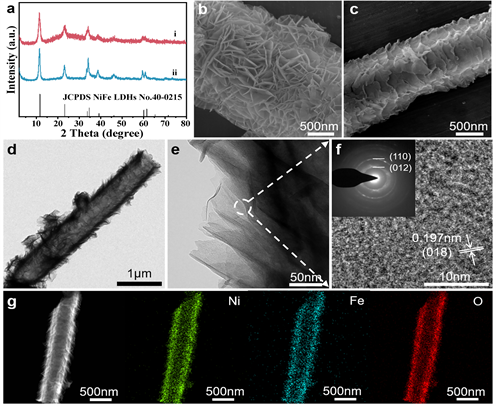
Figure 6. (a) XRD pattern of i) NiFe-82 LDHs-HNT-S, ii) NiFe-82 LDHs-HNT-C; (b) SEM images of NiFe-82 LDHs-HNT-C; (c) SEM images of NiFe-82 LDHs-HNT-S; (d) and (e) TEM images of NiFe-82 LDHs-HNT-S with different magnification; (f) HRTEM and SAED images of NiFe-82 LDHs-HNT-S; (g) elemental mapping images of NiFe-82 LDHs-HNT-S
图6. (a) NiFe-82 LDHs-HNT-C和NiFe-82 LDHs-HNT-S的XRD图谱;(b) NiFe-82 LDHs-HNT-C的扫描电镜图像;(c) NiFe-82 LDHs-HNT-S的扫描电镜图像;(d)和(e)具有不同放大倍率的NiFe-82 LDHs-HNT-S的透射电镜图像;(f) NiFe-82 LDHs-HNT-S的高分辨率透射电镜(HRTEM)和选区电子衍射(SAED)图像;(g) NiFe-82 LDHs-HNT-S的元素映射图像

Table 2. Electrochemical analysis of Ni(OH)2-HNT, NiFe-82 LDHs-HNT, NiCo-82 LDHs-HNT, NiMn-82 LDHs-HNT and their intrinsic activities toward OER
表2. Ni(OH)2-HNT、NiFe-82 LDHs-HNT、NiCo-82 LDHs-HNT和NiMn-82 LDHs-HNT的电化学分析及其对于OER过程的内在活性
采用X射线光电子能谱(XPS)方法对NiFe-82 LDHs-HNT-C和NiFe-82 LDHs-HNT-S的元素组成和表面的化学状态进行了研究。高分辨率XPS Ni 2p光谱如图7(a) 所示,可以观察到位于873.2 eV的Ni 2p1/2的峰和位于855.7 eV的Ni 2p3/2的峰表明了Ni2+的存在,而另外两个分别位于874.5 eV和856.8 eV的Ni 2p1/2和Ni 2p3/2特征峰与文献报道中的Ni3+的XPS结果相吻合 [13] [14],表明了纳米管中三价Ni离子的存在。在NiFe-82 LDHs-HNT-S的Fe 2p光谱中(图7(b)),Fe 2p1/2和Fe 2p3/2的特征峰分别位于725.7 eV和712.5 eV处出现,表明NiFe-82 LDHs-HNT-S中存在Fe3+ [15] [16]。与NiFe-82 LDHs-HNT-C相比,NiFe-82 LDHs-HNT-S的XPS图谱没有明显的变化,表明铁源的改变并没有对纳米管表面的化学态产生影响。
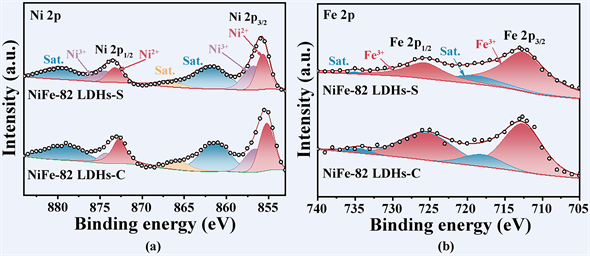
Figure 7. High-resolution XPS spectra of NiFe-82 LDHs-HNT-C and NiFe-82 LDHs-HNT-S: (a) Ni 2p and (b) Fe 2p
图7. NiFe-82 LDHs-HNT-C和NiFe-82 LDHs-HNT-S高分辨XPS光谱:(a) Ni 2p和(b) Fe 2p
3.4. 镍铁氢氧化物中空纳米管性能优化
随着合成中铁源的更换,镍铁中空纳米管的元素比例和空间结构得到优化,其OER催化性能也得到进一步优化。图8(a)和图8(b)展示了不同铁源的NiFe-82 LDHs-HNT的LSV图和Tafel图。可以看出,NiFe-82 LDHs-HNT-S,在10 mA∙cm−2的电流密度下过电位为270.5 mV,并且Tafel斜率降低至80.8 mV∙dec−1,催化性能相较于NiFe-82 LDHs-HNT-C有显著提升。图8(c)展示了两种NiFe-82 LDHs-HNT的电化学交流阻抗谱(EIS),NiFe-82 LDHs-HNT-S展现出更小的半圆半径,表明了更低的电荷转移电阻和更快的电子传输速度。图8(e)显示,NiFe-82 LDHs-HNT-S和NiFe-82 LDHs-HNT-C的Cdl分别为106.52 μF∙cm–2和55.74 μF∙cm–2,表明具有更松散的结构的NiFe-82 LDHs-HNT-S具有更大的电化学活性面积,可以在反应过程中提供更多的活性位点。ECSA归一化的LSV (图8(f))可以看到,两种NiFe-82 LDHs-HNT归一化后的LSV曲线近似重合,说明了二者的固有活性没有明显的差异。电化学测试结果表明,改变铁源主要是通过调整纳米管中的镍铁比,通过调整中空纳米管的表面形貌,新颖的中空纳米管结构和大的电化学活性面积,有利于电解质的进入,不受产物的扩散限制,气体产物也能更快的释放,从而导致更高的电化学活性。

Figure 8. Electrochemical measurement results of NiFe-82 LDHs-HNT-S and NiFe-82 LDHs-HNT-C (a) LSV plots; (b) Tafel plots; (c) Nyquist plots obtained at 1.445 V vs. RHE; (d) Current density differences at 0.35 V vs Hg/HgO plotted against the scan rate; (e) The Cycle voltammograms (CV) curves of NiFe-82 LDHs-HNT-S at 0.3~0.4 V vs. Hg/HgO; (f) LSV plots normalized by ECSA values.
图8. NiFe-82 LDHs-HNT-S和NiFe-82 LDHs-HNT-C的电化学测量结果(a) LSV曲线图;(b) 塔菲尔斜率图;(c) 在电压1.445 V vs. RHE下测得的奈奎斯特曲线;(d) 0.35 V vs. Hg/HgO的电流密度差异与扫描速率的关系图;(e) NiFe-82 LDHs-HNT-S在0.3~0.4 V vs. Hg/HgO的电势范围内不同扫速下测得的循环伏安图(CV)曲线;(f) 由ECSA值归一化的LSV图
最后,为了确定最佳成分比例,我们研究了不同金属元素比下的NiFeLDHs-HNT-S的电化学性能。如图9所示,NiFe氢氧化物中空纳米管材料的OER性能与Ni,Fe元素比有关,在3种具有不同Ni,Fe元素比的氢氧化物中空纳米管材料中,NiFe-82 LDHs HNT-S显示出最佳的OER电化学活性,在10 mA∙cm−2的电流密度下展现出最低的过电位,NiFe-91 LDHs HNT-S和NiFe-73 LDHs HNT-S的过电位分别为290.5 mV和309.5 mV,同时NiFe-82 LDHs HNT-S也展现出最低的塔菲尔斜率。表明NiFe-82 LDHs HNT-S具有最有利的反应动力学。
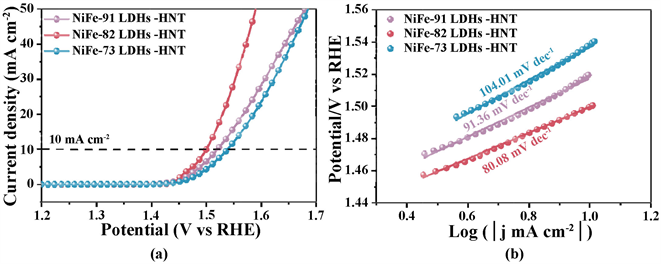
Figure 9. Electrochemical measurement results of NiFeLDHs-HNT-S (a) LSV plots; (b) Tafel plots
图9. 不同元素比例的NiFeLDHs-HNT-S的电化学测量结果(a) LSV曲线图;(b)塔菲尔斜率图
4. 结论
总之,本文通过简单地模板法制备了一系列具有不同元素组成的二元中空结构氢氧化物纳米管,不同过渡金属元素的掺杂对于Ni(OH)2纳米管的电催化性能均有显著的提升,其中Fe的掺入对于OER性能的提升最明显。虽然,相较于其他的二元氢氧化物纳米管NiFe-82 LDHs-HNT的电化学活性面积较低,但是由于其单位面积内的活性位点具有更高的固有活性,因此表现出有竞争力的电催化活性。通过改变合成过程中的铁源,可以提升电化学活性面积从而优化NiFe-82 LDHs-HNT的电催化性能,NiFe-82 LDHs-HNT-S仅需要270.5 mV的过电势就能实现10 mA∙cm−2的电流密度,同时表现出80.8 mV∙dec−1的低Tafel斜率。这种构架同时具备热力学和动力学优势的催化剂的策略为电催化水分解的发展提供了一个可供选择的方向。
基金项目
国家自然科学基金项目(51874357和U20A20123)。