摘要: 目的:研究SII、PNI与晚期胃癌患者免疫检查点抑制剂(Immune checkpoint inhibitors, ICIs)治疗疗效及预后的关系。方法:选取2018年1月~2021年5月在青岛大学附属青岛市市立医院接受ICIs (主要为PD-1/PD-L1抑制剂)治疗的晚期胃癌患者65例。以各组中位数为SII、PNI截断值,根据是否大于截断值将患者分为低SII、PNI组及高SII、PNI组。比较两组患者免疫治疗后的疾病控制率(DCR)及无进展生存时间(PFS)。结果:65例入组患者的中位年龄为64岁,其中男性45例,女性20例。SII、PNI的截断值分别为563.3、43.2 ng/mL,其中低SII组32例,高SII组33例,低PNI组32例,高PNI组33例。高、低值组SII的DCR分别为51.5%、71.9%,治疗前SII水平与DCR之间不具有相关性(P > 0.05)。高、低值组PNI的DCR分别为75.8%、46.9%,PNI水平与DCR之间具有相关性(P < 0.05)。低SII、高PNI预示ICIs治疗的晚期胃癌患者较长的PFS (SII的HR = 0.407,95% CI:0.179~0.925,P = 0.032;PNI的HR = 3.438,95% CI:1.466~8.062,P = 0.005)。多因素分析结果显示,SII、PNI是PFS的独立风险因素(P < 0.05)。结论:SII、PNI可以预测晚期胃癌患者免疫治疗的疗效及预后,未来有望成为新的预测指标。
Abstract:
Objective: To investigate whether SII, PNI are associated with Immune checkpoint inhibitors (ICIs) efficacy in patients with advanced gastric cancer. Methods: 65 patients with advanced gastric cancer who were treated with Immune checkpoint inhibitors (ICIs) at Qingdao Municipal Hospital affiliated to Qingdao University from January 2018 to May 2021 were enrolled in this retrospective study. The optimal cut-off values of SII, PNI for predicting efficacy and prognosis were determined accord-ing to the median of each group. Disease Control Rate (DCR) and Progression Free Survival (PFS) were calculated and compared using Kaplan-Meier method and log-rank test. Results: The median age of the 65 patients was 64 years old, including 45 males and 20 females. The optimal cut-off val-ues of SII/PNI were 563.3 and 43.2 ng/mL, respectively. 32 patients were in the low SII group, and 33 patients were in the high SII group, 32 patients were in the low PNI group, and 33 patients were in the high PNI group. The DCR of SII in high and low value groups was 51.5% and 71.9% respec-tively, and there was no correlation between SII level and DCR (P > 0.05). The DCR of PNI in high and low value groups was 75.8% and 46.9%, and there was a correlation between PNI level and DCR (P < 0.05). Low SII and high PNI were associated with longer PFS (HR for SII = 0.407, 95% CI: 0.179~0.925, P= 0.032; HR for PNI = 3.438, 95% CI: 1.466~8.062, P = 0.005). The results of multi-variate analysis showed that SII and PNI were independent risk factors for PFS (P < 0.05). Conclu-sion: SII and PNI can predict the efficacy and prognosis of immunotherapy in patients with ad-vanced gastric cancer, and are expected to be new predictors in the future.
1. 引言
胃癌是我国最常见的消化道恶性肿瘤,在全球范围内发病率居第5位,同时是癌症相关死亡的第3大原因 [1]。不能切除的晚期或转移性胃癌的治疗方式主要包括放疗、化疗、分子靶向治疗等。近年来,免疫治疗在多种实体瘤中取得巨大的进展,而免疫治疗在胃癌治疗领域也不断向前线推进,已成为一项新策略。目前,PD-L1表达、微卫星不稳定性(Microsatellite instability, MSI)和肿瘤突变负荷(Tumor mutational burden, TMB)被用于筛选可能受益于ICIs的患者,但由于其检测费用昂贵、检测平台不同、缺乏统一的阳性阈值等原因,它们并不是理想的生物标志物 [2]。因此寻找具有预测价值的生物标志物,筛选获益人群显得尤为重要。
炎症是肿瘤微环境的一个重要特征,与各种类型肿瘤的预后不良相关 [3]。血液学炎症参数如中性粒细胞、淋巴细胞、血小板等可以反映免疫状态,对肿瘤的预后预测有重要的价值。系统免疫炎症指数(systemic immune inflammation index, SII)是综合外周血淋巴细胞、中性粒细胞和血小板计数衍生出的炎症标志物,在小细胞肺癌、食管癌、结直肠癌等患者中,系统免疫炎症指数(SII)已被证明是一个有用的预后指标 [4] [5] [6]。预后营养指数(prognostic nutritional index, PNI)可以反映机体的营养与免疫状态,许多研究表明PNI状态可以预测多种肿瘤的预后,包括肺癌 [7]、胃癌 [8]、结直肠癌 [9] 等,然而目前晚期胃癌患者ICIs治疗疗效及预后与SII、PNI之间的关系仍然不确定,故本研究对其予以探讨。
2. 资料和方法
2.1. 资料
回顾性分析自2018年1月~2021年5月在青岛大学附属青岛市立医院接受ICIs治疗的晚期胃癌患者临床资料。该研究获青岛市市立医院伦理委员会批准。入组标准:病理组织学明确诊断为胃癌;临床分期为III-IV期;接受过至少2个周期的ICIs治疗。排除标准:同时合并有第二原发肿瘤;免疫治疗前严重感染及对外周血中性粒细胞、淋巴细胞等产生严重影响的其他血液系统疾病;免疫治疗前血常规、生化等数据缺失;严重心肌损伤或骨骼肌疾病;失访。
2.2. 治疗方法
所有患者均接受至少2个周期单纯免疫治疗或免疫治疗联合化疗、靶向治疗。免疫治疗主要为 PD-1/PD-L1抑制剂。每2周期免疫治疗后行影像学评估。
2.3. 观察指标
所有胃癌患者以电话或门诊方式进行随访,随访时间自应用免疫治疗之日起,截止至2021年9月30日,中位随访时间8个月(3~16个月)。统计免疫治疗前1周内最近1次的血常规和生化等临床资料。疗效评估按照WHO实体瘤评价标准1.1 (RECIST1.1)进行评价。无进展生存时间(PFS)定义为从开始接受ICIs治疗到疾病发生进展、死亡或随访截止时间。疾病控制率(DCR) = (CR + PR + SD)/总例数 × 100%;SII = 血小板计数 × 中性粒细胞计数/淋巴细胞计数;PNI = 血清白蛋白(g/L) + 5 × 淋巴细胞计数(109/L)。
2.4. 统计学分析
本研究原始数据采用Excel计算SII、PNI中位数来进行分组,余数据采用SPSS26.0软件进行统计分析,计数资料采用χ2检验,Kaplan-Meier法绘制患者生存曲线,采用单因素Cox回归分析影响患者PFS的相关因素,考虑本研究为小样本研究,将P < 0.1的因素纳入多因素COX比例风险回归模型。P < 0.05为差异有统计学意义。
3. 结果
3.1. 一般资料
最终符合入组条件的有65例患者,其中男性45例,女性20例;年龄 < 64岁38例,≥64岁27例 ;肿瘤分期、转移器官数目、免疫治疗前是否接受过胃癌切除术、免疫治疗的线数、是否联合治疗、PD-L1等情况见表1。PD-L1因数据缺失共收集54例。

Table 1. Baseline characteristics of patients
表1. 患者基线信息
3.2. SII、PNI与免疫治疗疗效及预后的关系
1) 在纳入SII高值组的33例患者中,有2名经历了PR,15名经历了SD,而16名经历了PD。在纳入SII低值组的32例患者中,有4名经历了PR,19名经历了SD,而9名经历了PD。通过卡方检验相关分析,高、低值组SII的DCR分别为51.5%、71.9%,治疗前SII水平与DCR之间不具有相关性(P > 0.05)。在纳入PNI高值组的33例患者中,有5名经历了PR,20名经历了SD,而8名经历了PD。在纳入PNI低值组的32例患者中,有2名经历了PR,13名经历了SD,而17名经历了PD。通过卡方检验相关分析,高、低值组PNI的DCR分别为75.8%、46.9%,PNI水平与DCR之间具有相关性(P < 0.05)。见表2。
2) 通过卡方检验分析,SII、PNI水平与PD-L1水平均不具有相关性(P值分别为0.914和0.132)。具体见表3。
3) 通过卡方检验分析,SII、PNI水平与治疗方案均不具有相关性(P值分别为0.702和0.267)。具体见表4。
4) 利用Kaplan-Meier法对患者PFS进行生存分析后发现,高SII组mPFS为8个月,低SII组mPFS未达到(P = 0.023)。低PNI组mPFS为8.0个月,高PNI组未达到mPFS (P = 0.002)。SII、PNI水平与患者PFS具有相关性。两组的生存曲线见图1、图2。
3.3. 影响PFS的单因素和多因素分析
单因素生存分析比较结果显示:治疗方案、PD-L1、PNI均与患者PFS呈正相关(P均<0.05),SII与患者PFS呈负相关(P < 0.05),有统计学意义。将治疗方案、PD-L1、PNI、SII纳入多因素Cox分析结果显示:SII、PNI是晚期胃癌患者免疫治疗预后生存的独立影响因素(P均<0.05)。具体见表5。

Table 2. The association between SII, PNI and DCR
表2. SII、PNI与DCR之间的关联

Table 3. The association between SII, PNI and PD-L1
表3. SII、PNI与PD-L1之间的关联

Table 4. The association between SII、PNI and Therapy
表4. SII、PNI与治疗方案之间的关联

Figure 1. Kaplan-Meier plots of progression-free survival of gastric cancer patients in the high and low SII groups
图1. SII高组和低组胃癌患者PFS生存曲线
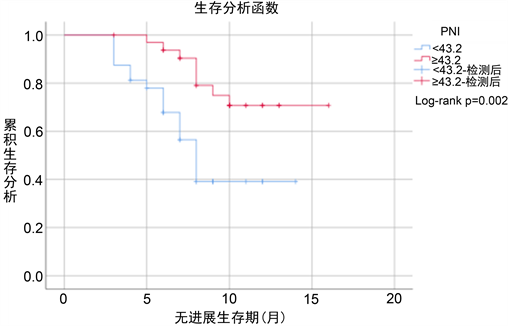
Figure 2. Kaplan-Meier plots of progression-free survival of gastric cancer patients in the high and low PNI groups
图2. PNI高组和低组胃癌患者PFS生存曲线

Table 5. PFS的单因素和多因素Cox回归分析
表5. 影响胃癌患者PFS的单因素和多因素Cox回归分析
4. 讨论
炎症与肿瘤的发生和转移密切相关,机体的免疫和营养状况是炎症反应的重要组成部分。因此,越来越多的研究关注炎症和营养在肿瘤微环境中的作用。系统免疫炎症指数(SII)是综合中性粒细胞、血小板和淋巴细胞计数的炎症指数,有研究报道了SII在接受免疫治疗的患者生存中的重要性 [10]。Ugo De Giorgi等证实 [11],SII和BMI是接受纳武利尤单抗治疗的肾细胞癌(RCC)患者OS的关键预后因素。同样,对于接受纳武利尤单抗治疗的转移性非小细胞肺癌(NSCLC)患者,SII、中性粒细胞与淋巴细胞比率(NLR)和血小板与淋巴细胞比率(PLR)也是可以预测ICIs治疗疗效及预后的潜在生物标志物 [12]。本研究结果显示,高、低值组SII的DCR分别为51.5%、71.9%,治疗前SII水平与DCR之间不具有相关性(P > 0.05),但是SII < 563.3 ng/mL时的Mpfs (8月vs.未达到,P = 0.023)更长,同时是晚期胃癌患者免疫治疗的独立预后因素,与之前研究结果相似。
PNI由白蛋白和淋巴细胞计算得出,反映机体营养及免疫状况。对于PNI在免疫治疗患者的预后方面,彭等研究显示 [13] PNI ≥ 45的患者mPFS (6.3月vs. 3.3月)和mOS (11.5月vs. 4.2月)更好,且是晚期 NSCLC患者ICIs治疗的独立预后因素。另外,罗等指出 [14] 治疗前的PNI水平与ORR无显著相关,但治疗前较高PNI水平预示对ICIs治疗疗效相对更佳。本研究发现高、低值组PNI的DCR分别为75.8%、46.9%,PNI水平与DCR之间具有相关性(P < 0.05),较高PNI患者的PFS更长,且是晚期胃癌患者免疫治疗的独立预后因素。
PD-L1 (B7-H1)属于B7超家族,通过与CD28免疫球蛋白超家族的PD-1结合来调节T细胞功能,实现肿瘤的免疫逃逸 [15]。目前PD-L1是预测免疫治疗预后常用的生物标志物,而PD-L1表达与预后的关系在胃癌中仍存在很大争议。在KEYNOTE-059试验中 [16],PD-L1高表达(定义为CPS ≥ 1)的患者具有更高的ORR (15.5% vs. 6.4%),该组的PFS和OS也更长。本文中PD-L1高表达时患者预后改善,并首次将PD-L1与SII、PNI相联系,遗憾的是,结果提示SII、PNI与PD-L1无相关性,但本文中PD-L1数值收集不完全,且样本量较小,需要大样本进一步分析。另外,根据晚期胃癌一线免疫治疗研究ATTRACTION-4结果显示 [17] 纳武利尤单抗联合化疗显著延长PFS (10.45个月vs. 8.34个月),疾病进展或死亡风险显著降低32%,本研究免疫联合组患者预后相对较好,但SII、PNI与免疫单药、免疫联合治疗无相关性。
免疫检查点抑制剂可以改变肿瘤微环境,激发免疫细胞攻击肿瘤细胞的潜能,借助自身免疫细胞来杀伤肿瘤。淋巴细胞、中性粒细胞等外周血细胞在机体免疫中起着非常重要的作用,所以炎性指标与免疫治疗疗效可能存在一定的相关性。淋巴细胞可反应机体免疫状态,淋巴细胞减少影响机体清除肿瘤细胞的能力。中性粒细胞能够分泌多种细胞因子(如血管上皮生长因子、IL-8、IL-16等),促进肿瘤细胞的增殖和转移 [18]。血小板分泌TGF-β等参与癌症转移,抑制CD4+和CD8+的活性,并可保护癌细胞免受化学疗法诱导的细胞凋亡和维持肿瘤血管系统的完整性 [19]。血清白蛋白浓度可以反应患者的营养状况,同时有研究显示白蛋白能够下调TNF-α、IL-1/IL-6的表达,抑制炎性因子,通过上调激活NF-γB途径,减轻炎症损伤 [20]。因此,SII的升高、PNI的降低可能意味着肿瘤微环境中肿瘤活性的抑制,最终导致预后不良。
当然我们的研究也存在不足:首先,我们的研究是回顾性研究,样本量较小。因此,需要多中心、大样本的前瞻性研究,以获得更准确的PNI和SII值,准确预测癌症患者的预后。其次,由于样本量和患者选择标准不同,不同研究的最佳PNI和SII值不同,导致值存在偏差。最后,未设置对照组。
PNI和SII是肿瘤患者血常规及血生化检查入院的常规检查,简单易获取。综上所述,SII、PNI有望成为预测晚期胃癌患者ICIs治疗疗效及预后的简单、可靠的生物标志物,但仍需多中心大规模、前瞻性的临床研究进一步证实。
基金项目
山东省医药卫生科技发展计划项目(2019WS154)。
NOTES
*通讯作者Email: yuanshengliqdmh@126.com