1. 引言
紫薇煤污病典型的发病症状是感病的叶片和枝条(主要是当年枝条)上形成较厚的黑色层 [1] [2] [3]。煤污病在世界上分布较广,在北美、欧洲、澳大利亚、东南亚地区、毛里求斯、夏威夷、南非、留尼汪岛、巴基斯坦、印度及我国南方和台湾都有报道 [4] [5]。
紫薇煤污病病原多数认为是由子囊菌亚门核菌纲小煤炱属真菌引起 [1] [2]。而刘加铸等研究发现引起紫薇煤污病的病原菌种类主要有枝孢霉(Cladosporium sp.)、散播烟霉(Fumagovegans Pers)、多绺孢属(Tripospermum sp.)、煤炱菌(Capnodium sp.)等多种真菌混生 [6] [7]。李萌等通过分离纯化、形态学鉴定及ITS分子生物学鉴定确定引起芍药煤污病的病原为枝细枝孢 [8]。2019年张俊逸等通过对病原菌进行分离、纯化、致病性测定以及形态学、分子生物学鉴定,确定栀子煤污病病原菌种类为隔孢从壳菌(Glomerella septospora) [9]。岳清华等通过单孢分离法分离病原菌,并通过症状观察、形态学、分子生物学、回接方法对病原菌进行鉴定,结果表明,引起蓝莓煤污病的优势病原菌有3种,即尖孢枝孢(Cladosporium oxysporum)、枝细枝孢(Cladosporium ramotenellum)、交链格孢(Alternaria alternate) [10]。
目前紫薇煤污病菌分离鉴定工作较少,且各个地区气候条件差异性较大,煤污病的病原也具有不同的特点。该研究主要是根据当地环境条件确定并分离鉴定该地的紫薇煤污病病原,为后续病原菌的分子生物学鉴定、综合防治及抗病品种筛选工作提供理论基础。
2. 研究方法
2.1. 紫薇煤污病样品采集
采集具有典型症状的病叶作为试验材料,发病叶片变形,叶片、茎秆表面布满灰黑色煤粉层,特别是有紫薇绒蚧为害的紫薇树。
2.2. 紫薇煤污病病原分离纯化
采集具有典型紫薇煤污病特点的病组织,利用无菌水冲洗3~5次晾干后用75%酒精棉消毒。无菌刀片切取病健交界处组织块,0.1% 升汞溶液表面消毒30 s后用无菌水冲洗2~3次,晾干。利用消毒镊子接入PDA培养基,28℃恒温培养观察。选取单一菌落纯化培养。
2.3. 紫薇煤污病病原形态学鉴定
挑取纯化的菌落,利用光学显微镜(40 × 10倍)观察。观察菌丝、产孢结构及分生孢子等显微特征,形态学鉴定。
2.4. 紫薇煤污病总DNA提取及ITS序列扩增
分离纯化的紫薇煤污病菌株及利用植物总DNA提取试剂盒(全式金)提取总DNA。
利用rDNA-ITS通用引物ITS1 (5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4 (5’-TCCTCCGCTTATTG ATATGC)进行真菌DNA的扩增。PCR反应体系为25 μl,各组分如下:模板DNA 2 μl,2 × Taq PCR Master Mix 12.5 μl,引物ITS1 (10 μmol/L)与ITS4 (10 μmol/L)各1 μl,无菌ddH2O 8.5 μl。PCR产物测序。
2.5. 紫薇煤污病病原菌遗传进化分析
测序,获得紫薇煤污病病菌的ITS序列。NCBIBlast序列比对分析,确定病原,构建系统发育关系,确定各待测菌株进化关系。
3. 结果与分析
3.1. 紫薇煤污病样品采集
通过采集潍坊科技学院校园及周边、寿光市公园共获得具有典型紫薇煤污病症状(如图1)的样品30份。

Figure 1. Symptoms of coal pollution of Lagerstroemia indica
图1. 紫薇煤污病症状
3.2. 紫薇煤污病病原分离纯化
通过对样品进行了紫薇煤污病菌的分离培养,25℃恒温培养7~14 d后,发现每个PDA平板上分化出多个菌落,菌落形态、颜色差异性较大。后期通过纯化培养获得单一菌落的纯培养。通过紫薇煤污病菌的纯化培养获得12个菌株并对其进行编号,ZWMW-11、ZWMW-12、ZWMW-13、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26、ZWMW-3、ZWMW-4、ZWMW-5、ZWMW-6。
选取已分离纯化的紫薇煤污病菌菌落,用烧制好的挑针挑取菌落,制作临时玻片,利用显微镜对其进行观察;通过形态学观察初步判定紫薇煤污病主要由链格孢菌、枝孢菌等多种病原菌侵染发生。利用斜面保存法和冻存管保存法将分离纯化的12个紫薇煤污病菌菌株4℃低温保存于冻存管中并建立了菌株资源库。
3.3. 紫薇煤污病病原形态学鉴定
利用显微镜进行形态学观察初步判定紫薇煤污病病原菌主要包括链格孢菌、枝孢菌等。通过形态学观察及描述初步判断ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26属链格孢菌,ZWMW-11、ZWMW-12、ZWMW-13属枝状枝孢菌,ZWMW-4属黑附球菌,ZWMW-3、ZWMW-6属聚生小穴壳菌。
ZWMW-3、ZWMW-6在 PDA培养基上菌落初为淡灰色,后渐变为褐色至深褐色,有气生菌丝,在PDA上可产生黑色子座,近圆形,具孔口,平均大小为390 μm × 680 μm;分生孢子梭形,无色,10~20 μm × 15~30 μm (如图2)。根据形态学特征与记载聚生小穴壳形态相符 [11] [12] [13]。
ZWMW-3在PDA培养基上只产生菌丝和膨大细胞,ZWMW-6在培养基上产生分生孢子器和分生孢子。
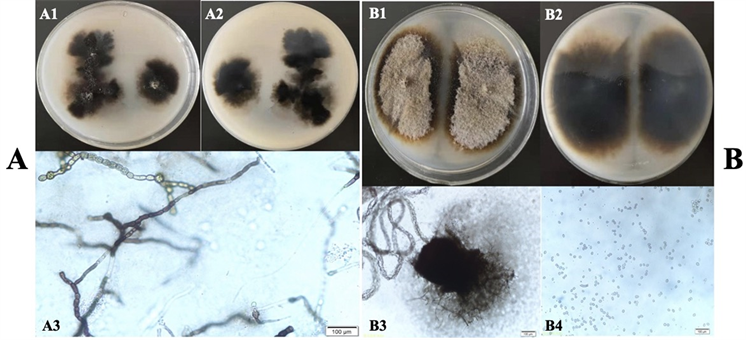
Figure 2. Colony and morphological characteristics of ZWMW-3 and ZWMW-6. (A) ZWMW-3; A1, A2: Colony; A3: Expanded cell; (B) ZWMW-6; B1, B2: Colony; B3: pycnidium; B4: Conidia
图2. ZWMW-3和ZWMW-6菌落及形态学特点。(A) ZWMW-3;A1、A2:ZWMW-3菌落;A3:膨大细胞;(B) ZWMW-6;B1、B2:ZWMW-6菌落;B3:分生孢子器;B4:分生孢子
在PDA培养基上中心呈橘黄色,边缘白色,菌丝形成垫状菌落,在OA 培养基上菌丝呈白色,中心致密,边缘稀疏,菌落背面淡黄色。体视镜下清晰可见紧密着生在球形分生孢子座上的黑色分生孢子。菌丝体表生或埋生。菌丝无色或淡褐色,具隔膜,分枝或少数不分枝,光滑,宽1.5~2.5 μm。分生孢子座垫状,有时培养中并不明显。分生孢子梗常短粗,直立或弯曲,末端或中间着生呈链格孢状的膨大细胞,0~2隔膜,光滑,无色或极淡褐色,3~5 × 1~2 μm。分生孢子从分生孢子梗顶端膨大处生出,分生孢子呈球状、黑褐色,直径约15~30 μm (如图3)。根据形态学特征与记载黑附球菌形态相符 [14] [15] [16]。
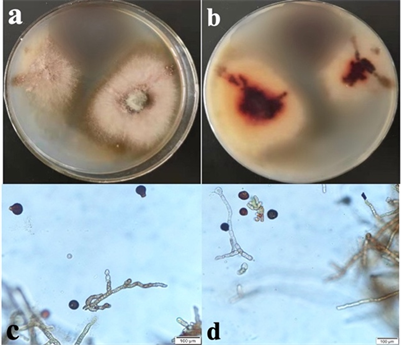
Figure 3. Colony and morphological characteristics of ZWMW-4. (a) (b) Colony; (c) (d) Conidiophores and conidia
图3. ZWMW-4菌落及形态学特点。(a) (b) 菌落;(c) (d) 分生孢子梗和分生孢子
菌落灰黑色,铺散状,容易产生孢子;分生孢子梗淡褐色,直立或稍弯曲,单生或簇生,分隔,内壁芽生式产孢,孢痕明显;分生孢子链生,直或微弯,倒棒状,淡褐色至褐色(如图4)。
ZWMW-22分生孢子光滑,具横膈膜0~3个,纵、斜隔膜较少,仅0~2个,喙不发达,1~2个细胞,孢子大小20~120 µm × 20~40 µm。
ZWMW-23分生孢子光滑,具横膈膜0~3个,纵、斜隔膜较少,仅0~2个,喙不发达,1~2个细胞,孢子大小30~170 µm × 20~40 µm。
ZWMW-24分生孢子光滑,具横膈膜0~7个,纵、斜隔膜较少,仅0~3个,喙发达,为多细胞喙,1~6个细胞,孢子大小30~2000 µm × 10~40 µm。
ZWMW-25分生孢子光滑,具横膈膜0~3个,纵、斜隔膜较少,仅0~1个,喙不发达,1~2个细胞,孢子大小15~40 µm × 30~160 µm。
ZWMW-26分生孢子光滑,具横膈膜0~3个,隔膜加厚,纵、斜隔膜较少,仅0~1个,喙不发达,1~2个细胞,孢子大小20~50 µm × 40~190 µm。
ZWMW-5分生孢子具刺突,具横膈膜0~4个,纵、斜隔膜较少,仅0~1个,喙不发达,1~2个细胞,孢子大小20~55 µm × 40~190 µm。
根据形态学特征与记载链格孢菌形态相符 [17] [18]。
菌落突点状,褐绿色,菌丝绒毛状,较致密,菌落背面墨绿色。菌丝有分隔,壁光滑或粗糙(如图5)。
ZWMW-11分生孢子梗淡褐色,直立,不分枝,孢痕疤1个,顶生,分生孢子链生,广椭圆形或宽圆柱形,平滑,无色至淡褐色,大小不一,0-1(-2)个隔膜,隔膜处略有缢缩,5~10 μm × 5~50 μm。
ZWMW-12分生孢子梗无色,直立,不分枝,孢痕疤1~2个,顶生或侧生,分生孢子链生,广椭圆形,平滑,无色至淡褐色,大小不一,0-1(-2)个隔膜,隔膜处略有缢缩,3~12 μm × 3~30 μm。
ZWMW-13分生孢子梗无色,直立,不分枝,孢痕疤1个,顶生,分生孢子链生,宽圆柱形,平滑,无色至淡褐色,大小不一,0-1(-2)个隔膜,隔膜处略有缢缩,10~22 μm × 15~200 μm。
根据形态学特征与记载枝孢菌形态相符 [19] [20] [21]。
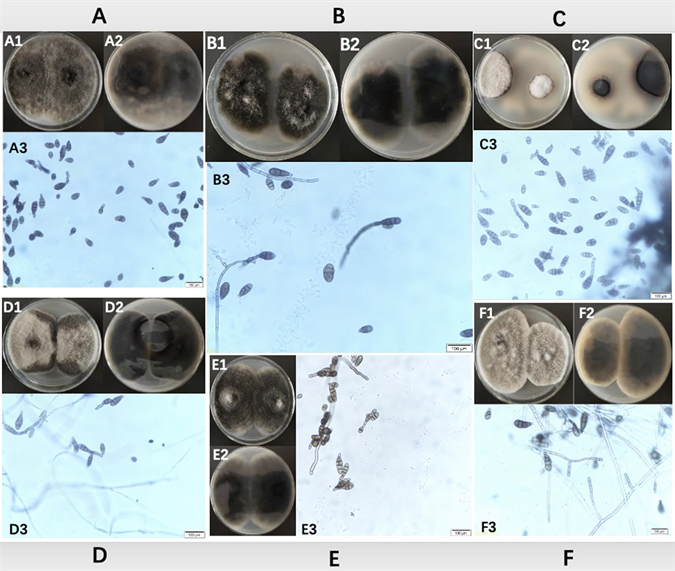
Figure 4. Colony and morphological characteristics of ZWMW-22, 23, 24, 25, 26, 5. (A) ZWMW-22; (B) ZWMW-23; (C) ZWMW-24; (D) ZWMW-25; (E) ZWMW-26; (F) ZWMW-5
图4. ZWMW-22、23、24、25、26、5菌落及形态学特点。(A) ZWMW-22;(B) ZWMW-23;(C) ZWMW-24;(D) ZWMW-25;(E) ZWMW-26;(F) ZWMW-5

Figure 5. Colony and morphological characteristics of ZWMW-11, 12, 13. (A) ZWMW-11; (B) ZWMW-12; (C) ZWMW-13
图5. ZWMW-11、12、13菌落及形态学特点。(A) ZWMW-11;(B) ZWMW-12;(C) ZWMW-13
3.4. 紫薇煤污病病菌ITS序列的扩增
利用真菌ITS (5.8S rDNA和28S rDNA基因间隔序列)序列引物ITS1和ITS4,紫薇煤污病菌总DNA作模板进行PCR反应。产物进行凝胶电泳。ITS PCR反应及凝胶电泳后发现,检测结果在500~750 bp之间(如图6),通过测序获得序列结果。

Figure 6. ITS PCR gel electrophoresis of coal pollution of Lagerstroemia indica
图6. 紫薇煤污病菌ITSPCR凝胶电泳
3.5. 紫薇煤污病病原菌遗传进化分析
通过序列测定及NCBI比对,发现ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26属链格孢,ZWMW-11、ZWMW-12、ZWMW-13属枝状枝孢菌,ZWMW-3、ZWMW-6属于聚生小穴壳菌,ZWMW-4属黑附球菌(如图7)。
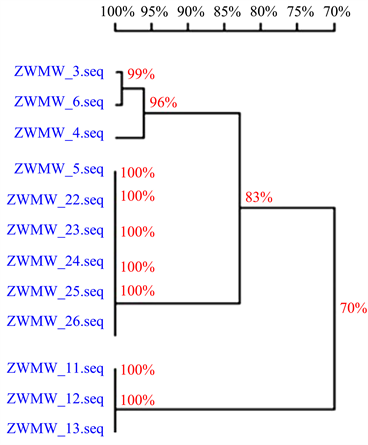
Figure 7. Genetic evolution of coal pollution of Lagerstroemia indica
图7. 紫薇煤污病病原菌遗传进化分析
通过遗传进化分析ZWMW-3、ZWMW-6同源率达到99%,属于同一种,但PDA培养发现ZWMW-3只产生菌丝和膨大细胞,而ZWMW-6产生分生孢子器和分生孢子,可能是由于培养时间、培养条件略有差异造成的。
ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26同源性达到100%,属链格孢,但在人工培养状态下分生孢子形态大小略有差异。
ZWMW-11、ZWMW-12、ZWMW-13同源性达到100%,属枝状枝孢菌,分生孢子梗颜色,产孢痕位置及分生孢子形态、大小略有差异。
由此得出结论,寿光紫薇煤污病病原菌主要包括链格孢菌、枝孢菌、黑附球菌、聚生小穴壳菌等。ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26属链格孢菌,ZWMW-11、ZWMW-12、ZWMW-13属枝状枝孢菌,ZWMW-4属黑附球菌,ZWMW-3、ZWMW-6属聚生小穴壳菌。
4. 结果与讨论
4.1. 结果
通过样品采集、分离纯化等获得紫薇煤污病病原菌;利用形态学观察、遗传进化分析鉴定紫薇煤污病病原菌主要包括链格孢菌(Alternaria sp.)、枝状枝孢菌(C. cladosporioides)、黑附球菌(E. nigrum)、聚生小穴壳菌(D. gregaria)等。
1) 采集潍坊科技学院校园及周边、寿光市公园获得具有典型紫薇煤污病症状样品30份。
2) 通过对具有典型紫薇煤污病症状样品的分离培养,获得12个菌株并对其进行编号,ZWMW-11、ZWMW-12、ZWMW-13、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26、ZWMW-3、ZWMW-4、ZWMW-5、ZWMW-6。
3) 利用显微镜进行形态学观察及描述初步判断ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26属链格孢菌,ZWMW-11、ZWMW-12、ZWMW-13属枝状枝孢菌,ZWMW-4属黑附球菌,ZWMW-3、ZWMW-6属聚生小穴壳菌。
4) 利用真菌ITS (5.8S rDNA和28S rDNA基因间隔序列)序列引物ITS1和ITS4,紫薇煤污病菌总DNA作模板进行PCR反应,检测结果在500~750 bp之间。
5) 通过序列测定及NCBI比对,发现ZWMW-5、ZWMW-22、ZWMW-23、ZWMW-24、ZWMW-25、ZWMW-26属链格孢,ZWMW-11、ZWMW-12、ZWMW-13属枝状枝孢菌,ZWMW-3、ZWMW-6属于聚生小穴壳菌,ZWMW-4属黑附球菌。
4.2. 讨论
紫薇煤污病病原多数认为是由子囊菌亚门核菌纲小煤炱属真菌引起。但通过该研究发现寿光紫薇煤污病主要由链格孢菌、枝状枝孢菌、黑附球菌、聚生小穴壳菌等单一侵染或混合侵染。说明不同的地区引起紫薇煤污病的病原差异性比较大,病原种类较为复杂。为后期该病害化学防治及抗病品种筛选工作产生一定的困难。
基金项目
山东省高校设施园艺实验室建设项目(2018YY036、2018YY012)、山东省重点研发计划(公益类) (2019GNC106119)、潍坊科技学院教学改革研究项目(201924)、潍坊市科技发展计划项目(2020ZJ1032)、横向课题(KJ2021011,山东寿光蔬菜种业集团有限公司)。
NOTES
*第一作者。