摘要: 背景:白细胞介素33 (Interleukin-33, IL-33)是1种具有双重作用的细胞因子,属于IL-1细胞因子家族。IL-33既可以与ST2受体结合,激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)和核因子(Nuclear factor, NF, NF-κB)的信号传导通路,增加Th2细胞因子(如IL-4、IL-5和IL-13)的表达,又在细胞核中起着染色质相关因子的作用,通过表现出转录抑制因子的特性来调节基因转录,在炎症性疾病及多种恶性肿瘤的发生发展过程中起重要作用。然而IL-33在肝细胞癌(Hepatocellular car-cinoma, HCC)的发生发展及预后中是否具有临床意义尚不明确。目的:本文通过研究淋巴管密度(Lymphatic vessel density, LVD),IL-33和微血管密度(Microvessel density, MVD)等在HCC癌组织及癌旁组织中的不同表达情况,结合患者的临床及病理学参数分析和研究IL-33、MVD、LVD与HCC的相关性及临床意义。方法:本研究收集了62例HCC患者的临床资料及手术病理样本,将符合要求的临床资料纳入进行回顾性的分析。通过免疫组织化学染色方法(SP法)检测患者癌组织及癌旁组织中IL-33蛋白、MVD及LVD的表达情况,分析三者与入组HCC患者临床病理参数之间的可能相关性,随访患者疾病进展状况,分析与HCC患者无进展生存期(PFS)的相关关系。结果:结合免疫组化染色结果及统计学分析数据,IL-33在HCC癌旁组织中的表达高于癌组织,差异有统计学意义(P < 0.01)。HCC癌组织中的MVD表达高于癌旁组织(P < 0.01),LVD表达无明显差异(P > 0.05)。IL-33的表达强度与MVD表达有关(P < 0.01)而与LVD无关(P > 0.05)。IL-33的表达强度还与肿瘤的病理组织学分级(P < 0.01)、肿瘤T分期(P < 0.05)及淋巴结转移(P < 0.01)呈正相关,但与年龄、性别、饮酒史、肝炎和肝硬化背景无明显相关性(P > 0.05)。单因素及多因素Cox回归分析获得的IL-33表达、MVD表达、淋巴结转移情况、临床T分期及肿瘤病理组织学分级与PFS有关。结论:HCC患者癌旁组织IL-33的高表达与患者不良预后有关。IL-33高表达、MVD高表达、淋巴结有转移、临床T分期晚及肿瘤的病理组织学分级差是患者PFS预后不良的危险因素,除肿瘤病理组织学分级外,其余4项为影响PFS时间的独立危险因素。IL-33或可作为预后预测因子为HCC的诊断和治疗提供新的方向和策略。
Abstract:
Background: Interleukin-33 (IL-33) is a dual-acting cytokine that belongs to the IL-1 family of cyto-kines. IL-33 binds to the ST2 receptor and activates Mitogen-activated protein kinase (MAPK) and nuclear factor (NF, NF-κB) signaling pathways, increasing the expression of Th2 cytokines (e.g. IL-4, IL-5 and IL-13). It also acts as a chromatin-associated factor in the nucleus, regulates gene tran-scription by exhibiting transcriptional repressor properties, and plays an important role in the de-velopment of inflammatory diseases and various malignancies. However, the clinical significance of IL-33 in the development and prognosis of hepatocellular carcinoma (HCC) is unclear. Objective: In this paper, we studied the different expression of lymphatic vessel density (LVD), IL-33 and mi-crovessel density (MVD) in HCC cancer tissues and paracancerous tissues, and analyzed and studied the correlation and clinical significance of IL-33, MVD, LVD and HCC with the clinical and pathological parameters of patients. The correlation between IL-33, MVD, LVD and HCC and their clinical signifi-cance were analyzed and studied in the context of the patients’ clinical and pathological parame-ters. Methods: In this study, clinical data and surgical pathology samples of 62 HCC patients were collected, and those that met the requirements were included for retrospective analysis. The ex-pression of IL-33 protein, MVD and LVD in the patients’ cancer and paraneoplastic tissues was de-tected by immunohistochemical staining method (SP method), and the possible correlation be-tween the three and the clinicopathological parameters of the enrolled HCC patients was analysed. The patients were followed up for disease progression and the correlation with the progression-free survival (PFS) of HCC patients was analysed. Results: Combined with the immunohistochemical staining results and statistical analysis, the expression of IL-33 was higher in HCC paraneoplastic tissues than in cancer tissues, and the difference was statistically significant (P < 0.01). The expres-sion of MVD was higher in HCC cancer tissues than in paracancerous tissues (P < 0.01), while LVD expression was not significantly different (P > 0.05). The intensity of IL-33 expression was associat-ed with MVD expression (P < 0.01) but not with LVD (P > 0.05). The intensity of IL-33 expression was also positively correlated with the pathological histological grade of the tumour (P < 0.01), the T-stage of the tumour (P < 0.05) and lymph node metastasis (P < 0.01), but not with age, gender, history of alcohol consumption, hepatitis and cirrhosis background (P > 0.05). IL-33 expression, MVD expression, lymph node metastasis status, clinical T-stage and tumour pathological histological grade obtained by univariate and multifactorial Cox regression analysis were associated with PFS. Conclusion: High expression of IL-33 in paracancerous tissues of HCC patients is associated with poor prognosis of patients. High expression of IL-33, high expression of MVD, presence of metastasis in lymph nodes, late clinical T-stage and poor pathological histological grading of tumour are risk fac-tors for poor prognosis of patients with PFS, except for pathological histological grading of tumour, the other four are independent risk factors affecting the time to PFS. IL-33 may be used as IL-33 may provide a new direction and strategy for the diagnosis and treatment of HCC as a prognostic predictor.
1. 引言
肝细胞癌(Hepatocellular carcinoma, HCC)是一种高死亡率的常见恶性肿瘤 [1],其发病可能与乙型和丙型肝炎的病毒感染 [2]、长期大量饮酒史引起的酒精性肝病 [3]、非酒精性脂肪性肝炎、食用黄曲霉毒素污染的食物 [4]、血吸虫病等因素引起的肝硬化及有肝癌家族遗传史有关 [5];然而,引起HCC的关键分子途径还不为人所知 [6]。白细胞介素-33是一种具有双重作用的细胞因子,一方面通过与磺基转移酶(ST2)受体同源物结合,激活NF和MAPK信号通路,从而调节多种炎症和免疫反应;另一方面,IL-33还在细胞核中充当染色质相关因子,起到抑制基因转录的作用。此外,当组织的细胞受到损伤或细胞坏死后,IL-33就会被释放到细胞外从而激活机体的免疫系统,起到“警报素”作用 [7] [8] [9]。结合目前检索到的文献发现,IL-33在多种恶性肿瘤的发生发展中起着重要作用。
肿瘤的转移是造成患者死亡的主要原因之一。大多数恶性肿瘤可通过淋巴结转移、直接侵袭和浸润和血源性转移进行扩散,在其中淋巴结转移和血行转移主要依靠肿瘤组织周围微血管生成来提供丰富的血供及营养因子 [10] [11],因此我们可以推测,肿瘤基质中微血管密度(Microvessel density, MVD)和淋巴管密度(Lymphatic vessel density, LVD)的表达可能增加。MVD及LVD在肿瘤和间质中的表达对预测肿瘤进展具有重要意义。
本研究的目的是通过检测HCC中的癌旁组织及癌组织中IL-33、MVD及LVD的表达情况,分析三者与入组HCC患者临床病理参数之间的可能相关性及与入组患者预后的相关性,研究IL-33在肝细胞癌发生发展预后中的作用,为HCC的早期诊断、预后评估及治疗提供新的指导方向。
2. 材料和方法
2.1. 研究对象
本研究选取从2014.1月到2016.1月因HCC在青岛市市立医院肝胆外科行手术治疗的总共62名患者样本。样本筛选条件:均为手术治疗后患者,且术前未进行新辅助放疗或化疗、靶向治疗、免疫治疗等抗肿瘤治疗,术后HCC病理诊断明确;选定的病理切块由癌组织和邻近组织构成。癌旁组织范围的定义是癌组织边缘1 cm以内的相邻组织;在随访过程能可以收集完整临床资料;入组HCC患者中,男性的患者有50例,女性的患者有12例,年龄范围在38至86岁之间,平均年龄为59.66岁。根据Edmondson病理分级,I-II级为1组,共有样本量37例,III-IV级为1组,共有样本量25例,按照美国抗癌联合会第6版对HCC的患者的TNM分期,其中把T1-2设置为1组,T3-4为1组,其中T1-2组共有46例,T3-4组共有16例;淋巴结转移阳性患者共有8例,淋巴结转移阴性患者共有54例。本研究获得青岛市市立医院医学伦理委员会批准。
2.2. 研究方法
本研究所有样本均采用免疫组织化学方法行过氧化物酶连接法(SP法)进行实验。所有标本都包埋在石蜡中,用切片机切成4 μm厚的切片。组织切片在68℃烘片机下烘烤30分钟,在二甲苯中脱蜡4分钟*4次,浸泡于PBS缓冲溶液中3分钟。用柠檬酸(1:100)修复液对组织抗原进行高压修复(100℃,2分30秒),取出逐渐冷却至室温。PBS缓冲溶液洗涤3分钟*3次。然后用3%过氧化氢/甲醇溶液室温下孵育10分钟以阻断内源过氧化物酶活性,再次用PBS缓冲溶液洗涤3分钟*3次。滴加山羊抗人血清封闭,室温下孵育20分钟。后分别滴加一抗工作液(山羊抗兔单克隆抗体IL-33,1:200,ab207737,Abcam;鼠抗人单克隆抗体D2-40,1:200,ab77854,Abcam、鼠抗人单克隆抗体CD34,1:100,ab8158,Abcam)于4℃温箱过夜孵育。孵育完成后用PBS冲洗3分钟*3次后滴加二抗(酶标羊抗小鼠/兔IgG聚合物),于室温下孵育20分钟。PBS缓冲溶液冲洗3分钟*3次。DAB显色剂于显微镜下控制染色。蒸馏水冲洗1分钟,苏木素复染,梯度酒精4分钟*3次脱水干燥,二甲苯4分钟*3次透明,中性树胶封片。以一抗换为磷酸盐缓冲液为阴性对照,但包括程序的所有其他步骤。观察蛋白阳性染色和细胞定位,并用光学显微镜拍摄图像。
3. 结果判定
3.1. IL-33的表达
IL-33的镜下表达结果分析由两名高年资病理学家以双盲法独立评估。当两位专家进行评估得出数据结果不一致时,由第三位无干扰因素资深病理学家进行重新计数分组。IL-33的显微镜染色显示,具有核和/或细胞质标记的细胞被认为是阳性的。对于细胞质和细胞核染色强度,非染色阴性评分为0,弱阳性评分为1,中度阳性评分为2,强阳性评分为3。随机选择10个200倍视野,阳性细胞所占比例小于5%评分为0分、阳性细胞所占比例在5%~25%之间评分为1分、阳性细胞所占比例在26%~50%之间评分为2分、阳性细胞所占比例在51%~75%之间评分为3分、阳性细胞所占比例大于75%评分为4分;最后得分由所占细胞总数比例和表达强度得分求和,总分在0~1分之间为阴性、2~4分之间为弱阳性、5~7分之间阳性。所选取的10个观察视野取平均值,然后将所得数据进行归纳整理,用SPSS软件进行统计学分析。在统计数据时,把阳性表达的设置为高表达组,阴性和弱阳性的设置为低表达组。
3.2. MVD的表达
MVD计数参照Weidner的血管计数法,将组织切片首先置于40倍光学显微镜下确定染色最密集的血管密度区域,确定好位置后,再移至200倍光学显微镜视野下,选择3个染色最密集的血管密度区进行微血管计数,然后取3个视野的平均值作为该患者的MVD最终值,并以此来划分高值组和低值组。有染色的单个细胞或成簇细胞团,不管是否有管腔形成,只要它与周围的微血管、肿瘤细胞和其他组织之间界限清楚,都算作可计数的阳性微血管。肿瘤组织内的硬化区以及肿瘤组织与正常组织交界处内的微血管不算作计数,有厚平滑肌壁以及管腔的直径大于8个红细胞直径的血管不计数。
3.3. LVD的表达
LVD计数参考Schoppmann等人的方法。在光学显微镜下观察带有棕黄色微淋巴管的单个或分组内皮细胞。在低倍视野(100×)下选择5个微淋巴染色的细胞,并在平均倍视野(200×)下计算每个视野中的微淋巴管数量。取5个视野中微淋巴管的平均数来表达LVD的表达,并根据平均数将高表达组和低表达组分开。
3.4. 统计学处理
用SPSS24.0软件进行统计分析。其中MVD、IL-33、LVD在HCC癌组织与癌旁组织中表达情况的比较采用卡方检验进行分析,癌旁组织中IL-33的表达情况与临床病理学参数及MVD、LVD的表达相关性用卡方检验进行分析,使用Kaplan-Meier法分析IL-33表达无进展生存期(PFS)的关系。采用单因素及多因素Cox回归模型分析影响患者PFS的相关危险因素,考虑本研究为小样本研究,将P值<0.1的因素纳入多因素COX比例风险回归模型。P值<0.05代表差异具有统计学意义。
4. 结果
4.1. HCC癌组织与癌旁组织中IL-33、MVD、LVD免疫组化染色结果比较
免疫组织化学法的染色结果如下图所示。IL-33在癌组织与癌旁组织中的表达见图1。其中可以看到:IL-33在邻近组织中强烈表达,而在癌组织中低表达。入组观察的62例病理标本中,HCC癌组织中IL-33高表达的例数为11例(17.74%),IL-33低表达的例数为51例(82.26%);癌旁组织中IL-33高表达的例数为28例(45.16%),IL-33低表达的例数为34例(54.84%),通过卡方检验进行统计学分析,P<值0.01,所以癌旁组织的表达量明显高于癌组织,差异均有统计学意义。
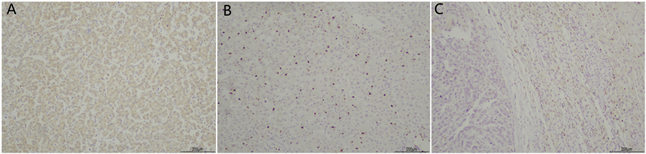
Figure 1. A: IL-33 expression in HCC cancer tissues (*100); B: IL-33 expression in HCC paracancer tissues (*100); C: IL-33 expression in HCC cancer tissues compared with paracancer tissues (*100)
图1. A:HCC癌组织中IL-33的表达(*100);B:HCC癌旁组织中IL-33的表达(*100);C:IL-33在HCC癌组织与癌旁组织中的表达对比(*100)
HCC癌组织及癌旁组织中LVD及MVD免疫组化染色结果的表达情况见图2和图3。结果显示:MVD在HCC癌组织内呈现出高表达的现象,在癌旁组织内MVD表达水平较低。而LVD在癌组织与癌旁组织中的表达无明显差异。HCC癌组织中MVD高表达的例数为29例(46.77%),MVD低表达的例数为33例(53.23%);癌旁组织中MVD高表达的例数为14例(22.58%),MVD低表达的例数为48例(77.42%),通过卡方检验进行统计学分析,P值<0.01,因此,MVD在癌组织中的表达明显高于癌旁组织,差异有统计学意义。在癌组织中LVD高表达的例数为53例(85.48%),LVD低表达的例数为9例(14.52%)癌旁组织中LVD高表达的例数为50例(80.65%),LVD低表达的例数为12例(19.35%),通过卡方进行分析,P > 0.05,无统计学意义。
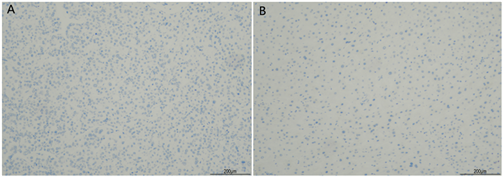
Figure 2. A: D2-40 expression results in HCC cancer tissues (*100); B: D2-40 expression results in HCC paracancer tissues (*100)
图2. A:HCC癌组织中D2-40表达结果(*100);B:HCC癌旁组织中D2-40表达结果(*100)
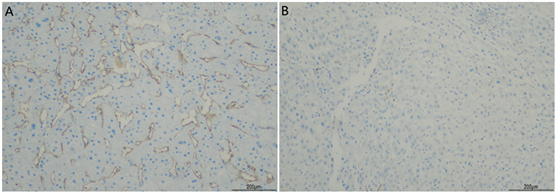
Figure 3. A: CD34 expression results in HCC cancer tissues (*100); B: CD34 expression results in HCC paracancer tissues (*100)
图3. A:HCC癌组织中CD34表达结果(*100);B:HCC癌旁组织中CD34表达结果(*100)
4.2. 患者癌旁组织中IL-33的表达与临床及病理学特征的相关关系
癌旁组织内IL-33的表达强度与肿瘤的病理组织学分级(P值<0.01)、肿瘤T分期(P值<0.05)及淋巴结转移(P值<0.01)呈正相关,但与年龄、性别、饮酒史、肝炎和肝硬化背景无明显相关性(P值>0.05)。见表1。

Table 1. Correlation between IL-33 expression in paracancerous tissues and clinical and pathological features in HCC patients
表1. HCC患者癌旁组织中IL-33的表达与临床及病理学特征的相关关系
4.3. HCC患者癌旁组织中IL-33的表达水平与MVD及LVD的相关性
HCC患者癌旁组织内IL-33的表达水平与MVD有关(P值<0.01)而与LVD无关(P值>0.05)。见表2。

Table 2. Correlation of IL-33 expression levels with MVD and LVD in paracancerous tissues of HCC patients
表2. HCC患者癌旁组织中IL-33的表达水平与MVD及LVD的相关性
4.4. HCC癌组织中MVD的表达情况与临床病理学参数之间相关性
HCC癌组织中MVD的表达强度与肿瘤的病理组织学分级(P值<0.01)、肿瘤T分期(P值<0.05)及淋巴结转移(P值<0.05)呈正相关,见表3。

Table 3. Correlation between MVD expression in HCC cancer tissues and clinicopathological parameters
表3. HCC癌组织中MVD的表达情况与临床病理学参数之间相关性
4.5. HCC患者癌旁组织中IL-33的表达水平、MVD、LVD与PFS相关性的回顾性因素分析
单因素及多因素Cox回归分析获得的IL-33表达情况、MVD表达情况、淋巴结转移情况、临床T分期及肿瘤病理组织学分级与HCC患者PFS有关,除肿瘤病理组织学分级外,其余4项为影响PFS时间的独立危险因素,见表4。HCC癌旁组织中IL-33的表达情况与患者PFS相关生存分析图见图4,其中IL-33高表达的估算中位进展期为8.5月,IL-33低表达的估算中位进展期为23月。

Table 4. Univariate and multivariate Cox regression model analysis of PFS in patients with hepatocellular carcinoma
表4. 肝癌患者PFS的单变量和多变量Cox回归模型分析

Figure 4. IL-33 expression in HCC paracancer tissue as a function of patient PFS-related survival analysis
图4. HCC癌旁组织中IL-33的表达情况与患者PFS相关生存分析函数图
5. 讨论
IL-33作为一种具有双重作用的细胞因子,主要由内皮细胞及上皮细胞等产生 [12],在细胞核及胞浆中均可表达,多在组织损伤时释放,被激活的巨噬细胞和一些树突状细胞等也可以表达一定量的IL-33。IL-33的特异性受体ST2在多种免疫细胞中均可广泛表达,诸如B细胞、肥大细胞和嗜酸性粒细胞等。IL-33既可以通过与ST2受体的同源物结合,激活NF和MAPK信号通路,促进Th2样细胞因子(如IL-4、IL-5和IL-13)的表达。又可以作为核因子通过表现出转录抑制因子的特性来调节基因转录,在炎症性疾病及多种恶性肿瘤的发生发展过程中扮演着重要的角色。
根据目前检索到的文献结果来看,血清中IL-33高表达被认为是多种肿瘤预后不良的生物标志物 [13],包括胃癌 [14] [15]、非小细胞肺癌 [16]、乳腺癌 [17] 和子宫内膜癌 [18] 等。与这些研究结果相反,也有其他研究报道IL-33可作为抗癌免疫的有效诱导剂,IL-33通过促进CD8+ T细胞和NK细胞的增殖浸润,增加CD8+ T细胞的细胞毒作用,从而增强抗肿瘤作用 [19]。肿瘤组织中IL-33的高表达与结直肠癌 [20]、前列腺癌 [21] 等肿瘤的进程呈负相关性。因此,IL-33表达与恶性肿瘤发生发展之间的关系仍然存在争议。IL-33的双重作用可能是研究其与多种肿瘤相关关系的一个重要的切入点。
在HCC方面,有研究表明IL-33高表达于HCC患者的血清中,提示IL-33可能在促进肝癌的发生发展中起了重要的作用。然而,也有一些研究质疑IL-33在HCC患者疾病进展中的作用,甚至提出IL-33的肝保护作用。本研究通过SP法检测HCC患者癌组织及癌旁组织中IL-33、MVD及LVD的表达情况,分析三者与入组HCC患者临床病理参数之间的可能相关性,随访患者疾病进展状况,分析与HCC患者PFS的相关关系。旨在探讨IL-33在肝癌发生发展中的作用,为肝癌的发生发展提供新的组织学资料和理论依据。
本研究结果显示IL-33在HCC癌旁组织中的表达高于癌组织,阳性表达多见于胞浆内;HCC癌组织中的MVD表达高于癌旁组织;癌旁组织内IL-33的表达与MVD表达情况、肿瘤的病理组织学分级、肿瘤T分期及淋巴结转移呈正相关。HCC组织中MVD表达阳性的患者,IL-33阳性表达的可能性高;肿瘤组织病理学程度越高,IL-33阳性表达越高;肿瘤T期越晚,IL-33阳性表达越高;同样,在淋巴结转移阳性的患者中,IL-33的阳性表达可能更高。IL-33的表达与年龄、性别、饮酒史、肝炎和肝硬化无显著相关性。这表明恶性程度越高,癌旁组织中IL-33的表达越高,这也表明IL-33可能在肿瘤的发生发展中起重要作用。
MVD的免疫标记物CD34为1种跨膜细胞表面糖蛋白;LVD其中的免疫标记物D2-40是唾液酸糖蛋白,它能和跨膜糖蛋白(位于淋巴管内皮细胞上的)特异性结合。本实验研究结果显示,仅MVD在癌组织与癌旁组织中的表达有明显差异,而LVD表达无明显差异。通过卡方检验统计分析,IL-33高表达组的患者,肿瘤中MVD浸润数目相应较多,IL-33低表达组的患者,肿瘤中MVD浸润数目相应较少,LVD在癌组织与癌旁组织中的表达无明显差异。IL-33的表达水平与MVD表达呈正相关(P值<0.01)而与LVD无关(P值>0.05)。这提示IL-33可能与肝癌的血管生成有关。下一步,可以敲除或扩增IL-33和ST2相关基因,以阐明它们对肝癌血管生成的影响,为肝癌的免疫靶向治疗奠定基础。
在进一步分析IL-33表达水平与HCC患者临床及病理特征之间的相关性时,通过单因素及多因素Cox回归分析获得的IL-33表达、MVD表达、淋巴结转移情况、临床T分期及肿瘤病理组织学分级对患者的PFS均有影响。癌旁组织中IL-33高水平表达、HCC组织中MVD高表达、淋巴结有转移、临床T分期晚及肿瘤病理组织学分级差的患者的PFS均较低。除肿瘤病理组织学分级外,其余4项为影响PFS时间的独立危险因素。
IL-33在肝癌邻近组织中的高表达是影响肝癌患者预后的重要因素。IL-33在HCC癌旁组织高表达而在HCC癌组织内不表达或呈弱阳性表达,可能是IL-33作为一种“警报因子”表达于癌旁组织的免疫细胞中,以自分泌和旁分泌的方式从细胞中释放出来,参与2型免疫反应,但由于肿瘤免疫逃逸是一个机制复杂的过程,在肿瘤发生进展时,癌旁组织中IL-33的表达水平会逐渐降低。还有一种可能是随着肿瘤的进展,癌旁组织受到侵犯损伤,表达于非免疫细胞如血管内皮细胞中的IL-33从损伤的细胞中释放出来,但是目前还没有明确的研究结果支持上述说法,IL-33的多重作用性为HCC预后评估及治疗方向提供了新思路。
6. 不足与展望
受目前实验条件限制,研究样本量较少,只研究了HCC癌组织与癌旁组织中IL-33表达情况与疾病相关关系,未结合IL-33在血清中的表达情况及IL-33不同表达定位情况与疾病的相关关系,接下来,我们可以扩大样本数量,全面分析研究IL-33在肝癌发生发展不同阶段的重要性,以验证实验结果是否具有大数据意义,并评估IL-33在肝癌患者的治疗和诊断中的价值。了解IL-33的重要双重作用及其介导的信号通路可能为HCC的诊断和治疗提供新的方向和策略。
NOTES
*通讯作者Email: chengye_guo@126.com