1. 引言
近年来,随着我国茶产业的大力发展和茶树种植面积越来越大,茶树资源成为一个巨大产业资源,茶叶籽作为副产物,其产量和资源总量也十分可观。对于茶树资源的利用,主要集中在“茶叶”部分。由于茶叶籽含有茶叶籽油 [1]、多糖 [2]、淀粉以及茶皂素 [3] 等多种有价值经济成分,所以对茶叶籽资源的开发利用具有巨大的经济价值。目前对茶叶籽成分开发利用方面主要集中在单一成分提取利用上,茶叶籽内含各成分在生产、分离、提纯及综合利用等技术还在探索和完善中。在实际生产中,提取茶叶籽油时受到淀粉与蛋白的影响乳化严重,导致清油难以提取 [4],在提取多糖时常有蛋白质和淀粉混入其中影响多糖的应用与性能 [5],故尚未见到采用综合利用工艺同时生产茶叶籽油、茶叶籽多糖等成分的报道。本研究以贵州铜仁茶叶籽为原料,参考前人茶叶籽资源开发利用的技术工艺,在水溶剂法提取茶油的基础上 [6] [7],依据低浓度乙醇使得可溶性淀粉沉淀 [8] [9] 促进茶皂素的溶解;盐可以促使蛋白质沉降,减轻其对油的乳化 [10],油水分离时使油可以充分暴露出来;进一步调节水溶液pH使得蛋白沉降,同时带走水溶液中残余的可溶性淀粉,解决水溶剂法直接提取用茶叶籽多糖时淀粉难以除去的问题;通过醇沉的方式分离茶叶籽多糖与茶皂素。最终使茶叶籽各成分得到较好的分离提取,实现综合提取制备目的。所以本试验研究采用乙醇水溶剂与盐互作法,充分考虑茶叶籽中各主要成分的性质和提取过程中的影响因素,使茶叶籽的经济价值得到充分实现,为茶叶籽的资源利用和工业化生产提供参考依据。
2. 材料与方法
2.1. 化学试剂
无水乙醇(天津市富宇精细化工有限公司),苯酚(天津市永大化学试剂有限公司),硫酸(国药集团化学试剂有限公司),氯化钠(国药集团化学试剂有限公司),冰乙酸(天津市富宇精细化工有限公司)。
2.2. 试验材料
茶叶籽,于2019年12月采自贵州省铜仁市某标准化茶园,其质地脆硬,无霉变及虫蛀,洁净光亮,呈棕褐色。将茶叶籽置于50℃烘箱中,使其中水分降到10%以下后用剥壳机剥壳。茶叶籽仁粉碎后,储存于干燥环境下,备用。
2.3. 试验仪器与设备
101-3A型电热鼓风干燥箱(天津市泰斯特仪器有限公司),旋转蒸发器RE-52AA (上海雅荣生化仪器设备有限公司),SHB-(III)循环水式多用真空泵(郑州长城科工贸有限公司),KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司),万分电子天平(上海精密科学仪器有限公司),L-550台式低速大容量离心机(长沙市湘仪离心机仪器有限公司),FW-100高速万能粉碎机(黄骅市振兴机械仪器厂)。
2.4. 试验方法
茶叶籽中多种成分提取工艺流程如图1所示。
2.4.1. 淀粉浸提
在室温条件下,在10 g茶叶籽粉(含水率在10%以下)中加入70 mL 15%乙醇溶液搅拌10分钟后进行浸泡。以浸泡时间设置单因素试验,过滤,将滤液进行离心,4000 r/min离心5 min。将上清液与过滤后得到的残渣混合,收集用于后续提取。收集离心得到的沉淀,用100 mL蒸馏水进行洗涤,每次洗涤静置10 min,共洗涤三次。弃洗液,洗涤完后将淀粉沉淀置于50℃烘箱中,干燥即得茶叶籽淀粉。
2.4.2. 单因素试验
固定超声波功率200 W,提取时间40 min,料液比1:7 g/mL [11],探究提取温度40℃,50℃,60℃,70℃中的最佳温度;固定超声波功率200 W,提取温度60℃,料液比1:7 g/mL,探究提取时间30,40,50,60,70 min中的最佳提取时间,以得油率为考察指标,重复三次。
2.4.3. 响应面试验
在单因素试验基础上,选取提取时间、提取温度、乙醇浓度和盐浓度为自变量,以得油率为响应值,按Box-behnken Design (BBD)原理设计响应面试验。根据试验结果进行优化分析,再进行验证试验,以得到最优提取工艺。
2.4.4. 茶叶籽油和粗蛋白质的提取
超声波提取后将残渣过滤出来,滤液用分液漏斗静置30 min后,上层得到茶叶籽油。下层溶液调节pH后进行抽滤,即得粗蛋白质。
2.4.5. 茶叶籽多糖的提取
前述2.4.4步试验抽滤后水相用75%乙醇醇沉8 h。醇沉后离心,4000 r/min离心10 min。离心得到的固体真空冷冻干燥后即得茶叶籽多糖。
2.4.6. 茶皂素的提取
前述2.4.5步试验离心后的上清液进行浓缩精炼,即得茶皂素。
2.5. 数据处理
试验重复3次,试验结果取3次平均值±标准差,数据处理采用SPSS及Design-Expert.V 8.0.6.1.软件设计响应面试验。
2.5.1. 计算清油得率
计算公式如下:得油率 = 得油重量 ÷ (总重量 − 除杂重量) × 100%。
2.5.2. 计算多糖得率
计算公式如下:多糖得率 = 多糖质量 ÷ (总重量 − 除杂重量) × 100%。
3. 结果与分析
3.1. 淀粉的提取
茶叶籽材料起始用低浓度乙醇浸泡的时间试验结果如图2和图3,浸泡时长为6 h时效果最好,淀粉得率为19.37%,浸泡处理后茶叶籽油得率为20%。

Figure 2. Effect of soaking time on starch yield
图2. 浸泡时间对淀粉得率的影响

Figure 3. Effect of soaking time on oil yield
图3. 浸泡时间对得油率的影响
3.2. 单因素试验结果
3.2.1. 提取温度对得油率的影响
不同温度对得油率的影响如图4所示。随着提取温度的升高,茶叶籽油得油率先升高后下降。可能由于提取温度升高,反应体系中油脂分子和溶剂分子获得的动能变大,从而有利于油脂的浸出。当温度达到60℃时,得油率达到最大值,为21.33%,当温度超过60℃得油率反而下降,原因可能是温度过高,使油脂中的部分活性成分挥发,导致得油率降低。因此在试验选定的范围内,确定最佳温度为60℃。

Figure 4. Effect of extraction temperature on oil yield
图4. 提取温度对得油率的影响
3.2.2. 提取时间对得油率的影响
不同提取时间对得油率的影响如图5所示。由图可知,随着提取时间的延长,得油率逐渐增加,40 min时得油率为20.83%,随着提取时间延长,油的得率增加趋势并不明显,因此在试验选定的范围内,确定最佳提取时间为40 min。
3.2.3. 盐浓度对得油率的影响
不同盐浓度对得油率的影响如图6所示。
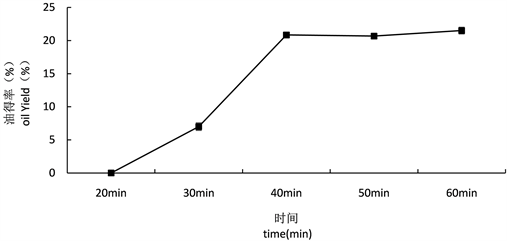
Figure 5. Effect of extraction time on oil yield
图5. 提取时间对得油率的影响

Figure 6. Effect of salt concentration on oil yield
图6. 盐浓度对得油率的影响
不同盐浓度对得油率的影响如图6所示,当盐浓度为0.2 mol/L时,得油率达到最大值26.00%。随着盐浓度的增大,得油率逐渐减小,当盐浓度为1.0 mol/L时,得油率有所提高,但不是最优值,因此在试验选定的范围内,确定最佳盐浓度为0.2 mol/L。
3.2.4. 乙醇浓度对得油率的影响
不同乙醇浓度对得油率的影响如图7所示,当乙醇浓度在10%时,得油率达到最大值为20.67%。当乙醇浓度继续增大时,得油率反而下降,原因可能是乙醇浓度过高使得蛋白变性包裹着油沉淀。因此在试验选定的范围内,确定最佳乙醇浓度为10%。
3.2.5. 提取温度对多糖得率的影响
不同提取温度对多糖得率的影响如图8所示,随着提取温度的升高,多糖得率先升高后下降。当温度达到60℃时,多糖得率达到最大值为3.97%,当温度超过60℃多糖得率反而下降,原因有可能是温度过高破坏了茶叶籽多糖的结构。因此在试验选定的范围内,确定最佳温度为60℃。
3.2.6. 盐浓度对多糖得率的影响
不同盐浓度对多糖得率的影响如图9所示,随着盐浓度的升高,多糖得率先增加后减少。当盐浓度为0.8 mol/L时,多糖得率达到最大值3.96%。当盐浓度为1.0 mol/L时,多糖得率反而下降。原因可能是盐浓度为0.8 mol/L时正好为蛋白等电点,此时继续调节pH沉降蛋白时,不带走茶叶籽多糖。因此在试验选定的范围内,确定最佳盐浓度为0.8 mol/L。
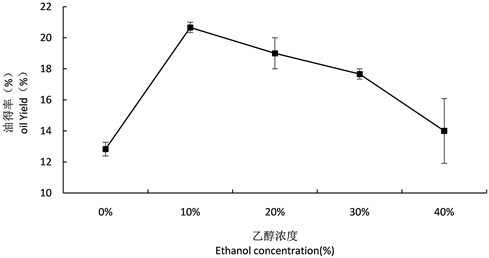
Figure 7. Effect of different ethanol concentrations on oil yield
图7. 不同乙醇浓度对得油率的影响
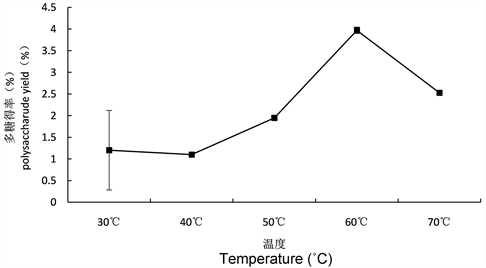
Figure 8. Effect of different extraction temperatures on polysaccharide yield
图8. 不同提取温度对多糖得率的影响

Figure 9. Effect of different salt concentrations on polysaccharide yield
图9. 不同盐浓度对多糖得率的影响
3.2.7. 盐浓度对蛋白质得率的影响
不同盐浓度对蛋白质得率的影响如图10所示,当盐浓度时为0.8 mol/L,蛋白质得率达到最大值为28.75%。因此在试验选定的范围内,确定最佳盐浓度为0.8 mol/L。

Figure 10. Effect of different salt concentrations on protein yield
图10. 不同盐浓度对蛋白质得率的影响
3.2.8. 提取时间对蛋白质得率的影响
不同提取时间对蛋白质得率的影响如图11所示,当提取时间为30 min时,蛋白质得率达到最大值为25.08%。随着提取时间的延长,蛋白质得率有点波动,但是总体呈逐渐减小趋势,因此在试验选定的范围内,确定最佳提取时间为30 min。

Figure 11. Effects of different extraction times on protein yield
图11. 不同提取时间对蛋白质得率的影响
3.2.9. 提取温度对皂素得率的影响
不同提取温度对皂素得率的影响如图12所示,随着提取温度的升高,皂素得率先升高后下降,温度
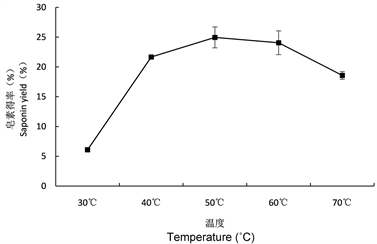
Figure 12. Effect of different extraction temperatures on saponin yield
图12. 不同提取温度对皂素得率的影响
达到50℃时,皂素得率达到最大值为24.95%,当温度低于50℃时,由于温度不够高、时间不够长,茶皂素在水中未能充分溶解,提取率较低,但超过50℃皂素得率反而下降,原因可能是温度过高使得溶液中的乙醇挥发,导致茶皂素在溶液中的溶解度下降;因此在试验选定的范围内,确定最佳温度为50℃。
3.3. 茶叶籽油提取率优化
3.3.1. 响应面模型的建立
根据单因素试验结果,选取提取温度(A)、乙醇浓度(B)、盐浓度(C)、提取时间(D)为自变量,以得油得率为Y值,采用Box-behnken Desig原理进行试验设计。试验的因素和水平表如表1所示。

Table 1. Level coding values of response surface test factors
表1. 响应面试验因素水平编码值表
3.3.2. 响应面模型的显著性检验
由表2、表3得回归方程为:
回归方程R2和R2Adj值分别为0.87810.7359,说明该回归方程可以分别解释响应值变化的87.81%和模型经校正以后73.59%的响应值变化。AP (信噪比) = 8.280 > 4,表明该回归方程的拟合度和可信度均较高。由表3可知,在影响茶籽油提取率的各因素中,A、D、A2、B2、C2项表现出显著性影响;由于AC和BC项对提取率有显著性影响,表明影响茶籽油提取率的因素间也有交互作用。

Table 2. Response surface test methods and results
表2. 响应面试验方法及结果

Table 3. Response surface analysis of variance results
表3. 响应面方差分析结果
3.3.3. 两因子交互作用的响应面分析
根据试验回归分析结果作响应曲面图,得到开口向下的响应面曲面的图,说明因素间交互作用影响提油率存在最大值。模型中各因素之间交互作用如图13~18所示。响应曲面的坡度越陡说明影响因素的变化对提取率影响越大,试验结果变化越显著。交互效应的强弱可以用等高线的形状进行确定。由图13和图14可知,等高线呈椭圆形,说明盐浓度和提取温度、盐浓度和酒精浓度的交互作用对提油率的影响具有显著性;由图15和图18可知,提取温度和时间、酒精浓度和提取时间之间的无显著交互作用。而图16和图17的等高线为椭圆形,说明两者有交互作用,但其曲线坡度较小,两者之间交互作用不显著。根据等高线的疏密程度可确定试验选定的各因素对提油率影响大小顺序为:提取温度 > 盐浓度 > 提取时间 = 酒精浓度。当在提取温度60℃、乙醇浓度为15%、氯化钠浓度为0.2 mol/L、提取时间50 min时达到最优值,为20.567%。在前述优化得到的最佳提取工艺条件下进行3次重复试验,结果20.15%与预期值20.567%偏差小于5%,说明结果可靠试验工艺可行。
3.4. 茶叶籽油检测分析
皂化值、酸价、碘价是反映油脂质量的重要指标, 以本试验方法提取制备的茶叶籽清油按照国家标准方法进行检测分析,结果如表4所示。3项指标均符合国家标准要求。所以,用此法提取茶叶籽油在获得较高得率的同时,所得油脂品质达标。

Figure 13. Interaction of extracted salt concentration and ethanol concentration on tea seed oil yield contour plot and response surface plot
图13. 提取盐浓度和乙醇浓度对茶叶籽油得率交互作用等高线图和响应面图

Figure 14. Interaction of extraction temperature and salt concentration on tea seed oil yield contour plot and response surface plot
图14. 提取温度和盐浓度对茶叶籽油得率交互作用等高线图和响应面图

Figure 15. Contour plot and response surface plot of the interaction between extraction temperature and ethanol concentration on tea seed oil yield
图15. 提取温度和乙醇浓度对茶叶籽油得率交互作用等高线图和响应面图

Figure 16. Interaction of extraction temperature and extraction time on tea seed oil yield contour plot and response surface plot
图16. 提取温度和提取时间对茶叶籽油得率交互作用等高线图和响应面图

Figure 17. Interaction of extraction time and ethanol concentration on tea seed oil yield contour plot and response surface plot
图17. 提取时间和乙醇浓度对茶叶籽油得率交互作用等高线图和响应面图
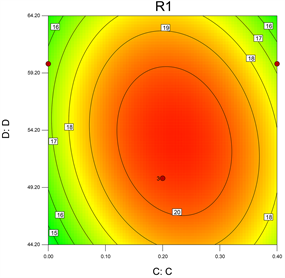
Figure 18. Interaction of extraction time and salt concentration on tea seed oil yield contour plot and response surface plot
图18. 提取时间和盐浓度对茶叶籽油得率交互作用等高线图和响应面图

Table 4. Tea seed oil quality values
表4. 茶籽油品质数值
4. 结论
本研究采用乙醇水溶剂与盐互作法,在单因素试验基础上采用响应面法优化进行正交分析,得到茶叶籽综合利用优化工艺。结果表明:在提取温度60℃、乙醇浓度为15%、氯化钠浓度为0.2 mol/L、提取时间50 min时,茶叶籽多糖、茶叶籽油、淀粉等物质综合提取率达到最优。油得率达20%、茶叶籽多糖得率达3.9%、淀粉得率达10%、蛋白得率达15%。试验证明,本提取工艺具有实际可操作性和较强的实际应用价值。
基金项目
本项目由国家级大学生创新创业训练项目“茶叶籽多糖绿色提取工艺研究”(202014223032);贵州省科技厅奖励基金项目(黔教合KY字(2017) 5790-06);贵州省茶籽资源综合开发利用工程研究中心(黔教合([2017]020)共同资助。
NOTES
*通讯作者。