摘要: 目的:本研究目的在于系统评价及对比免疫检查点抑制剂及单纯化疗治疗肺癌的疗效及安全性。方法:计算机检索中国期刊全文数据库、万方数据库、The Cochrane Library、PubMed、CBM、维普数据库等数据库,搜索免疫检查点抑制剂及单纯化疗治疗肺癌的随机对照试验(randomized control trial, RCT);主要结局指标包括总生存期(overall survival, OS)、无进展生存时间(progression free survival, PFS)、有效率及治疗相关3~4级不良反应;采用RevMan5.2软件进行meta分析。结果:共纳入6个RCT,2509例晚期肺癌患者。meta分析结果显示:与化疗组相比,免疫检查点抑制剂可显著提高肺癌患者的有效率(RR = 1.48, P < 0.05, 95%CI: 1.08~2.03),显著延长患者的无进展生存期(HR = 0.83, P < 0.0001, 95%CI: 0.77~0.91),显著延长患者的总生存期(HR = 0.71, P < 0.00001, 95%CI: 0.65~0.78),并不显著降低患者治疗相关3~4级不良反应(RR = 0.43, P = 0.08, 95%CI: 0.17~1.09)。结论:与单纯化疗相比较,免疫检查点抑制剂治疗肺癌可以提高晚期肺癌患者的有效率、PFS及OS。
Abstract:
Objective: To systematically review the efficacy and safety of immune checkpoint inhibitors in the treatment of lung cancer. Methods: The PubMed, CBM, CNKI, VIP, Wan Fang and The Cochrane Li-brary were retrieved by computer, the randomized controlled trials (RCT) about immune check-point inhibitors in the treatment of lung cancer were collected by us. The outcomes included overall survival (OS), progression-free survival (PFS), response rate and treatment-related adverse events of grade 3 or 4; RevMan5.2 software was used for Meta analysis. Results: Six trials and 2509 lung cancer patients were included. Meta analysis indicated that compared with chemotherapy alone, the immune checkpoint inhibitors could increase the response rate of the patient (RR = 1.48, P < 0.05, 95%CI: 1.08~2.03), significantly prolong the progression-free survival of the patients (HR = 0.83, P < 0.0001, 95%CI: 0.77~0.91), significantly prolong the overall survival of the patients (HR = 0.71, P < 0.00001, 95%CI: 0.65~0.78), did not significantly reduce the treatment- related adverse events of grade 3 or 4 (RR = 0.43, P = 0.08, 95%CI: 0.17~1.09). Conclusions: Immune checkpoint in-hibitor can obviously improve the response rate, PFS and OS of patients with advanced lung cancer, better than chemotherapy alone.
1. 引言
近年来,肺癌的死亡率已经逐渐上升为全球癌症死亡率首位,已经严重危害到人类健康。临床研究发现肺癌的恶性程度高,生物学特性极其复杂,且其早期临床症状不明显,在被确诊的肺癌患者中,约有75%发现时已经属于中晚期 [1] [2],研究发现大约57%的肺癌患者被确诊时就已经发生了远处转移,这也使得肺癌患者的预后差、生活质量差、死亡率居高不下 [3] [4] [5]。非小细胞肺癌(non small cell lung cancer, NSCLC)占肺癌总数85%,NSCLC患者的5年生存率为16% [6]。小细胞肺癌(small cell lung cancer, SCLC)患者5年生存率仅有6% [7]。中晚期肺癌的治疗方法有限,而且疗效较差,生存期短,例如使用以铂类为基础的标准化疗方案治疗NSCLC,一般在治疗的4~6个月后出现疾病进展,且患者总体缓解率仅达20%~35%,中位生存期仅为8~10个月,1年生存率只有30%~40% [8]。近年来,由于免疫检查点抑制剂及其抑制通路的大量研究使得肺癌的免疫治疗取得了突飞猛进的进展。免疫检查点通过免疫系统中存在一些抑制性通路调节免疫反应使组织避免损伤,并参与维持对于自身抗原的耐受 [9],而肺癌逃避免疫杀伤的方法正是通过免疫检查点的抑制性信号通路抑制T细胞活性。本文通过meta分析的方法,评价目前研究较为成熟的免疫检查点抑制剂与单纯化疗相比治疗肺癌的疗效及安全性。
2. 材料与方法
2.1. 纳入标准
2.1.1. 研究对象
经病理学或细胞学诊断明确的晚期肺癌患者,非小细胞肺癌TNM分期在IIIb期及以上,小细胞肺癌广泛期,ECOG评分0~3分。
2.1.2. 研究类型
公开发表的RCT,语言限定为中、英文,文献发表时间至2016年12月。
2.1.3. 干预措施
治疗组为接受免疫检查点抑制剂联合或不联合化疗,对照组则为单纯接受化疗组,其中免疫检查点抑制剂治疗剂量不限。
2.1.4. 结局指标
总生存期(overall survival, OS)、无进展生存期(progression free survival, PFS)、有效率、治疗相关3~4级不良反应。依据实体瘤疗效评价标准2.1版评价有效率 [10]。
2.2. 排除标准
① 非RCT研究;② 摘要、综述性文献、病例报道;③ 重复发表的研究,以最近年限发表的文献为准。
2.3. 检索策略
计算机检索PubMed、中国期刊全文数据库(CNKI)、维普数据库(VIP)、中国生物医学文献数据库(CBM)、万方数据库、The Cochrane Library等数据库,查找免疫检查点抑制剂联合化疗治疗NSCLC的随机对照试验(randomized control trial, RCT)。文献检索采用的主题词包括:肺癌、免疫检查点、化疗、lung cancer、immune checkpoint、chemotherapy、Nivolumab、Ipilimumab、Pembrolizumab、Atezolizumab。
2.4. 文献筛选及资料提取
文献的筛选及资料提取由两名研究者独立完成,按照事先设定的纳入与排除标准筛选文献,提取资料的提取按照事先设定的资料提取表,意见不一致时由第三方决定。
2.5. 质量评价
按照Cochrane协作网偏倚风险评价标准 [11] 推荐的RCT质量评价标准对符合纳入标准的临床试验进行方法质量学评价,评价由两名研究者独立完成,意见不一致时咨询第三方决定。
2.6. 统计学分析
对收集的数据采用RevMan5.2软件进行meta分析,异质性检验的方法采用χ2检验,若异质性检验结果为P > 0.1时,认为多个研究结果有同质性,采用固定效应模型计算其合并统计量,当P ≤ 0.1时,
认为多个研究结果有异质性,异质性的大小用I2衡量,
(Q为异质性检验的χ2值,
K为纳入meta分析的RCT个数),I2 ≤ 50%其异质性可以接受,若I2 > 50%,则采用随机效应模型处理数据。采用相对危险度(relative risk, RR)和风险比(hazard ratios, HR)为效应量,各效应量以95%置信区间(95%CI)表示,P < 0.05为差异有统计学意义。
3. 结果
3.1. 检索结果
本研究共检索出487篇文献,其中包括英文文献309篇,中文文献178篇,RCT有23篇,参照文献的纳入和排除标准,最终有6个RCT符合纳入标准 [12] - [17],共纳入了2509例晚期肺癌患者,其中治疗组即免疫检查点抑制剂组1485例,对照组即化疗组1024例。
3.2. 纳入研究的基本特征
见表1。

Table 1. Basic characteristics of the included literature
表1. 纳入研究文献的基本特征
3.3. 纳入研究的质量评价
见表2。

Table 2. Quality evaluation of the included literature
表2. 纳入研究的质量评价
3.4. 异质性检验
分别以OS、PFS、有效率、治疗相关3~4级不良反应发生率进行效应指标的异质性检验。有效率及治疗相关3~4级不良反应发生率存在异质性(P < 0.1),采用随机效应模型进行meta分析;OS及PFS无异质性(P > 0.1),采用固定效应模型进行meta分析。
3.5. Meta分析结果
3.5.1. 有效率
6个研究均报道了有效率 [12] - [17]。meta分析结果显示如图1所示,免疫检查点抑制剂组有效率明显高于单纯化疗组,差异具有统计学意义(RR = 1.48, P < 0.05, 95%CI: 1.08~2.03)。
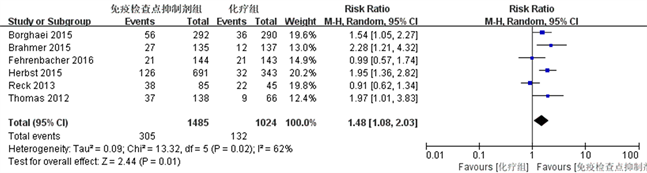
Figure 1. Meta-analysis of response rate
图1. 有效率的Meta分析
3.5.2. PFS
6个研究报道了PFS [12] - [17]。meta分析结果显示如图2所示,2组PFS差异有统计学意义(HR = 0.83, P < 0.0001, 95%CI: 0.77~0.91),免疫检查点抑制剂组PFS明显高于单纯化疗组。
3.5.3. OS
6个研究报道了OS [12] - [17]。meta分析结果显示如图3所示,免疫检查点抑制剂组OS明显高于单纯化疗组,差异有统计学意义(HR = 0.71, P < 0.00001, 95%CI: 0.65~0.78)。
3.5.4. 治疗相关3~4级不良反应
5个研究报道了治疗相关3~4级不良反应 [13] [14] [15] [16] [17]。随机效应模型meta分析结果显示如图4所示,免疫检查点抑制剂组治疗相关3~4级不良反应与单纯化疗组相比,差异无统计学意义(RR = 0.43, P = 0.08, 95%CI: 0.17~1.09)。
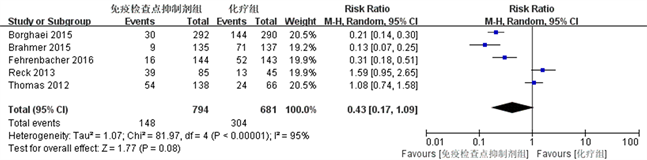
Figure 4. Meta-analysis of grade 3~4 treatment-related adverse events
图4. 治疗相关3~4级不良反应的Meta分析
4. 讨论
免疫系统在控制肿瘤发展中起重要作用,肿瘤能够诱导免疫抑制、逃避免疫摧毁,肿瘤微环境存在大量功能失调的免疫细胞,其可以利用免疫调节途径逃避宿主细胞免疫 [18]。作为近年来兴起的治疗药物,免疫检查点抑制剂的显著效果使其成为肺癌治疗领域的热点,也成为未来治疗的发展方向,尤其当免疫检查点抑制剂与传统肺癌治疗方式联合时可以使得肺癌的预后更佳。目前临床上研究较为成熟的肺癌免疫检查点抑制剂主要包括细胞毒性T淋巴细胞相关抗原4 (CTLA-4)的抑制性抗体及程序性细胞死亡蛋白-1 (PD-1)及其配体(PD-L1)的抑制性抗体。其中PD-1大部分表达于活化T细胞表面,其功能是主要是抑制T细胞的激活,通过与PD-L1、PD-L2相互作用传递抑制性信号进而发挥负调控作用调控免疫应答。由于肿瘤细胞高表达PD-L1,PD-1与PD-L1/PD-L2结合,从而发挥抑制T细胞的抗肿瘤活性,所以要阻止这种机制介导的免疫抑制作用,就要阻断PD-L1与PD-1的结合,抗PD-1/PD-L1抗体通过阻断PD-1/PD-L1信号通路的激活使得T细胞功能发挥正常功能,从而减少免疫逃逸,提高抗肿瘤效应 [19] [20] [21]。PD-1抗体相关药物:Nivolumab、Pembrolizumab。PD-L1抗体相关药物:Atezolizumab。CTLA-4表达于T细胞表面,是调控T细胞活化与增殖的重要负性检查点 [22],可与CD28竞争性结合APC表面的B7,当CTLA-4与APC表面B7结合时,T细胞的活化就会受到抑制,最终导致肿瘤免疫逃逸,而CTLA-4抗体通过抑制CTLA-4与B7的结合,增强机体的抗肿瘤作用 [23]。CTLA-4人源化单克隆抗体打破免疫耐受、增强T细胞的活性主要是通过抑制活化T细胞的CTLA-4与抗原递呈细胞的B7结合,其中主要代表药物包括Ipilimumab和tremelimumab。
本meta分析纳入的6项研究 [12] - [17] 中,主要包含的免疫检查点抑制剂有Nivolumab、Ipilimumab、Pembrolizumab、Atezolizumab,免疫检查点抑制剂治疗组有两项研究使用免疫检查点抑制剂联合了化疗 [13] [17],其余四项研究均未联合化疗 [12] [14] [15] [16],虽然本文纳入的研究中采用分配隐藏及盲法的试验较少,因此本文存在一定的选择性偏倚,但6项研究 [12] - [17] 多为经典的大样本、多中心的随机对照临床试验,而且按照Cochrane协作网偏倚风险评价标准,本文的主要结局指标有效率、无进展生存期及总生存期均为比较客观的衡量指标,所以结果的评估受到未实施盲法及分配隐藏的影响较小,故本meta分析的结果是稳定可信的,且可成为肺癌临床治疗的循证医学依据。meta分析结果显示与化疗组相比,免疫检查点抑制剂组可显著提高肺癌患者的有效率,显著延长患者的无进展生存期及总生存期,并不显著降低患者治疗相关3~4级不良反应。因此,对于晚期肺癌的患者使用免疫检查点抑制剂联合化疗临床获益大于单纯化疗。