摘要: 目的:基于RhoA/ROCK信号通路研究电针抑制膝骨关节炎软骨细胞凋亡、延缓退变的作用机制。方法:选择2月龄SD雄性大鼠50只,随机分为5组,即正常组、模型组、电针膝眼组、电针非穴组和抑制剂组。选用改良Hulth手术建立大鼠膝骨性关节炎模型,正常组不作干预,模型组和抑制剂组于两电针组电针治疗时给予同样的抓取和袜套固定15 min,电针膝眼组予内外膝眼电针15 min,电针非穴组予电针非经非穴15 min以作对照,抑制剂组大鼠每次腹腔注射0.1 ml Y-27632溶液,1天注射1次,每周连续注射5天,休息2天,连续注射12周。两组电针均采用疏密波刺激模式,脉冲频率调节2/10 Hz,强度0.5~1.5 mA,以肌肉局部开始抽搐,大鼠不挣扎为度。每周干预5天,1天干预1次,共干预12周。收集大鼠右侧膝关节软骨组织,通过HE染色观察各组软骨组织形态学变化,Western Blot法检测软骨组织中RhoA/ROCK信号通路上RhoA、ROCK、ERK1/2、p-ERK1/2、Bax及Bcl-2等相关蛋白表达情况。结果:HE染色结果显示:电针膝眼组和抑制剂组的关节软骨组织形态均较模型组或电针非穴组有明显改善,而电针膝眼组和抑制剂组两组间的差异不明显。Western Blot结果显示:与模型组或电针非穴组相比,电针膝眼组和抑制剂组均明显下调了RhoA、ROCK、ERK1/2、bax等蛋白的表达水平,上调Bcl-2的蛋白表达水平,差异均具有显著意义(P < 0.01),而电针膝眼组和抑制剂组两组间的差异无统计意义(P > 0.05)。结论:电针膝眼穴可有效减轻膝骨关节炎大鼠软骨组织形态的损伤程度,电针膝眼穴通过调控RhoA/ROCK信号通路,下调软骨组织中RhoA、ROCK、ERK1/2、bax等关键蛋白的表达水平,上调Bcl-2的蛋白表达水平,抑制关节软骨细胞凋亡,减轻软骨破坏,维持关节软骨结构的相对完整性,从而达到延缓软骨退变的作用。
Abstract:
Objective: Based on the RhoA/ROCK signaling pathway, to study the mechanism of electroacu-puncture in inhibiting chondrocyte apoptosis and delaying degeneration in knee osteoarthritis. Methods: Fifty 2-month-old male SD rats were selected and randomly divided into 5 groups, namely normal group, model group, electroacupuncture knee-eye group, electroacupuncture non-acupoint group and inhibitor group. The modified Hulth operation was used to establish a rat model of knee osteoarthritis. The normal group was not intervened. The model group and the inhibitor group were given the same grasping and sock fixation for 15 min during the electroacupuncture treat-ment in the two electroacupuncture groups. Electroacupuncture knee-eye group was given to the eyes of the inner and outer knees for 15 min, and the electroacupuncture non-acupoint group was given electroacupuncture to non-meridian and non-acupoints for 15 min as a control. The rats in the inhibitor group were intraperitoneally injected with 0.1 ml of Y-27632 solution each time, once a day, continuously every week. 5 days of injection, 2 days of rest, 12 weeks of continuous injection. Both groups of electroacupuncture used the sparse-dense wave stimulation mode, the pulse fre-quency was adjusted to 2/10 Hz, and the intensity was 0.5~1.5 mA. The strength is based on the fact that the muscle starts to twitch locally and the rats do not struggle. Intervention was conducted 5 days a week, once a day, for a total of 12 weeks. The cartilage tissue of the right knee joint of the rats was collected, and the morphological changes of the cartilage tissue in each group were observed by HE staining, and detect the expression of RhoA, ROCK, ERK1/2, p-ERK1/2, Bax, Bcl-2 and other re-lated proteins on rhoa/ROCK signal pathway in the cartilage tissue by Western blot. Results: HE staining results showed that the morphology of articular cartilage in the electroacupuncture knee-eye group and the inhibitor group was significantly improved compared with the model group or the electro-acupuncture non-acupoint group, while the difference between the electroacupunc-ture knee-eye group and the inhibitor group was no significant. Western Blot results showed: Com-pared with the model group or the electroacupuncture non-acupoint group, the electroacupuncture knee eye group and inhibitor group significantly down-regulated the expression levels of RhoA, ROCK, ERK1/2, bax and other proteins, and up-regulated the expression levels of Bcl-2. There were significant differences in protein expression levels (P < 0.01), while there was no significant differ-ence between the electroacupuncture knee-eye group and the inhibitor group (P > 0.05). Conclusion: Electro-acupuncture at knee-eye point can effectively reduce the damage degree of cartilage tissue morphology in rats with knee osteoarthritis. Electro-acupuncture at knee-eye point can regulate RhoA/ROCK signaling pathway and down-regulate RhoA, ROCK, ERK1/2, bax, etc. in cartilage tissue. The expression level of key proteins increases the protein expression level of Bcl-2, inhibits the apoptosis of articular cartilage cells, reduces cartilage damage, and maintains the relative integrity of articular cartilage structure, thereby delaying cartilage degeneration.
1. 引言
膝骨关节炎(knee osteoarthritis, KOA)是以关节软骨退变后继发骨赘形成生、关节间隙变窄和滑膜炎性增生等病理变化的老年性骨关节疾患,其病程具有一定进展性和相对不可逆性 [1]。KOA具有发病率高、致残率高的特点,对患者和社会造成很大影响,目前KOA已成为威胁中老年人健康的重大疾患之一 [2]。因此,积极探寻一种能够有效治疗或延缓KOA退变的疗法极具意义。
KOA属中医“膝痹”范畴,病位在膝府、筋骨,病性属“本虚标实、本萎标痹”,电针具有补肾壮筋以起萎、疏经通络止痛以除痹的功效,从而达到标本兼治的作用,因此从理论上说电针尤适用于膝骨关节炎的临床应用。此前研究也证实了,电针可有效抑制软骨细胞凋亡,延缓膝骨关节炎的发生发展,因此被临床广泛运用 [3]。近年来研究发现RhoA/ROCK信号通路参与了细胞凋亡的调控,并与炎症反应密切相关 [4],其中Bax促凋亡蛋白和Bcl-2抗凋亡蛋白之间的表达平衡对细胞存活和死亡的影响最为关键,Bax/Bcl-2比值增加可激活体内细胞凋亡途径 [5]。RhoA/ROCK异常激活可促进Bcl-2高表达,阻止软骨细胞经线粒体或死亡受体依赖的途径发生凋亡,而ERK磷酸化具有负调控Bax的抗凋亡效应。因此,该信号通路的异常激活是软骨细胞凋亡的关键机制之一 [6]。本研究从RhoA/ROCK信号通路探讨电针对膝骨关节炎模型大鼠软骨细胞凋亡的影响。
2. 实验材料
2.1. 实验动物
选购50只SPF级2月龄雄性SD大鼠,体质量200 ± 20 g。动物实验在福建中医药大学实验动物中心/SPF级动物实验室完成(使用许可证号:SYXK(闽)2019-0005)。
2.2. 实验试剂
10%水合氯醛、HE染色试剂盒、骨组织提取试剂盒(博士德)、PMSF蛋白酶抑制剂、RIPA裂解液、蛋白质分子量标准、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒(碧云天)、SDS-PAGE蛋白上样缓冲液、TBS-T、ECL Plus化学发光显影试剂盒、SDS-PAGE电泳缓冲液、转膜液、western blot相关试剂、PVDF膜−0.45 μm、以及考马斯亮蓝-R250染色液等。
2.3. 实验仪器
华佗牌SDZ-II型电子针疗仪、华佗牌一次性无菌毫针(规格:0.25 mm * 13 mm)以及RM2135切片机、DM4000B显微图像采集系统(德国Leica公司),ELx800全自动酶标仪(美国BIO-TEK公司),Real-time PCR 仪(7500,美国ABI公司),Trans-Blot Trubo半干转转膜仪、化学发光成像系统(美国BIO-RAD公司)。常用手术刀、剪刀、镊子、止血钳等常规手术器械等。
3. 实验方法
3.1. 分组及造模方法
适应性喂养SD大鼠2周,采用分层随机法将SD大鼠50只分入正常组和造模组,正常组10只,而造模组40只。造模组大鼠按3.5 ml/Kg的10%水合氯醛腹腔注射麻醉,然后采用改良Hulth造模法建立大鼠膝骨性关节炎模型 [7]:术取膝关节内侧入路,先将内侧副韧带切断、将内侧半月板摘除、并切断前交叉韧带,术后缝合创面;并给予每只大鼠腹腔注射青霉素20万U/天,以预防关节感染,连续注射3天;同时于第2天通过抽签法将40只造模组大鼠再次随机分成4组,即模型组(Model)、电针膝眼组(EA-XY)、电针非穴组(EA-NP)和抑制剂组(Y-27632),每组各10只,并于造模1周后开始干预。
3.2. 干预方法
① 取穴及定位参照《实验针灸学》、《中国兽医针灸学》并结合动物比较学方法定位 [8]:内膝眼(在髌骨内侧,膝关节内侧凹陷处)、外膝眼(在髌骨外侧,膝关节外侧凹陷处)、非穴1 (在后正中线旁开20 mm,与髂嵴直上10 mm交点的非经非穴处)、非穴2 (在后正中线旁开25 mm,与髂嵴直上15 mm交点的非经非穴处)。② 各组干预方法:2个EA组均用黑色袜套固定仰卧位,暴露穴位,龙胆紫定位,针刺采用华佗牌一次性0.5寸无菌毫针(规格Φ0.25 mm × 13 mm),EA-XY组于双侧内外膝眼穴垂直刺入毫针4 mm,EA-NP组于非穴1和非穴2向上斜30˚刺入4 mm。抑制剂组:每只大鼠每次腹腔注射0.1 ml Y-27632溶液,一天一次,每周连续注射5天,休息2天,连续注射12周。③ 电针参数:针刺后2个EA组均加电针仪刺激干预,EA-XY组于每侧内外膝眼穴的针柄根部上方接一组电极,EA-NP组则接在每侧非穴1和非穴2,设置输出脉冲为疏密波,强度0.5~1.5 mA,频率2/10 Hz,以大鼠局部肌肉抽搐,不挣扎为度。④ 各组干预时间:两电针组每次均电针干预15 min,1天1次,每周5天,休息2天,共干预12周。正常组大鼠不做任何干预,模型组大鼠和抑制剂组大鼠在两电针组干预时给予同样的抓取和袜套固定15 min。(临床上电针治疗骨性关节炎患者的常用时间为30 min,大鼠干预时间参照实验动物的平均体重,采用Meeh-Rubner氏公式,计算出大鼠电针干预15 min等效于临床人体干预30 min的治疗时间 [9])。
3.3. 取材方法
各组干预后腹腔下10%水合氯醛麻醉取材。切取股骨内侧髁软骨,手术刀片轻刮关节面表层取下软骨组织,放置于液氮冷冻降温,24 h后转移至−80℃冰箱冻存。
3.4. 检测方法
① 大体观察关节软骨面情况各组大鼠随机均截取部分股骨髁和胫骨平台,于自然光线视野下肉眼大体对比观察各组关节软骨面情况,并拍照保留存。
② HE染色法观察关节软骨形态变化各组软骨组织制片后经二甲苯脱蜡、梯度酒精入水、苏木素染色、洗涤、分色、返蓝、伊红染色、梯度酒精脱水、二甲苯透明、中性树胶封片等步骤后,采用显微镜对比观察软骨形态变化,并拍照保存。
③ Western Blot检测组织中RhoA/ROCK通路上相关蛋白表达 经过样品总蛋白提取,BCA检测法对各组样品蛋白定量、蛋白变性等处理环节后,进行SDS-PAGA电泳,配制SDS-PAGE凝胶,配方如下表1。
随后进行蛋白样品准备,上样和SDS-PAGE垂直电泳,连接APC300电泳仪,设置电泳条件,先用20 V电压预跑10 min,随后在80 V恒压下电泳上层分离胶,在溴酚蓝标记线电泳至浓缩胶与分离胶分界线时,切换电压至100 V条件下再电泳约70 min,待电泳使染料条带适度分离,且距离胶底约1 cm位置时结束电泳。然后采用考马斯亮蓝染色法检测胶中蛋白,历经转膜、封闭及抗体孵育后,进行蛋白成像及分析:1) 采用ECL化学发光显影:首先将PVDF膜从二抗中取出,置于摇床上1 × TBST洗膜3次× 10 min,以去除残留抗体;根据PVDF膜大小配制适量ECL显影液,A液:B液 = 1:1,充分混匀,现配现用;滤纸吸除PVDF膜周围多余液体,将配制好的ECL显影液均匀滴加在膜表面的目的蛋白区,室温反应2 min。2) 蛋白图像采集与分析:采用ChemiDoc XRS + 凝胶成像分析系统扫描目的蛋白图像,Image Lab软件识别蛋白泳道和条带,并分析各目的蛋白灰度值;各指标的相对蛋白含量 = 目的蛋白灰度值/β-actin灰度值,对其数据进行统计分析。

Table 1. SDS-PAGE electrophoresis gel formulation table
表1. SDS-PAGE电泳凝胶配方表
3.5. 统计方法
数据统计使用SPSS 22.0软件包进行分析,计量资料采用x ± s表示;两组间比较选取t检验与单因素方差分析;各组间比较采用χ2检验,P < 0.05为差异有统计意义。
4. 实验结果
4.1. 膝骨性关节炎模型大鼠鉴定结果
① 大体观察
正常组软骨表面光滑,为淡蓝色,色泽透亮,关节表面未见纤维化及骨赘形成;模型组软骨表面较粗糙,局部见缺损凹陷,色泽较灰暗,局部区域软骨周边可见骨赘形成。
② 镜下对比观察关节形态
HE染色后镜下见,正常关节软骨四层结构清晰,表层较光整较厚、细胞呈现“背靠背”分布,未发现明显簇集现象,无炎性细胞浸润,软骨细胞分布较均匀(图1(a))。模型组关节表面凹凸不平,软骨局部表层缺损变薄,纤维成分增多,光泽较正常软骨淡暗,且软骨表层细胞明显减少,细胞“背靠背”现象分布消失,深层可见软骨细胞簇集(图1(b))。
 (a) (b)注:(a):正常组,(b):模型组
(a) (b)注:(a):正常组,(b):模型组
Figure 1. Comparison and identification results of OA model rats (200×)
图1. OA模型大鼠对比鉴定结果(200×)
4.2. 各组HE染色结果对比
正常组:关节软骨四层排列规整、结构清晰,表层光滑分布无缺损,细胞密集成梭形排列,与软骨表面走行一致。软骨细胞周围被蓝染,放射层最蓝,四周逐渐变淡;软骨潮线规整清晰,软骨基质被均匀红染,松质层骨小梁密度适中,软骨下骨致密层厚薄适中(图2(a))。
模型组:关节软骨表层变粗糙变薄,表层很不完整,局部软骨增厚,软骨纤维化明显,可见部分区域软骨表面几乎被破坏殆尽;部分软骨细胞出现凋亡现象,细胞“背靠背”消失,排列较乱,呈增殖簇集现象;软骨潮线分布不规整,软骨基质纤维化;软骨下骨伴局部增生,并嵌入软骨层内,髓腔开放、扩大,致密层变薄(图2(b))。
电针膝眼组和抑制剂组:两组的软骨表层裂缝较少,组织损伤程度轻于模型组,整细胞体排列较规整齐,局部区域排列欠齐,但总体上明显比模型组和电针非穴组要好,软骨深层结构清晰,表层细胞形态结构较正常,组织各结构较规则,软骨潮线较规整,极少数部位出现细胞簇聚,电针膝眼组与抑制剂组两组间形态变化差异不明显(图2(c)、图2(d))。
电针非穴组:关节软骨表面变粗糙变薄,表层不完整,部分软骨表层成纤维化变性,破坏较严重,软骨细胞成簇集聚、排列紊乱,软骨潮线分布不规整,软骨下骨有局部增生嵌入软骨层,与模型组相比未见有明显改善(图2(e))。
4.3. 电针膝眼穴对软骨组织RhoA/ROCK通路上相关蛋白表达的影响
Western blot结果显示,模型组的RhoA、ROCK、ERK1/2、p-ERK1/2、Bax的蛋白表达量较正常组均有明显升高,而Bcl-2蛋白表达量及Bcl-2/Bax比值均较正常组明显降低,差异均具有统计意义(P < 0.05)。与模型组或电针非穴组比较,电针膝眼组和抑制剂组的RhoA、ROCK、ERK1/2、p-ERK1/2、Bax的蛋白表达量均出现不同程度下降,Bcl-2蛋白表达量及Bcl-2/Bax比值均升高,差异均具有统计学意义(P < 0.05);电针非穴组与模型组比较,RhoA、ROCK、ERK1/2、p-ERK1/2、Bax、Bcl-2的蛋白表达量及Bcl-2/Bax比值差异均无统计学意义(P > 0.05);电针膝眼组与抑制剂组的RhoA、ROCK、ERK1/2、p-ERK1/2、Bax、Bcl-2的蛋白表达量及Bcl-2/Bax比值差异亦均无统计学意义(P > 0.05) (见图3)。

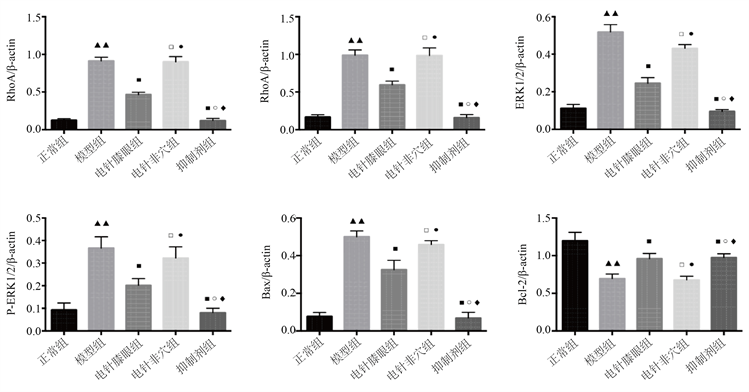 注a:与正常组比较:▲P < 0.05,▲▲P < 0.01;注b:与模型组比较:□P > 0.05,■P < 0.05,■■P < 0.01;注c:与电针膝眼组比较:P > 0.05,●P < 0.05,●●P < 0.01;注d:与电针非穴组比较:◊P > 0.05,♦P < 0.05,♦♦P < 0.01。
注a:与正常组比较:▲P < 0.05,▲▲P < 0.01;注b:与模型组比较:□P > 0.05,■P < 0.05,■■P < 0.01;注c:与电针膝眼组比较:P > 0.05,●P < 0.05,●●P < 0.01;注d:与电针非穴组比较:◊P > 0.05,♦P < 0.05,♦♦P < 0.01。
Figure 3. The protein expression levels of RhoA, ROCK, ERK1/2, p-ERK1/2, Bax and Bcl-2 in cartilage tissue of each group
图3. 各组软骨组织RhoA、ROCK、ERK1/2、p-ERK1/2、Bax、Bcl-2蛋白表达量
5. 讨论
RhoA是Ras超家族中G蛋白的主要成员之一,为小分子蛋白,具有GTP酶活性。RhoA作为细胞信号转导通路的小分子开关,在多种细胞因子和炎性介质的诱导下,RhoA活化并激活其下游靶分子ROCK,引起细胞粘附迁移、肌动蛋白细胞骨架重构、细胞凋亡等多种生物学效应 [10]。RhoA/ROCK信号转导通路是影响细胞行为改变较直接的信号通路,相关研究认为,RhoA/ROCK信号通路可能受炎性介质诱导激活,间接影响了关节软骨退变的病理进程,多类炎性介质和细胞因子的活化均可不同程度地激活RhoA/ROCK信号通路。被TNF-α、IL-1等炎性介质活化的RhoA能够调节多种转录因子的活性,如RhoA激活ROCK能够进一步促使细胞P38/MPK2和JNK/SAPK通路的激活,从而间接影响SOX-9的基因和蛋白表达,发挥调节软骨细胞功能的作用 [11]。MAPK家族包括ERKl/2、P38MAP激酶、JNK,活化的RhoA和ROCK能够协同Ras-Raf-MEK通路而共同影响下游ERK1/2的活性,因此通过这一系列激酶活性的逐级放大反应,炎性介导的RhoA/ROCK通路的活化可激活ERK1/2通路,促使ERK1/2发生磷酸化转变为p-ERK1/2,然后进入细胞核影响组织细胞促凋亡因子Bax的合成与分泌,从而使RhoA-ROCK-ERK1/2-Bax构成一条新的调控软骨细胞凋亡的信号传导通路 [12] [13]。RhoA/ROCK通路可调控ERK1/2蛋白的细胞定位与活性。正常情况下每个ROCK蛋白的一级序列中会含有两个相同的ERK结合位点,通常此位点均被羧基末端覆盖隐藏,阻止ROCK与ERK1/2相互结合;而当两者发生结合时,ROCK构象改变,它的羧基端迅速翻转并暴露出ERK结合位点,此时ERK1/2与ROCK结合,ERK1/2的生物活性遭到一定抑制,并受ROCK影响大部分重新分布于细胞的胞质内。在膝骨性关节炎软骨细胞中,被炎症因子激活的RhoA/ROCK随即释放出大量ERK1/2小分子蛋白,促使ERK1/2从细胞质转运至细胞核,且活性急剧升高,触发调亡起始信号的启动。通路上被异常活化的ERK1/2一方面促进Bax促调亡分子蛋白的活性表达。另一方面促使Bax进一步形成同二聚体,引起线粒体膜转位,增高线粒体通透性,造成细胞色素C内流至细胞质内,从而活化Caspase-3与Caspase-9等凋亡信号执行因子,导致软骨细胞调亡进程加速 [14]。
本实验结果显示,模型组的RhoA、ROCK、ERK1/2、Bax的mRNA及蛋白表达量较正常组均有明显升高,而Bcl-2的mRNA表达量及蛋白均较正常组明显降低,差异均具有统计学意义(P < 0.05),说明膝骨性关节炎软骨细胞的RhoA/ROCK通路被激活。与模型组比较,电针膝眼组和抑制剂组的RhoA、Rock、ERK1/2、Bax的mRNA及蛋白表达量均出现不同程度下降,Bcl-2的mRNA及蛋白表达量升高,差异均具有统计意义(P < 0.05);电针非穴组与模型组比较,RhoA、ROCK、ERK1/2、Bax、Bcl-2的mRNA及蛋白表达量差异均无统计学意义(P > 0.05);电针膝眼组与抑制剂组的RhoA、ROCK、ERK1/2、Bax、Bcl-2的mRNA及蛋白表达量差异亦均无统计学意义(P > 0.05)。综上实验结果说明,电针膝眼穴可通过调控RhoA/ROCK信号转导通路,下调RhoA、ROCK、ERK1/2、bax等相关基因和蛋白的表达,上调Bcl-2的基因和蛋白表达,抑制关节软骨细胞凋亡,从而达到延缓关节软骨退变作用。
基金项目
由福建省卫生健康科研人才培养项目(编号2019-CX-39)资助。
NOTES
*第一作者叶国平(1988.11-),男,医学博士,厦门市中医院针灸科二区医师,主要研究方向:针灸防治骨与关节病的基础与临床研究。
#通讯作者吴明霞(1965.05-),女,医学博士,博士生导师,福建中医药大学附属第二人民医院主任医师,研究方向:针灸防治骨与关节病的基础与临床研究。Email: wumingxiafz@163.com