1. 引言
随着时代的快速发展和生活质量的提高,环境问题逐渐成为人们关注的热点问题。纤维素废弃物是日常生活中常见的废弃物,一般通过室外焚烧进行处理,而焚烧产生的大量温室气体和颗粒物是导致空气质量降低、雾霾天气增多以及全球变暖等问题的主要“元凶” [1]。研究发现,纤维素酶可作为纤维素废弃物的水解酶,能将其有效降解,不仅解决了环境污染问题,还在食品、饲料、纺织、造纸业等领域有广阔的应用前景 [2] [3]。
鉴于盐碱地区土壤的理化性质,盐碱化土壤含盐量较大,植物凋谢物是盐碱化土壤营养物的主要来源之一,纤维素是植物凋谢物的主要成分之一 [4]。因此筛选出可降解纤维素的耐盐菌对解决盐碱地区的资源循环利用问题和环境污染问题具有重要意义。嗜盐真菌与其他极端微生物相比更易培养,且对菌培养条件要求不苛刻,具有很大的发展潜能 [5]。已有文献报道:在高盐环境生长的真菌Penicillium sp. NICS01可以作为生物肥料和生物防治剂来改善植物生长,提高植物抵抗盐斜坡和枯萎病病菌感染的能力 [6];工业上使用的嗜盐酶很多也都是来自嗜盐菌,嗜盐酶因其特殊的活性,可应用于处理海产品、酱制产品以及化工、制药、石油、发酵等排放含高浓度无机盐废水的工业部门 [7]。
本研究从盐碱地区筛选出具有生产嗜盐性纤维素酶的菌株,并对其最适温度、pH等酶学性质进行探究,为该菌种的选育和实际应用提供了理论基础,为耐盐纤维素酶的开发和应用提供依据。
2. 材料与方法
2.1. 实验材料
样品采自青海茶卡盐湖的泥层土样100 g,海拔3059 m,北纬36˚20'60,东经99˚02'21。
2.2. 产纤维素酶真菌菌株的筛选
通过稀释涂布法(10−1、10−3、10−4)对样品进行初筛,将150 µL的稀释菌悬液涂布到2.5%和5%盐浓度的PDA固体培养基中倒置培养3 d [8],挑取单菌落菌丝四区划线法直至得到纯化菌种;复筛通过刚果红染色法 [9],选取水解圈与菌圈直径比(D/d值)较大的菌株于恒温摇床中27℃、180 r∙min−1液体发酵,4 d后4℃、8000×g离心15 min取上清作为粗酶液进行酶活力测定 [10] [11]。结合D/d值和酶活力大小确定高产纤维素酶菌株。液体发酵培养基:10 g∙L−1羧甲基纤维素钠(CMC)、4 g∙L−1 (NH4)2SO4、1.2 g∙L−1 MgSO4∙7H2O、1 g∙L−1 KH2PO4、1 g∙L−1 K2HPO4、1 g∙L−1 NaNO3、0.5 g∙L−1酵母粉、50 g∙L−1 NaCl/25 g∙L−1 NaCl。
2.3. 产纤维素酶真菌菌株的形态观察
制作高产纤维素酶菌株的玻片 [12] 在显微镜下观察其菌体形态。
2.4. 产纤维素酶真菌菌株的分子生物学鉴定
挑取少量真菌菌丝于25 µL含2% CTAB (十六烷基三甲基溴化铵)的TE缓冲液(pH 8.5)中,PCR仪中98℃裂解30 min,10,000×g离心10 min,取上清液作为真菌基因组模板。利用真菌核糖体RNA基因间隔区序列(ITS)通用引物(ITS4:TCCTCCGCTTATTGATATGC,ITS5:GGAAGTAAAAGTCGTAACAAGG),使用Taq酶进行PCR扩增。利用琼脂糖凝胶电泳跑出DNA条带后,送擎科生物科技有限公司进行测序。测序获得序列与NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中序列进行比对,利用MEGAX的邻位法(Neighbor joining)构建系统发育树,根据菌株间的亲缘关系确定菌株的种属 [13] [14]。
2.5. 菌株产酶最适碳源的筛选
将筛选出的高产纤维素酶菌株(F33)接种于100 mL初始pH为7.0,1%不同碳源(小麦、玉米、稻秆、杨木、松木)的产酶发酵液中28℃、180 r∙min−1培养96 h后取样,对所得粗酶液进行酶活测定 [15] [16],确定其最适碳源。
2.6. 粗酶液中纤维素酶最适反应温度和温度的影响力测定
在已知的最适条件下,以初始pH为7.0、浓度为1%的CMC作为底物与粗酶液在不同温度下(0℃~90℃)反应相同时间,以确定F33来源纤维素酶最适反应温度 [17] [18]。通过将粗酶液在不同温度(40℃、45℃、50℃)下孵育不同时间(0、20、40、60、80、100 min)后,测定其残留活性 [19] [20],来探究温度对F33来源纤维素酶稳定性的影响,以未处理(0 min)粗酶液为阳性对照(100%)。
2.7. 粗酶液中纤维素酶最适pH和pH的影响力测定
在已知的最适条件下,用不同pH缓冲液(磷酸二氢钠–柠檬酸缓冲液pH 3.0~8.0、氢氧化钠–甘氨酸缓冲液pH 8.0~10.0)将CMC稀释到1%后,与粗酶液反应相同时间,以确定F33来源纤维素酶最适反应pH [21] [22]。将粗酶液与不同pH缓冲液(pH 3.0~10.0) 1:1混合,在4℃孵育12 h和24 h后测其残留活性 [23] 以确定pH对F33来源纤维素酶的影响。
2.8. 盐浓度对纤维素酶的影响
在已知的最适条件下,将0.5 M、1.0 M、1.5 M、2.0 M、2.5 M、3.0 M、3.5 M的NaCl加入到1%的CMC中作为酶促反应的底物,取粗酶液测其残留活性 [24],以确定盐浓度对F33来源纤维素酶的影响。
2.9. 不同金属离子和抑制剂对纤维素酶活力的影响
在已知的最适条件下,取粗酶液分别加入1 mM和10 mM不同金属离子(K+、Mg2+、Fe3+、Ca2+、Ni2+、Ba2+、Mn2+、Pb2+、Zn2+和Al3+)以及0.1%和1%的化学试剂[乙二胺四乙酸二钠(EDTA)、十二烷基硫酸钠(SDS)、苯甲基磺酰氟(PMSF)和二硫苏糖醇(DTT)]进行酶活测定 [25],以确定金属离子和抑制剂对F33来源纤维素酶的影响,其中无添加剂的反应混合物作为对照(100%)。
2.10. 发酵时间对产纤维素酶的影响
将菌株F33种子液,以1%接种量接种于发酵培养基中,27℃,180 r/min震荡培养,每12 h取上清进行酶活测定 [26],以确定F33来源纤维素酶的最适发酵时间。
3. 结果与分析
3.1. 产纤维素嗜盐菌的筛选
通过刚果红染色法共筛选出42株菌株有透明圈,有16株菌圈直径比(D/d值) > 1,如表1所示。其中菌株F33在刚果红培养基上的透明圈最大,直径为90 mm,菌落直径为210 mm,菌圈直径比(D/d值)约为2.33 (图1)。16株菌株酶活测定结果如图2所示,F28、F33、F53的纤维素酶活性相对较高,其中F33的酶活性最高。

Figure 1. The halophilic cellulase hydrolysis rings by F33 strain
图1. 菌株F33嗜盐纤维素酶水解圈

Figure 2. The relatively cellulase activity in fermentation medium of various strains
图2. 各菌株发酵培养基中相对纤维素酶活力

Table 1. Diameter of hydrolysis circle and cell diameter on Congo red plate of each strain
表1. 各菌株刚果红平板上水解圈直径以及菌体直径
3.2. 产纤维素酶菌株F33的形态特征
用划线法将F33接种在5% NaCl PDA平板培养基上,菌落培养6 d后(见图3(a)、图3(b))。菌落白色至浅棕绿色,圆形,绒状。菌丝体表生,具隔,分枝,棕黄色。分生孢子梗直立或微弯曲,圆柱形,结节,膈膜,简单或分枝,棕绿色,粗糙到粘结,厚壁。产孢细胞单芽生或多芽生,棕绿色至浅棕色至无色,梭形。分生孢子浅棕绿色或半透明,卵形至短椭圆体,光滑,厚壁。
3.3. 产纤维素酶菌株F33的分子生物学鉴定
通过ITS通用引物扩增检测到长度为543 bp的DNA条带(图4),经测序获得ITS rRNA核苷酸序列,序列在线上传至GenBank (http://www.ncbi.nlm.nih.gov/genbank),GenBank登录号:ON318389,与菌株Cladosporium perangustum F05-01 (登录号:KX664325.1)同源性为99.08%。基于菌株F33 ITS序列在NCBI数据库中同源系列构建系统进化树,可知菌株F33与枝孢菌属聚在一枝,结合形态学特征,最终确定F33为Cladosporium sp. (图5)。

Figure 3. Characteristics of F33 strain colony. (a) colony front; (b) colony back; (c) F33 hyphae (40x); (d)~(e) F33 conidiophores and conidia (100×); (f)~(h) F33 Conodiogenous cells (100×); (i)~(j) F33 conidia (100×). Scale bars: C = 90 μm, D = 20 μm, E = 30 μm, F-L = 10 μm
图3. 菌株F33的表型特征和细胞形态。(a) 菌落正面;(b) 菌落反面;(c) F33菌丝(40×);(d)~(e) F33分生孢子梗及分生孢子(100×);(f)~(h) F33产孢细胞(100×);(i)~(j) F33分生孢子(100×)。标尺:C = 90 μm,D = 20 μm,E = 30 μm,F-L = 10 μm

Figure 4. Argarose gel electrophoresis of the amplification products of F33 gene. M: DNA marker; 1: The amplification products of F33
图4. F33基因扩增产物的琼脂糖凝胶检测。M:DNA marker;1:F33基因扩增产物

Figure 5. The phylogenetic tree of F33 based on ITS rRNA sequence
图5. 基于ITSrRNA序列同源性构建菌株F33的系统进化树
3.4. F33来源纤维素酶的最适碳源
通过不同碳源发酵后,菌株的产酶量也有所不同(见图6),唯一碳源为稻秆、玉米秆以及小麦的活性相对较高,其中玉米杆为菌株F33的最适碳源。

Figure 6. The optimal carbon source of strain F33
图6. 菌株F33的最适碳源
3.5. F33来源纤维素酶的最适反应温度及其稳定性影响
F33来源纤维素酶的最适反应温度为45℃ (图7(a))。F33来源粗酶液在35℃~55℃,表现出最高活性80%以上的相对活性;从0℃~45℃菌株F33的酶活力在逐步提高,在45℃时达到峰值,45℃以后酶活力开始逐渐失活。随着时间的推移,该酶表现出较高的稳定性,在40℃、45℃和50℃下孵育120 min后,分别保留约82%、73%和60%的相对活性(图7(b)),说明该酶为中温酶且在40℃~50℃表现出较高的稳定性。
 (a) (b)
(a) (b)
Figure 7. Effects of pH on the cellulase activity (a) and stability (b) of strain F33
图7. pH对菌株F33来源纤维素酶活性(a)及稳定性(b)的影响
3.6. F33来源纤维素酶的最适反应pH及其稳定性影响
F33来源纤维素酶的最适反应pH为4.0 (图8(a))。F33来源粗酶液在pH 3.6~9.6时都有一定的活性40%以上的相对活性,酸碱跨度较大;在pH 3.6~5.6时表现出最高活性75%以上的相对活性。pH对F33来源纤维素酶稳定性的影响表明粗酶液在pH 4.0~10.0孵育24 h后,表现出较高的稳定性(>75%) (图8(b))。说明该酶为嗜酸酶且pH稳定性较好。
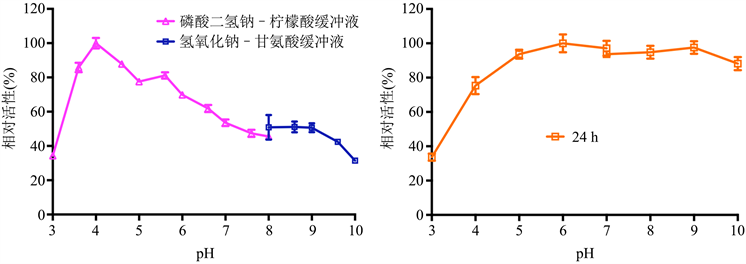 (a) (b)
(a) (b)
Figure 8. Effects of temperature on the cellulase activity (a) and stability (b) of strain F33
图8. 温度对菌株F33来源纤维素酶活性(a)及稳定性(b)的影响
3.7. 盐浓度对F33来源纤维素酶的影响
F33来源纤维素酶在0.5~3.0 mol/L NaCl条件下表现出较好的活性(图9),在当NaCl浓度为3.0 mol/L时,仍表现出50%以上的相对活性,说明该酶在盐环境有较好的耐受性,其中它的最适盐浓度为0.5 mol/L NaCl。

Figure 9. Salt activation of Cellulase F33
图9. 盐浓度对菌株F33来源纤维素酶活性的影响
3.8. 不同金属离子和化学试剂对纤维素酶的影响
在F33来源纤维素酶加入1 mM金属离子和0.1%浓度抑制剂时,相比对照组,金属离子Mn2+ (119%)对该酶有一定的促进作用;抑制剂SDS (57%)有较强的抑制作用。其余测试对粗酶液纤维素酶活性均无显著作用,活性均保持在80%以上(图10(a))。在加入10 mM金属离子和1%浓度抑制剂时,相比对照组,金属离子Mn2+ (181%)对该酶有较强的促进作用,Fe3+ (65%)、Pb2+ (73%)和Al3+ (69%)表现出显著的抑制作用;抑制剂SDS (0%)完全抑制了酶活性,DTT (118%)对其有一定的促进作用。其余测试对该纤维素酶活性无明显作用效果,酶活性范围均在86%~108% (图10(b))。

Figure 10. Effects of different metal ions and chemical agent on the cellulase activity of strain F33
图10. 不同金属离子及化学试剂对F33菌株产酶影响
3.9. 培养时间对菌株F33产酶影响
菌株F33在发酵培养基中培养24 h后,随着培养时间的增加其发酵液中纤维素酶活性不断提高,在60~156 h酶活力变化较快,156~204 h酶活力增加趋缓,204 h后酶活力又开始大幅度上升,孵育300 h时酶活力达到最高,为0.54 ± 0.03 U/mL (图11)。

Figure 11. Effects of different culture time on the cellulase production of strain F33
图11. 不同培养时间对菌株F33纤维素酶的影响
4. 讨论
近年来,国内外对于嗜盐纤维素酶产生菌的研究主要集中在细菌和放线菌上 [27] [28] [29] [30],关于真菌产嗜盐纤维素酶的报道较少,且大多局限于曲霉属Aspergillus Link [31] [32] [33] [34] [35]。研究从青海茶卡盐湖土样中筛选真菌,利用刚果红染色法和DNS法筛选出一株可降解纤维素酶且酶活力相对较高的嗜盐真菌F33,结合形态观察和ITS rRNA同源序列结果分析显示,鉴定该菌株为枝孢属(Cladosporium sp.)。通过单因素实验得到F33纤维素酶最优发酵时间为300 h,发酵温度45℃,pH 4.0,酶活力可达0.54 ± 0.03 U/mL,具有较强的产纤维素酶的能力。F33是在5%盐浓度的培养基纯化得到的菌株,其最适盐浓度为0.5 mol/L,且在3.5 mol/L高盐浓度下依旧有45%左右的相对活性,因此嗜盐真菌F33可在高盐环境下降解纤维素有着普通真菌不可比拟的优势。
目前,嗜盐菌是极具应用前景的微生物资源,其研究已成为极端环境微生物研究的重要组成部分。目前已实现利用嗜盐菌生产胡萝卜素和类胡萝卜素等食品添加剂的生产 [36],部分嗜盐真菌具有较好抗肿瘤作用,例如陈显强等人在海盐田中发现一株嗜盐真菌Epicoccum sorghinum的提取物对FGFR2过表达的乳腺癌细胞MDA-MB-231-(S252W)增殖有较强的抑制作用 [37],红树林在平衡高盐环境的渗透压作用中,嗜盐微生物也起到了关键作用 [38],嗜盐菌是极端环境微生物的重要类群,对菌株F33的挖掘,具有良好的开发和应用前景。嗜盐真菌在高盐环境中经过长时间进化,已经有了自己的嗜盐方法和适应机制,未来将会深入研究极端微生物是如何适应极端环境,阐明生物多样性形成的机制与极端环境的适应机制问题,探索生命的奥秘,同时开发其用途进一步造福于人类。
基金项目
本研究获得云南省基础研究专项——青年项目(202101AU070138)、大理苍山高海拔真菌多样性科学考察和大理大学高层次人才科研启动费支持。
NOTES
*通讯作者。