1. 引言
光热疗法(PTT)是目前可以治疗肿瘤的行之有效的办法之一。与其他治疗方法相比,光热疗法能以最小的侵略性和人体副作用诱导特定部位的肿瘤细胞坏死。近红外(NIR)区域的辐射对PTT尤其有利,因为近红外光穿透组织较深,且在此波长范围内内源性生物分子对光子的吸收较弱,细胞毒性较小 [1] [2]。
吲哚菁绿(ICG)是一种典型的近红外光热转换剂,有着良好的光热转换效率且是一种有效的光动力治疗(PDT)增敏剂,在光照下可以产生活性氧,可在肿瘤成像诊断和光热联合治疗等多个领域应用,其药理性质一直备受关注。但是其较差的水溶性,较低的细胞摄取率和快速的代谢性等缺陷限制了其临床应用。因此,为了进一步提高其生物相容性和利用率,寻求一种有效的载药方式已然成为研究热点 [3]。
但是,传统的两亲性聚肽制备过程复杂,难以精准控制。因此,可以在聚肽结构中引入大环主体化合物,通过主客体识别作用简单高效地构建超分子两亲性聚肽 [4] [5] [6]。这种超分子两亲性聚肽不仅丰富了聚肽的结构多样性,而且更易于功能化修饰,并且主客体作用的可逆性也可以赋予体系更多的可能性 [7] [8]。因此,基于主客体识别作用的超分子两亲性聚肽的构建为癌症治疗诊断体系提供了一种极具前途的理想纳米载体构建方法。
本文中,我们设计并制备了末端修饰了吡啶盐的聚半胱氨酸(PPC),其与水溶性柱[5]芳烃(WP[5])通过主客体识别作用,形成两亲性超分子聚肽。该超分子聚肽通过自组装负载ICG于内核中,形成超分子聚肽纳米药物(WPPC/ICG)。WPPC/ICG通过增强渗透与滞留(EPR)效应靶向富集在肿瘤组织部位 [9] [10],并经内吞作用进入肿瘤细胞,在肿瘤细胞内的酸性环境中,纳米药物发生pH-响应性解组装从而释放出ICG,在808 nm近红外光照射下,温度升高,杀死肿瘤细胞,不仅提高了游离ICG的光热疗效,而且减小了对正常组织的损伤。
2. 实验部分
2.1. 试验原料与仪器
ICG购自北京华威锐科化工有限公司,L-半胱氨酸购自上海笛柏化学品技术有限公司,三乙胺(TEA)购自上海阿拉丁试剂有限公司,邻硝基苄溴购自上海毕得医药科技有限公司,乙酸乙酯购自Enox,四氢呋喃(THF)购自上海凌峰化学试剂公司,三光气购自上海阿拉丁试剂有限公司,甲苯购自西陇科学股份有限公司,正己烷购自上海凌峰化学试剂公司,N,N-二甲基甲酰胺(DMF)购自上海麦克林生化科技有限公司,无水乙醚购自国药集团。核磁共振波谱仪的型号为AgilentAV-400,购于美国Agilent公司。透射电子显微镜的型号为JEM-210,购于日本电子株式会社。
2.2. 超分子聚肽纳米药物的制备及表征
2.2.1. S-邻硝基苄基-L-半胱氨酸(L-NBC-NCA)的合成
将L-半胱氨酸(1.23 g, 10.18 mmol)溶于20 mL水中,再加入1.33 mL TEA,于0℃下进行搅拌。然后向溶液中滴加30 mL 邻硝基苄溴(2 g, 9.26 mmol)的甲醇溶液,于0℃下反应0.5 h,再于室温下反应1 h,反应结束后,将反应液进行过滤,并用乙酸乙酯和水进行洗涤,得到淡黄色固体。将固体按每50 mg溶于1.8 mL水中进行重结晶,加热至沸腾后,趁热过滤,冷却结晶后再进行抽滤并用乙酸乙酯进行洗涤,得到淡黄色针状晶体。然后,在手套箱的氮气保护环境中,取(350 mg, 1.36 mmol)的淡黄色晶体溶于3 mL THF中,再向溶液中加入3 mL三光气(403.7 mg, 1.36 mmol)的甲苯溶液,于50℃下反应2 h,反应结束后将反应液沉降在4倍的无水正己烷中,静置过夜后过滤并干燥,得到淡黄色固体产物 L-NBC-NCA,产率为65.3%。
2.2.2. 吡啶-聚(S-邻硝基苄基-半胱氨酸)PPNBC的合成
PPNBC的合成:在25℃的N2保护下,将(7.5 mg, 0.025 mmol)引发剂六氟磷酸吡啶盐溶于1.0 ml的干燥DMF中,再加入(200 mg, 0.71 mmol)的L-NBC-NCA单体搅拌反应48 h。反应结束后将反应液沉降在10 mL无水乙醚中并离心,反复3次后,真空干燥得到PPNBC,产率为83.8%。1H NMR (DMSO-d6) of PPNBC:δ (ppm) = 8.51~8.65 (m, 5H, Py),8.11~7.31 (m, 88H, (Ph)22),4.47~4.82 (m, 24H, CH2Py, (COCHNH)22),4.13~3.92 (d, 44H, (CH2Ph)22),3.37~3.25 (m, 2H, CH2NH),2.75~2.62 (t, 44H, SCH2),2.23~2.17 (t, 2H, CH2),1.97~1.88 (f, 2H, CH2)。
2.2.3. 吡啶-聚半胱氨酸(PPC)的合成
PPC的合成:再取50 mg PPNBC溶解在100 mL DMF/CH3CN (v:v = 4:1)的混合溶剂中,配制成0.5 mg/mL浓度的溶液,置于UV LED灯(波长365 nm,功率150 W)下光照12 h,使聚合物中的邻硝基苄基(NB)发生光解,完全从聚合物骨架上脱落。光照结束后,将溶液浓缩至3 mL左右,再沉降于25 mL的无水乙醚中并离心,反复3次后,真空干燥得到PPC,产率为83.6%。1H NMR (DMSO-d6) of PPC:δ (ppm) = 8.31~8.13 (m, 5H, Py),3.63~3.10( m, 26H, CH2Ph, CH2CH2CH2CH2Ph, (OCCHNHCH2)22),1.07~1.02 (t, 2H, CH2)。
2.2.4. WPPC/ICG的制备
将PPC(3.5 mg, 0.002 mmol)和ICG (1.5 mg, 0.002 mmol)加入0.5 mL DMF中剧烈搅拌1~2 h后缓慢滴加15 mL WP5 (2.78 mg, 0.002 mmol)水溶液,反应48 h。结束后,将溶液置于分子量3500的透析袋中,用500 mL去离子水透析48 h,中间每8 h换一次去离子水,透析结束后,冷冻干燥后得到超分子聚肽纳米药物WPPC/ICG。
2.3. WPPC/ICG超分子聚肽纳米药物性能研究
2.3.1. 升温曲线
在96孔板中加入500 μL、含有0.25 mg/mL WPPC/ICG的纳米粒子,25 μg/mL游离的ICG的PBS溶液以及PBS溶液,用光斑大小为0.12 cm2的近红外光(808 nm, 1.0 W/cm2)垂直进行照射,同时将热电偶探针置于溶液内,每隔10 s记录一次溶液的温度。
2.3.2. 循环曲线
在96孔板中加入500 μL含有0.25 mg/mL WPPC/ICG的纳米粒子用光斑大小为0.12 cm2的近红外光(808 nm, 1.0 W/cm2)垂直进行照射,同时将热电偶探针置于溶液内,每隔10 s记录一次溶液的温度。5 min后停止光照,再每隔10 s记录一次温度,直到温度下降至不变为止。重复3次。
2.3.3. WPPC/ICG超分子聚肽纳米药物体外ICG释放
将3 mL 0.58 mg/mL的载药纳米粒子溶液置于透析袋(分子量3500)中然后分别用 20 mL PBS (pH 5.5, pH 5.5 + NIR)于35℃进行透析,每间隔一定时间更换相同体积的PBS溶液于透析袋中,测定更换的PBS溶液在390 nm处的紫外吸光度值,并根据ICG的标准曲线计算出各个时间点的ICG释放。
2.3.4. WPPC/ICG超分子聚肽纳米药物的体外细胞毒性
通过MTT法测定纳米药物对HeLa的细胞毒性。首先将细胞按照1.0 × 104的密度种入96孔板中,加入 DMEM完全培养基(200 μL),转入5% CO2、37℃的细胞培养箱中培养12 h。除去原有培养基,孔中分别加入含有WPPC/ICG,ICG的新鲜培养基,培养4 h后除去培养基,一组WPPC/ICG和ICG光照5 min (808 nm, 1.0 W/cm2)继续培养48 h,更换200 μL新鲜培养基并每孔加入25 μL含有MTT的PBS溶液(5 mg/mL),继续培养4 h;4 h后除去培养基,用PBS洗两次,再每孔加入200 μL DMSO溶液,振荡10 min左右,让蓝紫色结晶甲瓒充分溶解。结束后用酶标仪测量每孔溶液在570 nm处的吸光值(Abs)。细胞的存活率计算使用如下公式:
3. 结果与讨论
3.1. 设计原理
WPPC/ICG超分子聚肽纳米粒子的制备与表征
本文设计合成了客体聚肽——吡啶–聚半胱氨酸(PPC)。具体的反应流程如图1所示。首先,用六氟磷酸吡啶盐作为引发剂,引发L-NBC-NCA单体开环聚合得到吡啶–聚(S-邻硝基苄基-L-半胱氨酸) (PPNBC),其1H NMR谱图如图2所示。然后,通过紫外光照使聚合物中的邻硝基苄基(NB)发生光解,得到最终产物PPC。从PPC的1H NMR谱图可以看到,邻硝基苄基的特征峰已经完全消失(图3),证明PPNBC上的NB基团已经完全从聚合物骨架上脱落。
WPPC/ICG超分子聚肽纳米药物的制备流程如图4所示。将PPC和ICG溶于DMF溶剂中剧烈搅拌,同时缓慢滴加WP5的水溶液,搅拌过夜后,用去离子水透析48小时,得到WPPC/ICG超分子聚肽纳米药物的水溶液。通过动态光散射(DLS)和透射电子显微镜(TEM)对其粒径和形貌进行表征。如图5所示,WPPC/ICG超分子聚肽纳米药物的平均流体力学粒径为125.4 ± 5.8 nm,PDI为0.28 ± 0.01,形貌为球形胶束结构。这些数据进一步表明,WPPC/ICG纳米药物的形成,并且在水溶液中具有很好的分散性和稳定性。此外,我们根据紫外可见光谱,计算得出该纳米药物中ICG的载药量为12%。
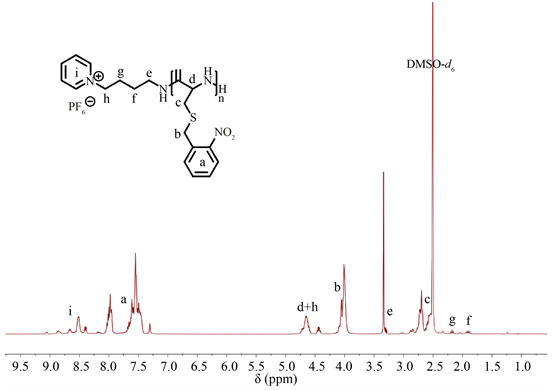
Figure 2. 1H NMR spectra of PPNBC
图2. PPNBC的1H NMR图谱
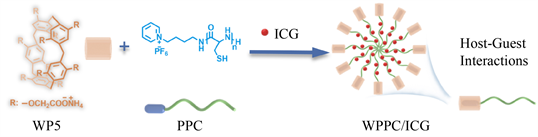
Figure 4. The composite diagram of supramolecular polypeptide nanoparticles WPPC/ICG
图4. WPPC/ICG超分子聚肽纳米粒子的合成示意图
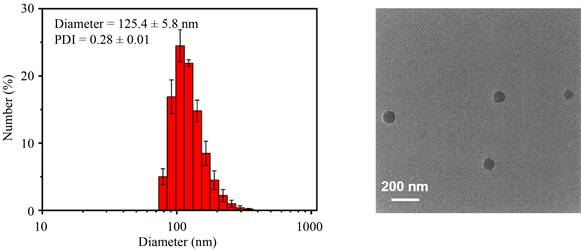 (a) (b)
(a) (b)
Figure 5. The DLS (a) and TEM (b) data of WPPC/ICG
图5. WPPC/ICG的DLS (a)和TEM (b)数据
3.2. WPPC/ICG的光热性能研究
由于ICG的近红外成像和光热转换特性,负载ICG的纳米粒子在近红外成像和光热疗方面得到了广泛的研究。如图6(a)所示,在近红外(808 nm, 1.0 W/cm2, 5 min)照射下,WPPC/ICG的PBS溶液最终升温约27.5℃,这个温度是可以致使肿瘤细胞发生不可逆的凋亡甚至坏死的,所以可以用于光热疗,并且该温度略高于游离的ICG组(24.5℃),这可能是由于纳米药物中ICG的聚集可以增强其激发热辐射,同时降低热量的耗散。此外,我们研究了WPPC/ICG纳米药物的三次升温降温循环情况,可以观察到3次最高升温情况几乎一致,表明该纳米药物WPPC/ICG具有很好的光热稳定性(图6(b))。
 (a) (b)
(a) (b)
Figure 6. (a) The temperature increase of PBS, ICG and WPPC/ICG; (b) the photostability of WPPC/ICG
图6. (a) PBS, ICG和WPPC/ICG的升温曲线;(b) WPPC/ICG的光热稳定性
3.3. WPPC/ICG复合纳米粒子的体外细胞毒性
我们进一步地通过MTT法研究了ICG和WPPC/ICG对HeLa细胞系的细胞毒性如图7所示。在没有光照时,WPPC/ICG实验组的细胞系存活率基本都高于95%,说明其没有明显的细胞毒性,具有良好的生物相容性。在NIR光照(808 nm, 1.0 W/cm2, 5 min)条件下,WPPC/ICG的细胞毒性明显高于ICG,说明通过将ICG负载于WPPC胶束内制成WPPC/ICG纳米药物后,显著提高了ICG的光热疗抗肿瘤效果。
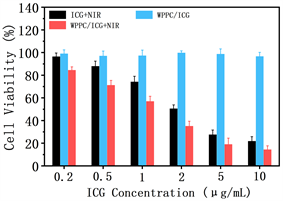
Figure 7. The cytotoxicity of ICG + NIR, WPPC/ICG, and WPPC/ICG + NIR determined by MTT
图7. MTT法测定的ICG + NIR、WPPC/ICG和WPPC/ICG + NIR的细胞毒性
4. 结论
本文构建了一种基于主客体识别作用的超分子聚肽纳米药物WPPC/ICG,WP[5]和PPC通过主客体识别作用形成两亲性超分子聚肽,并将ICG负载在纳米粒子中,形成纳米药物WPPC/ICG,增强了ICG在近红外光照射下的升温效果,并显著提高了ICG的光热疗效果。本实验可以进一步将DOX包入其中,起到联合抗肿瘤效果。因此,该纳米载药体系的构建为生物医药领域提供了有力的实验基础。同时,在肿瘤治疗、医药领域、生化分析等方面存在潜在的应用前景。
参考文献
NOTES
*通讯作者。