1. 引言
糖尿病(diabetes mellitus, DM)是一种呈现高血糖状态的代谢紊乱疾病,是当今世界发病率最高的慢性病之一,糖尿病微血管病变是糖尿病最常见的并发症,也是糖尿病致死致残的主要原因 [1]。血管内皮依耐性舒张(endothelium-dependent relaxation, EDR)是血管舒张功能的重要组成,对血管内的血液灌注有着直接影响。生物钟是体内的时间测量装置,对觉醒以及体内代谢有着广泛调控,脑和肌肉芳香烃受体核转运样蛋白1 (brain and muscle arnt-like 1, Bmal1)是最具代表性的生物钟基因 [2]。过氧化物酶体增生物激活受体δ (peroxisome proliferators-activated receptor δ, PPARδ)是哺乳动物细胞内的一种核受体,影响多种蛋白的转录,研究发现PPARδ可通过影响二氢叶酸还原酶(dihydrofolate reductase, DHFR)的表达来影响内皮型一氧化氮合成酶(endothelial nitric oxide synthases, eNOS)的解偶联,对血管的EDR产生影响 [3]。近年来有研究报道Bmal1基因敲除小鼠体内PPARδ的表达降低 [4]。
糖尿病微血管病变常累积心脏、脑、视网膜、肾脏等各处器官,对糖尿病患者的生存质量带来很大影响,而生物钟紊乱也是心脑血管疾病的重要危险因素,通过对Bmal1的研究,可进一步探讨生物钟系统对微血管系统的影响 [5] [6]。由于微血管位置深直径小,难以取材,目前尚无完美的动物模型,国内外实验中常用小鼠的肠系膜动脉二级分支作为微血管的研究载体 [7] [8]。本实验选用了Bmal1全基因敲除的小鼠为研究对象,进行糖尿病造模,探究生物种基因Bmal1敲除对糖尿病微血管EDR的影响。在前期的实验中,我们发现了Bmal1敲除可以影响糖尿病微血管EDR,结合之前的研究,提出实验假设:Bmal1可以通过调控PPARδ的表达,来影响PPARδ通路下游DHFR、eNOS的表达,增加eNOS的解偶联,来影响EDR。通过提取糖尿病微血管内皮细胞,再用Western blot的方法检测蛋白表达量,对假设进行验证。
2. 材料和方法
2.1. 实验动物
实验所用的雄性Bmal1全基因敲除小鼠(Bmal1−/−)和同批次野生型小鼠(WT)购自北京唯尚立德生物科技公司。饲养环境:温度20℃~25℃,普通饲料,自由摄食饮水,12 h/12h昼夜明暗交替。实验通过青岛市市立医院伦理委员会审批。
2.2. 试剂与仪器
血管张力仪DMT620M (丹麦DMT);血糖仪(瑞士罗氏);体视显微镜(南京江南);链脲佐菌素STZ、柠檬酸钠、胶原酶I (美国Sigma);CD31、ICAM2抗体(美国BD);磁珠二抗(美国Thermo Fisher);Bmal1、PPARδ、DHFR、eNOS、GAPDH抗体(英国Abcam);羊抗兔二抗、RIPA裂解液、BCA蛋白定量试剂盒(北京索莱宝)、ECL发光试剂盒(南京诺唯赞)。
Krebs液配方(mmol/l):氯化钠120,氯化钾5,硫酸镁1.2,磷酸二氢钾1.2,碳酸氢钠3.25,葡萄糖11.1,氯化钙2.5。(中国国药)
2.3. 糖尿病造模
选取8周龄Bmal1−/−小鼠和WT小鼠,采用低剂量链脲佐菌素(STZ,50 mg/kg,溶于柠檬酸钠缓冲液)连续腹腔注射5天,对照组同时注射5天柠檬酸钠缓冲液 [9]。2周后检测血糖含量,以随机血糖 > 16.7 mM为糖尿病成模标准(DM) [9] [10]。
2.4. 实验分组及取材
在糖尿病造模成功后,选取糖尿病状态(DM)的Bmal1−/−小鼠和WT小鼠各5只,只注射缓冲液的非糖尿病(Ctr)的Bmal1−/−小鼠和WT小鼠各5只,共分为4组:糖尿病的Bmal1−/−组(Bmal1−/− + DM),非糖尿病的Bmal1−/−组(Bmal1−/− + Ctr),糖尿病的WT组(WT + DM),非糖尿病的WT组(WT + Ctr),n = 5。
注射STZ后18周时,在戊巴比妥钠(50 mg/kg)腹腔注射麻醉后解剖,分离肠系膜二级动脉用于EDR检测和内皮细胞提取。
2.5. 内皮依耐性舒张功能(EDR)检测
取小鼠肠系膜动脉2 mm,安装于张力测量仪,并给每个容器加入5 ml Krebs溶液,给予95%氧气和5%二氧化碳混合气体通入,37℃平衡60分钟,将仪器标准化,用60 mM氯化钾收缩血管环并用Krebs溶液冲洗,再用苯肾上腺素(PE, 1 μM)产生稳定的收缩,并累积添加乙酰胆碱(ACh,10−9 M至10−5 M)以诱导内皮依赖性舒张 [3]。(1 M = 1 mol/L)
2.6. 内皮细胞提取
先用磁珠包被CD31抗体和CAM2抗体,将小鼠的肠系膜动脉剪碎,用胶原酶I消化,20G的针头吹打分离细胞团块。将细胞悬浮液与磁珠包被的CD31抗体混合孵育,置于磁力架上对内皮细胞进行分离。同样方法再用磁珠包被的ICAM2抗体二次分离,就得到较纯的内皮细胞 [11]。
2.7. Western Blot检测Bmal1蛋白的表达水平
用RIPA裂解液提取内皮细胞的蛋白,BCA法测定蛋白浓度。用PAGE凝胶试剂盒制胶,每孔30 μg蛋白样品,经电泳、转膜、封闭后,加入Bmal1 (1:1000)、PPARδ (1:3000)、DHFR (1:5000)、eNOS (1:5000)、GAPDH (1:5000),4℃摇床孵育过夜。次日TBST洗膜,加入羊抗兔二抗(1:5000)孵育后,经化学发光显影,用Image J计算灰度值,分析蛋白的相对表达水平。
2.8. 统计学处理
应用SPSS 26.0软件进行统计学分析,计量资料数据用
表示。血糖和蛋白表达结果中多组数据比较采用单因素方差分析(One-way ANOVA),两组之间比较用Tukey法。内皮依耐性舒张功能(EDR)的多组数据比较采用双因素重复测量方差分析(Two-way Repeated-Measures ANOVA),双因素为分组和ACh浓度,两组之间比较用Bonferroni法分析 [3]。以P < 0.05为差异有统计学意义。
3. 结果
3.1. 各组小鼠的一般情况
在糖尿病造模前,Bmal1基因敲除(Bmal1−/−)的小鼠和同批次野生型(WT)小鼠相比,血糖无明显差异(P > 0.05),Bmal1−/−组的毛色也稍暗淡。在开始造模以后,可见注射STZ的小鼠出现饮水、排尿、进食量增加的症状,体重增长缓慢,毛色明显暗淡,活动量减少,垫料味道较大,而只注射柠檬酸钠缓冲液的小鼠未出现此类症状。在注射STZ的小鼠中,8只Bmal1−/−小鼠全部成模(Bmal1−/− + DM,随机血糖 > 16.7 mmol/L),10只WT小鼠成模9只(WT + DM,随机血糖 > 16.7 mmol/L),1只造模失败(血糖不达标,不用于后续实验)。在只注射柠檬酸钠缓冲液的小鼠中,8只Bmal1−/−小鼠和10只WT小鼠随机血糖与注射前无明显上升(Bmal1−/− + Ctr,WT + Ctr,随机血糖 < 16.7 mmol/L)。造模过程中小鼠均未出现意外死亡。由于Bmal1−/−小鼠的繁育困难,所以用于前期糖尿病造模的Bmal1−/−小鼠稍少于WT小鼠,在造模后为了平衡各组入组数量,选出部分小鼠进行此次实验,剩余小鼠用于其他相关研究。
选出糖尿病的Bmal1−/−小鼠(Bmal1−/− + DM)、糖尿病的WT小鼠(WT + DM)、非糖尿病的Bmal1−/−小鼠(Bmal1−/− + Ctr)、非糖尿病的WT小鼠(WT + Ctr)各5只,构成4个实验分组(n = 5),进行此次试验。
为了确认糖尿病造模效果,并尽可能减少误差,在糖尿病造模第4、5、6周时测三次随机血糖,对三次血糖进行合并分析,四组小鼠之间血糖的差异有统计学意义(F = 1997.00, P < 0.01),Bmal1−/− + DM组血糖(26.36 ± 1.00)高于Bmal1−/− + Ctr组(9.57 ± 0.79, P < 0.01),WT + DM组血糖(27.05 ± 0.94)高于WT + Ctr组(9.81 ± 0.63, P < 0.01),且Bmal1−/− + DM组和WT + DM组随机血糖都大于16.7 mmol/L,证明入组的小鼠是符合实验要求的(表1)。

Table 1. Comparison of three random blood sugars of mice in each group (n = 5, mmol/L,
)
表1. 各组小鼠三次随机血糖的比较(n = 5, mmol/L,
)
注:四组比较,F = 1997.00,P < 0.01。与Bmal1−/− + Ctr组相比,* q = 76.33,P < 0.01;与WT + Ctr组相比,# q=78.39,P < 0.01。
3.2. 各组血管的内皮依赖性舒张功能(EDR)比较
血管环被肾上腺素(PE)诱导收缩时,张力达到峰值(PE峰),再用不同浓度的ACh诱导出内皮依赖性舒张(EDR),每个ACh浓度对应一个舒张度,和PE峰形成百分比关系(%PE峰),作为评价EDR的指标。
各组血管在梯度浓度ACh诱导的舒张资料:见表2。使用双因素重复测量方差分析,数据不符合球形检验假设(P < 0.05),选用Greenhouse-Geisser法校正,结果显示分组差异、ACh浓度差异以及交互作用都有统计学意义(P < 0.05),见表3。对分组因素进行多重比较,WT + DM组的EDR是差于WT + Ctr组的(P < 0.05),但好于Bmal1−/− + DM组(P < 0.01),见表4和图1。

Table 2. Comparison of the relaxation of vascular in each group in the gradient concentration ACh (n = 5, %PE峰,
)
表2. 各组血管在梯度浓度ACh环境下的舒张情况对比(n = 5,%PE峰,
)
注:与WT + DM组比较,* P < 0.05。

Table 3. Repeated-measures variance analysis of the four groups vascular relaxation in the gradient concentration ACh
表3. 各组血管在梯度浓度ACh环境下舒张情况的重复测量方差分析
注:Mauchly’s球性检验,P < 0.05,选用Greenhouse-Geisser法校正。

Table 4. Multiple comparisons of grouping factors for vasodilation (partial data)
表4. 血管舒张情况的分组因素的多重比较(部分数据)
3.3. 各组小鼠肠系膜动脉内皮细胞中Bmal1及PPARδ通路蛋白的表达情况。
通过磁珠分选的方法提取小鼠肠系膜动脉内皮细胞,检测各组内皮细胞中Bmal1及PPARδ通路蛋白(PPARδ, DHFR, eNOS)的表达,其中eNOS有二聚体(dimer)和单体(monomer)两种状态,二者比值增加代表eNOS偶联增加,比值减小代表eNOS解偶联增加。
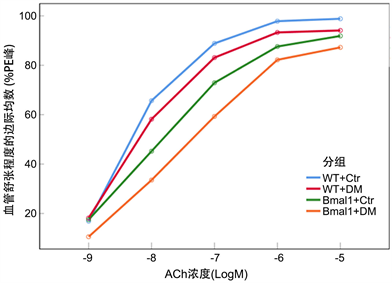
Figure 1. Interaction profile plot of grouping factor and ACh concentration factor
图1. 分组因素和ACh浓度因素的交互轮廓图
Bmal1−/− + Ctr组和WT + Ctr组对比,Bmal1−/− + DM组和WT + DM组对比,Bmal1、PPARδ、DHFR的表达都是减少的(P < 0.01),eNOS的解偶联是增加的。Bmal1−/− + DM组和Bmal1−/− + Ctr组对比,Bmal1的表达量极低,且差异无统计学意义(P > 0.05),而PPARδ、DHFR的表达量是减少的,差异有统计学意义(P < 0.01),如图2和表5
 (A: WT + Ctr, B: WT + DM, C: Bmal1−/− + Ctr, D: Bmal1−/− + DM)
(A: WT + Ctr, B: WT + DM, C: Bmal1−/− + Ctr, D: Bmal1−/− + DM)
Figure 2. Expression of Bmal1 and PPARδ pathway proteins in mesenteric artery endothelial cells in each group
图2. 各组肠系膜动脉内皮细胞中Bmal1及PPARδ通路蛋白的表达情况

Table 5. Comparison of expression levels of Bmal1, PPARδ, DHFR and eNOS uncoupling in mesenteric artery endothelial cells in each group (n = 5,
)
表5. 各组肠系膜动脉内皮细胞中Bmal1、PPARδ、DHFR表达水平及eNOS解偶联情况对比(n = 5,
)
注:各指标组间比较,F = 24.34~746.45,P < 0.01。与WT + Ctr组相比,* P < 0.01;与WT + DM组相比,# P < 0.01;与Bmal1−/− + Ctr组相比,& P < 0.01。
4. 讨论
微血管是体内大中血管的分支,广泛分布于全身的组织器官,是血液循环的重要结构基础,糖尿病(DM)是微血管损伤最常见原因之一,对肾脏、心脏、神经、视网膜等重要器官的结构和功能造成破坏,对患者的生存质量带来很大影响。长期的高糖环境下,微血管内可出现糖基化亢进、活性氧(ROS)和自由基增加、糖基化终产物(AGEs)堆积、蛋白激酶C(PKC)途径激活等多重反应,破坏微血管的结构,影响微血管的收缩和舒张功能 [12]。内皮细胞是覆盖在血管内壁的单层鳞状细胞,受高血糖的影响也最为直接,内皮功能障碍被认为是糖尿病微血管损伤的主要特征,表现为内皮的一氧化氮(NO)合成减少,ROS的生成增加,血管内皮依赖性舒张功能(EDR)是内皮功能障碍的常用检测指标 [3]。
生物钟是24小时的周期性行为及生理波动,由下丘脑视交叉上核(suprachiasmatic nucleus, SCN)的中枢性主时钟控制,在外周的组织中还存在外周生物钟,有一定自主性,但也受中枢时钟的调控 [13]。转录因子Bmal1是最为重要的时钟蛋白,它通过和Clock蛋白构成异源二聚体,结合在基因启动子上游的E-box位点,调控下游时钟基因的表达,推动生物钟的运转 [14]。经过遗传学分析,Bmal1与高血压和糖尿病的易感性有关,在动物实验和临床实践中,也发现了Bmal1和糖尿病、高血压、缺血性心肌病等慢性疾病存在联系 [15]。
在本实验中,我们发现WT + DM组的EDR是差于WT + Ctr组的(P < 0.05),但好于Bmal1−/− + DM组(P < 0.05),这说明糖尿病造模引起了小鼠肠系膜动脉的EDR损伤,Bmal1基因的缺失加重了糖尿病小鼠的肠系膜动脉EDR损伤。通过对Bmal1及PPARδ通路蛋白的表达量进行检测,我们发现在Bmal1敲除的小鼠肠系膜动脉内皮细胞中,Bmal1、PPARδ、DHFR的表达都是减少的(P < 0.01),eNOS的解偶联是增加的,这说明Bmal1的敲除可通过影响减少PPARδ的表达,进而减低下游DHFR的表达,促进eNOS的解偶联,影响内皮NO的合成来使EDR功能受损。另外,Bmal1−/− + DM组和Bmal1−/− + Ctr组对比,Bmal1的表达量趋近于零,且差异无统计学意义(P > 0.05),而PPARδ、DHFR的表达量是减少的,差异有统计学意义(P < 0.01),这也说明Bmal1虽然可以调控PPARδ的表达,但并非不可或缺,同时DM对PPARδ的合成也有一定的调控作用。
5. 总结
综上所述,糖尿病可引起微血管的EDR受损,Bmal1的敲除可加重糖尿病微血管的EDR损伤,PPARδ介导了Bmal1对EDR的影响。本次研究是首次对生物钟家族蛋白和糖尿病微血管损伤之间的关系进行功能学探索,并首次提出Bmal1可通过PPARδ来影响EDR,为生物钟在血管领域的研究提供了新的方法和思路。但Bmal1基因的靶点众多,可能涉及到多种机制的共同调节,仍需要进一步的探讨 [16]。
基金项目
青岛市科技惠民示范引导专项(21-1-4-rkjk-9-nsh);青岛市医疗卫生优秀学科带头人计划(青卫科教字[2019] 9号)。
NOTES
*第一作者。
#通讯作者。