1. 引言
历城草莓是山东省济南市十大农业特色产业之一,济南市的草莓种植面积主要分布在历城区,从上个世纪八十年代开始规模化种植,发展到近几年,历城草莓种植面积超过了2.5万亩,年产量近百万吨。2022年1月8日,又迎来了一个历史性的时刻——“泉水草莓”作为历城草莓的区域公用品牌正式发布了。历城草莓因其“早、鲜、香、美、甜”的特点而深受企业和消费者的认可,呈现出规模化、专业化、集约化的发展趋势。
历城草莓主要采用一年一栽的栽培模式,即春夏育苗,秋冬进行设施条件下的促成栽培生产草莓果实。有的采摘园区拥有吊挂草莓种植模式或者各种类型支架的(单层或多层)立体基质栽培模式;但大多数种植户仍采用设施下的土壤栽培模式,土壤栽培是草莓最传统的最基础的栽培方式。
由于草莓种植效益可观以及当初的棚体设计适宜草莓生长,导致草莓在同一地块的连年种植,从而难免土壤环境变差、草莓病虫害逐年加重和产量品质下降,出现连作障碍 [1] [2]。维持土壤健康对草莓产业的可持续性发展至关重要。土壤的物理、化学以及生物学的指标等方面指示着土壤健康与否,其中土壤微生物多样性和丰度已成为衡量土壤质量高低的重要生物学指标 [3] [4]。
真菌构成了土壤的大部分微生物生物量,具有分解有机质,为草莓植株提供养分的功能,是土壤生态系统是否健康的指示物。另外草莓的大部分病害也是由真菌侵染引起的 [5],因此,我们首先对土壤真菌组成进行揭示。由于大部分土壤微生物仍然不能被培养,利用传统的分离培养方法具有一定局限性,而高通量测序技术能较全面揭示土壤微生物多样性和丰度。
程刚等 [6] 调查分析了历城草莓种植地的土壤养分状况,据此提出改良和施肥对策。但还未见关于历城草莓土壤微生物群落、多样性方面的研究报道。我们通过研究历城草莓土壤真菌多样性,揭示其群落结构和组成,以期为草莓园区和种植户的土壤质量管理、病虫害的生物防治以及菌肥的开发利用提供基础数据和技术支撑。
2. 材料与方法
2.1. 研究区概况
山东省济南市历城区,多年平均气温14.3℃,多年平均降水量665.7毫米。地理位置在北纬36度19分51秒~36度53分45秒,东经116度55分24秒~117度22分15秒(https://baike.so.com/doc/6066802-6279866.html)。
2.2. 样品采集
2021年7月,先后在历城区刑家洼村、老僧口北村、西八户村草莓种植户,每村选取2个采样点,每个样品是五点取样后混匀,共6个土壤样品,依次取名代号:T1、T2、T3、T4、T5和T6。实验材料委托北京擎科生物科技有限公司(Tsingke Biotechnology Co., Ltd.)进行高通量测序。
2.3. 建库测序
提取样品总DNA后,根据保守区设计得到引物,在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina Novaseq 6000进行测序。利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对Reads拼接过滤,聚类或去噪,并进行物种注释及丰度分析,可以揭示样品的物种构成。
2.4. 数据预处理
主要有如下3个步骤:1) 质量过滤:首先对测序得到的Raw Reads进行过滤;然后进行引物序列的识别与去除,得到不包含引物序列的Clean Reads;2) 双端序列拼接:通过overlap对每个样品的Clean Reads进行拼接,然后根据不同区域的长度范围对拼接后数据进行长度过滤;3) 去除嵌合体:鉴定并去除嵌合体序列,得到最终有效数据(Effective Reads)。
2.5. OTU划分及多样性分析
使用Usearch软件对Reads在97.0%的相似度水平下进行聚类、获得OUT (Operational Taxonomic Units)即分类操作单元,每个OTU对应于一种代表序列 [7]。通过Alpha多样性分析研究单个样品内部的物种多样性,统计了各样品的Ace、Chao1、Shannon指数,绘制样品稀释曲线。
2.6. 物种注释及分类学分析
以UNITE为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释,可得到每个特征对应的物种分类信息,进而在各水平(Phylum, Class, Order, Family, Genus, Species)统计各样品群落组成,利用QIIME软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。
3. 结果与分析
3.1. 测序序列处理及优化分析
经Hi Seq测序,共得到6个样品序列数据,总原始reads数479,956,高质量reads数477,839,有效序列数为468,423,每个样品的具体情况如表1所示,可见测序数据的数量和质量都比较高。
Sample ID为样品名称;Raw Reads为测序得到的原始reads数;Clean Reads为原始序列质控后得到的高质量reads数;Effective Reads为Clean Reads通过拼接(双端)、过滤长度和嵌合体后的有效序列数;AvgLen (bp)为样品平均序列长度;GC (%)为样品GC含量,即G和C类型的碱基占总碱基的百分比;Q20 (%)为质量值大于等于20的碱基占总碱基数的百分比;Q30 (%)为质量值大于等于30的碱基占总碱基数的百分比;Effective (%)为Effective Reads占Raw Reads的百分比。
使用Usearch软件对Reads在97.0%的相似度水平下进行聚类、获得OUT (即分类操作单元Operational Taxonomic Units)。图1显示了通过聚类得到各样品OTU的个数:柱子上面的数字即为相应样品的OTU数目。T1至T6依次为854、938、767、629、580和582,总OTU个数为1359。

Table 1. Statistics of data processing results of sample sequencing
表1. 样品测序数据处理结果统计
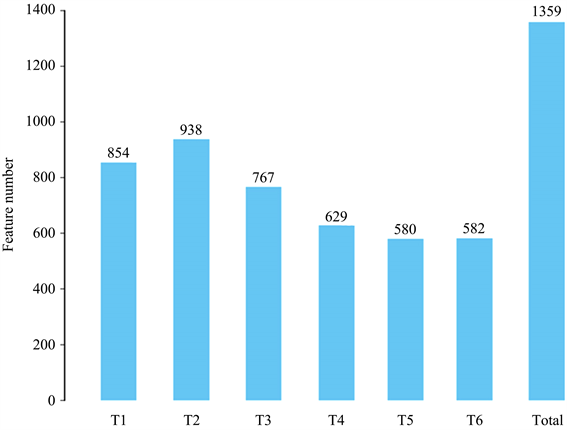
Figure 1. Distribution diagram of the characteristic number (OTU number) of each sample
图1. 各样品特征个数(OTU数)分布图
样品稀释曲线如图2所示,可见曲线基本平缓,表明测序深度足够大,得到的数据量已能够全面反应各样品内的物种及分类信息。
3.2. 土壤真菌群落丰富度和多样性分析
ACE指数和Chao1指数反映群落物种丰富度,它们的数值大小排序几乎与各样品的OTU个数一致,如表2,样品T1和T2 OTU个数最多,ACE指数和Chao1指数最大,真菌丰富度最高;样品T5和T6 OTU个数最少,ACE指数和Chao1指数最小,真菌丰富度最低,但是T5和T6的Shannon指数较大,说明它们的真菌多样性最高。
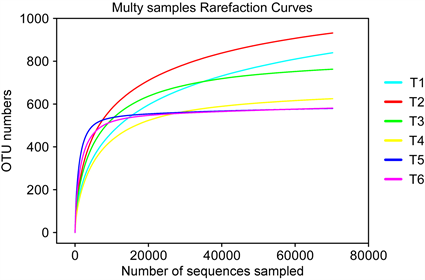
Figure 2. Dilution curves of the samples
图2. 样品的稀释曲线

Table 2. Analysis of community richness and diversity in soil fungal
表2. 土壤真菌群落丰富度和多样性分析
如图3,6个样品共有的OTU个数200个,每个样品特有的OTU个数依次为 55、82、27、34、55和50个。可见这些样品大部分群落物种相同,但是同时都有各自特异的特征(OTU)。花瓣图是Venn图的另一种表现形式,只展示各样品中都存在的共有特征和只存在于各样品中的特有特征。
3.3. 土壤真菌分类学组成分析
3.3.1. 土壤真菌门水平分析
6个土样真菌门类群中,如图4显示,子囊菌门(Ascomycota)为第一优势门,其次为担子菌门(Basidiomycota)。其它为被孢霉门(Mortierellomycota)、捕虫霉门(Zoopagomycota)、壶菌门(Chytridiomycota)、罗兹菌门(Rozellomycota)、球囊菌门(Glomeromycota)、油壶菌门(Olpidiomycota)、梳霉门(Kickxellomycota)、芽枝霉门(Blastocladiomycota)、毛霉门(Mucoromycota),共涉及11个门。
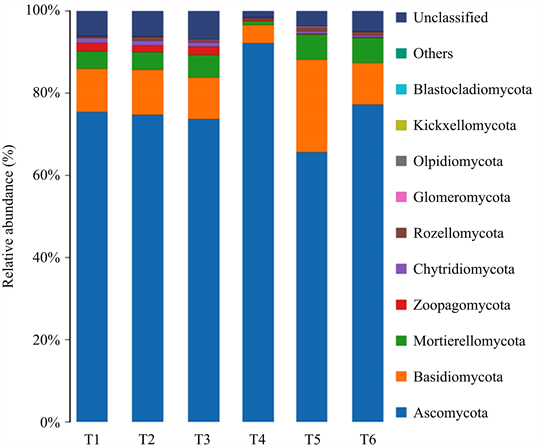
Figure 4. Distribution histogram of species at the phylum level
图4. 物种门水平分布柱状图
3.3.2. 土壤真菌纲水平分析
土样真菌纲水平占比排在前面的主要有:粪壳菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)、座囊菌纲(Dothideomycetes)、锤舌菌纲(Leotiomycetes)、伞菌纲(Agaricomycetes)、被孢霉纲(Mortierellomycetes)、盘菌纲(Pezizomycetes)、银耳纲(Tremellomycetes)等,组成土壤真菌群落的优势真菌纲,粪壳菌纲为所有样品中的第一优势菌纲。
3.3.3. 土壤真菌属水平分析
土样真菌属水平占比排在前面的主要有:曲霉属(Aspergillus)、篮状菌属(Talaromyces)、镰刀菌属(Fusarium)、白粉菌属(Erysiphe)、被孢霉属(Mortierella)、短梗蠕孢属(Trichocladium)、毛壳菌属(Chaetomium)、头梗霉属(Cephaliophora)、癣囊腔菌属(Plectosphaerella)、毛葡孢属(Botryotrichum)等。
3.4. 真菌表型预测
3.4.1. 真菌营养型解析
FUNGuild (Fungi Functional Guild)是一种可用于分类学解析真菌的工具。按照营养方式将真菌分为三大类:病理营养型(Pathotroph)、腐生营养型(Saprotroph)和共生营养型(Symbiotroph)。如图5所示,病理营养型优势纲有:锤舌菌纲(Leotiomycetes)、散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)。腐生营养型优势纲有:粪壳菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)、盘菌纲(Pezizomycetes)、座囊菌纲(Dothideomycetes)。共生营养型优势纲:伞菌纲(Agaricomycetes)占比很高,是第一大纲;其它有球囊菌纲(Glomeromycetes)、散囊菌纲(Eurotiomycetes)、类球囊菌纲(Paraglomeromycetes)等。以上是相对于一般作物的营养类型的解析。
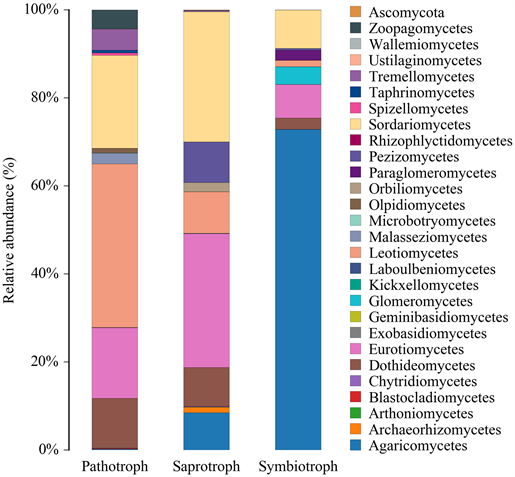
Figure 5. FUNguild distribution histogram of the species at the class level
图5. FUNguild物种在纲水平的分布柱状图
3.4.2. 草莓潜在病原真菌
相对频率较高且包含可侵染草莓的病原菌的真菌属有:镰刀菌属(Fusarium)的根腐病原 [5]、链格孢属(Alternaria)的根腐病 [8] 和草莓黑斑病病原 [5]、炭疽菌属(Colletotrichum)的炭疽病原 [5]、土赤壳属(Ilyonectria)的根腐病原 [9] 等。所有土壤样品均没有检测到:葡萄孢属(Botrytis)、轮枝菌属(Verticillium)、丝核菌属(Rhizoctonia)、腐霉属(Pythium)、疫霉属(Phytophthora)、拟盘多毛孢属(Pestalotiopsis)等草莓致病真菌。
3.4.3. 土壤潜在有益菌
相对频率较高的有益菌有:篮状菌属(Talaromyces)、毛壳菌属(Chaetomium) [10]、丝孢酵母(Trichosporon)、拟青霉属(Paecilomyces)、木霉属(Trichoderma)等。大部分的篮状菌是分布在土壤和植物中的,能被用来拮抗病原菌、降解木质纤维素、生产天然着色剂等,是生物防治的有力后备军。毛壳菌与植物病原菌在生长过程中有拮抗作用,而且能够诱导植物某些组织抗氧化能力的提高,从而增强植物的抗病能力。木霉菌是开发利用比较成熟的生防真菌。
4. 讨论
历城草莓土壤微生物多样性研究报道较少,土壤真菌的多样性和丰富度对维持土壤及草莓健康至关重要,因此,我们采用Illumina高通量测序技术对其进行分析和研究。高通量测序技术克服了微生物培养的局限性,使得不可培养微生物的研究可以进行,尤其是一些低丰度的重要功能微生物,能够全面、精准、高效地读取土壤微生物群落的遗传信息,是研究土壤微生物多样性的有效方法。但此法也有缺陷,就是不能完全鉴定到种,不能得到具体的菌种(病原菌或者有益菌)用于进一步深入地研究和开发。
而早期研究多采用微生物平板分离培养法,统计土壤微生物数量以及鉴定微生物种类,因土壤微生物特殊的生存环境,大部分微生物不可人工培养得到,因此这一方法不能充分反映其多样性特征。已有的研究已经了一定的研究成果:连作土壤由“细菌型”向“真菌型”转变、微生物群落结构失衡、病原菌大量积累,以及有益菌属数量减少等造成连作障碍 [11] [12]。同时,利用这种方法可以获得有应用价值的微生物种类,积累微生物种质资源。
通过此研究,我们获得了历城草莓土壤真菌的基础数据,有效序列数为468,423条,总OTU个数为1359。其中子囊菌门(Ascomycota )占比最高为第一优势门,其次为担子菌门(Basidiomycota)。粪壳菌纲(Sordariomycetes)是第一大纲。同时,检测到草莓潜在病原真菌属和潜在有益菌属。土壤是微生物生活的大本营,是开发有重要应用潜力的生防菌种的主要源泉。
土壤是一个复杂的、多元的、动态的有机整体,在微生物群落结构及物种丰度和多样性方面均存在差异,也就是说在地球上找不出2个完全一样的地块,这就需要扩大检测点,尽量涵盖各种土壤特性,还需加强月度和年度的动态检测,任重道远。个性化分析积累到一定数量则有可能总结提炼出一般性科学规律。杨美悦 [13]、陈爱萍 [14]、LI Wei-hua [15]、赵帆 [16]、肖蓉 [17] 等的研究结果显示,草莓经不同连作年限后,镰刀菌属(尖孢镰刀菌)等病原真菌在土壤中的丰度显著增加。
开展连作导致草莓土传病害的研究,同时开展处理、改良草莓连作土壤的相关研究,从正反两个方向解析相关因子与连作病害的关系,探讨土传病害和土壤真菌多样性之间的内在联系。化学药剂熏蒸处理土壤,可有效消除土传病害对草莓的影响 [13] [18] [19] [20],但是对环境不友好。利用太阳能和微生物菌剂、添加有机质以及套作和秸秆还田等处理也能达到目的 [21] [22] [23] [24],这些天然的、生物的、环境友好的方法值得推广。
高通量测序一般检测到属,而对草莓病原菌的研究需要精准到种,种特异的检测方法或者特异引物设计开发就显得尤为重要。摸清病原菌从土壤、根际到侵入植物体内每个环节以及最终发病的条件因子。囊括了80%以上的植物真菌性病害的防治极具挑战性,不注重前期的预防工作,病害发生时才开始用药,有些病此时已无法挽回,造成死棵断垄。所以“工作前置”很必要,而且解决问题的方法也就不仅限于化学药品。
5. 结论
利用高通量测序技术,揭示了历城草莓土壤真菌多样性及其群落结构和组成,获得了从门到种各水平的基础数据。检测到的潜在病原和有益真菌为进一步的研究奠定基础。土壤微生物多样性及构成是维持土壤生态功能的基础,也是决定土壤健康的重要因素,健康的土壤加上健康的草莓苗才能结出健康的果实,草莓产业才能健康发展;本研究的意义在于为农业绿色可持续发展研究提供参考。
基金项目
山东省农业科学院农业科技创新工程项目(CXGC2021A28、CXGC2022E08)资助。
NOTES
*通讯作者。