摘要: 在当前阶段,磷酸铁锂材料对新能源电池的重要性显而易见,其成本低、性能稳定、有较好的循环使用性且可控性高,使其成为锂电池正极材料的首选。而磷酸铁是合成磷酸铁锂的重要原料,磷酸铁锂的制备离不开磷酸铁这一前驱体,因此,去除磷酸铁中杂质的工作显得必不可少,本文就提出了一种除去磷酸铁中硫酸钠的方法,该工艺利用磷酸铁和硫酸钠溶解性的差异实现分离,整个过程清洁环保,操作简单,效率较高,且最终得到的磷酸铁有较好的铁磷比。
Abstract:
At this stage, the importance of lithium iron phosphate material to new energy battery is obvious. It’s the preferred option to be positive an electrode for lithium batteries for its low cost, stable performance, good recyclability and high controllability. Iron phosphate is the core raw material for the synthesis of lithium iron phosphate, the preparation of lithium iron phosphate is inseparable from the precursor of iron phosphate. Therefore, it is essential to remove impurities in the iron phosphate. A method for removing sodium sulfate from iron phosphate is proposed in this paper, the difference of solubility between ferric phosphate and sodium sulfate is proposed to achieve separation. The whole process is clean, environmentally friendly, with simple operation and high efficiency, and the finally obtained iron phosphate has a better iron to phosphorus ratio.
1. 引言
自上世纪90年代日本、美国分别发表了LiMPO4的橄榄石结构后 [1],磷酸铁锂这一新材料开始走进大众的视野,在引起广泛关注的同时也得到迅速发展,与传统锂离子电池正极材料不同,磷酸铁锂材料由于其独特的结构存在巨大的天然优势。直至现在,磷酸铁锂电池都凭借其低廉的成本、较高的安全性、良好的循环性和稳定的性能,成为锂电池正极材料的不二之选,也被誉为最具潜力的正极材料,是电动车汽车动力锂离子电池的理想正极材料,预计在储能领域也拥有巨大的潜力 [2] [3] [4] [5]。制作磷酸铁锂的工艺有很多,但是以磷酸铁工艺最为合理 [3] [6] [7] [8]。磷酸铁工艺是以磷酸铁为前驱体,同碳源、锂源均匀混合,碳热还原制得磷酸铁锂正极材料。其中磷酸铁为主要原料,因此对磷酸铁的研究将对磷酸铁锂电池的发展有重要意义,国内就有人发表过在磷化渣中使用合适的分离手段得到磷酸铁的工艺,而本文则提出一种除去磷酸铁中硫酸钠盐的方法,其方法是根据磷酸铁和硫酸钠在水中的溶解性不同,在合适的温度下用水洗将硫酸钠溶于水中,从而实现去除目的,该方法操作简单但效率高,能达到较高的去除效果。
2. 实验原理
2.1. 磷酸铁
磷酸铁又称磷酸高铁、正磷酸铁,分子式为FePO4,其天然状态下以蓝铁矿的形式存在,常见的磷酸铁一般为带两个结晶水的水合物FePO4∙2H2O,颜色为白色或者浅黄色,随着结晶水的褪去,其颜色将慢慢变黄。其形态为粉末状,在加热时易溶于盐酸但不溶于其他酸,同时磷酸铁不溶于水和醇类溶剂。
2.2. 硫酸钠
硫酸钠分子式为Na2SO4,极易吸水,与水生成的Na2SO4∙10H2O又称芒硝。其形态为结晶或粉末,颜色为白色,不溶于乙醇但极易溶于水,在水中的溶解度随温度变化如表1 [9]。
由上述文字可以看出,磷酸铁不溶于水,但硫酸钠在水中却有较好的溶解度,因此我们可以根据二者在水中的溶解度差异,用去离子水在一定条件下实现二者的分离。
3. 实验仪器及试剂
3.1. 实验仪器
上海精科仪器公司JA2603B电子天平;Ⅰ型旋片式真空泵;智能恒温定时磁力搅拌器;SHB-Ⅲ循环水式多用真空泵;X射线荧光光谱仪XRF;美国尼高力生产Nicolet 670傅里叶变换红外光谱仪。
3.2. 实验试剂
乙醚(99.5%)购于国药集团化学试剂有限公司,硝酸钡(99%)购于安耐吉化学试剂公司。
4. 实验部分
4.1. 实验流程图
如图1:
4.2. 实验方案
1) 将含有磷酸铁、硫酸钠等物质的样品进行真空干燥。
2) 取3.0 g干燥好的样品,将其溶于100 mL水中,在60℃~65℃下进行搅拌约60 min。
3) 将得到的混合液体进行抽滤,并不断用去离子水(水温仍为60℃~65℃)进行淋洗。
4) 将硝酸钡溶液(浓度为0.01 mol)用滴管滴加进抽滤瓶的液体中,若有白色沉淀产生,则重复上一步操作;若无白色沉淀产生,则停止淋洗。
5) 向淋洗后的样品中加入乙醚,待抽滤结束。
6) 将得到的固体进行真空干燥。
7) 称量干燥后的固体质量,并将所得固体送检(XRF和IR),分析实验是否有效。
4.3. 实验过程
4.3.1. 样品预处理
样品中主要包含磷酸铁,而磷酸铁湿料较为粘稠,用传统的干燥技术(例如在普通烘箱中干燥)难以解决,不仅烘干不均匀,而且极其浪费时间,能耗极大。因此本实验采用真空干燥,使其可以不用在较高的温度下也能做到干燥,需要注意的是,在真空干燥过程中样品的形态会发生变化,起初为粘稠状,在失去较多水分后会变成块状固体,此时需将这些块状固体捣碎至颗粒状,以加快干燥进度,当样品以颗粒状和粉末状共存(以大小不一的颗粒状为主,有少量粉末状固体)时,且晃动圆底烧瓶时样品在瓶中运动平滑并完全不挂壁,干燥即可停止。以3.0 g样品为例,真空干燥只需要200~225 min左右,而若采用烘箱干燥则需要600~720 min。
做五组实验,皆取3.0 g干燥后的样品并按照上方案进行实验,其中搅拌时转速在180~200 rad/min之间,取0.13068 g硝酸钡溶于50 mL去离子水中制得0.01 mol硝酸钡,用该浓度溶液检测硫酸根离子的存在,在抽滤瓶中无沉淀产生后,分别记录各自用水量,然后将各自得到的固体真空干燥并记录时间,最后将给每次得到的干燥固体进行称量,记录质量数值,上述各数据如表2所示:
4.3.2. 产物处理
将水洗过后的混合物Ⅱ进行真空干燥时,同样需要将块状物体碾碎至小颗粒状,当混合物以颗粒状和粉末状共存(以大小不一的颗粒状为主,有少量粉末状固体)时,且晃动圆底烧瓶时样品在瓶中运动平滑并完全不挂壁,混合物Ⅱ颜色由黄色变为灰白色时,干燥即可停止。
5. 产物结构表征
5.1. XRF分析
将原样品和混合物Ⅲ分别送XRF检测,检测结果显示各个物质的含量如表3、表4所示,其中表3为原样品数据,表4为混合物Ⅲ数据。由表3、表4我们可以清晰地看出在实验前后硫酸根与钠离子显著减少,而磷酸根和铁离子的含量上升明显,且原样品中其铁磷比(Fe:P)为1.12,产物的铁磷比(Fe:P)则为0.98。

Table 3. Main data of original sample XRF detection
表3. 原样品XRF检测的主要数据

Table 4. Main data of XRF detection of mixture III
表4. 混合物III XRF检测的主要数据
5.2. 傅立叶变换红外光谱仪分析

Figure 2. Infrared spectrum of mixture III
图2. 混合物III红外光谱图
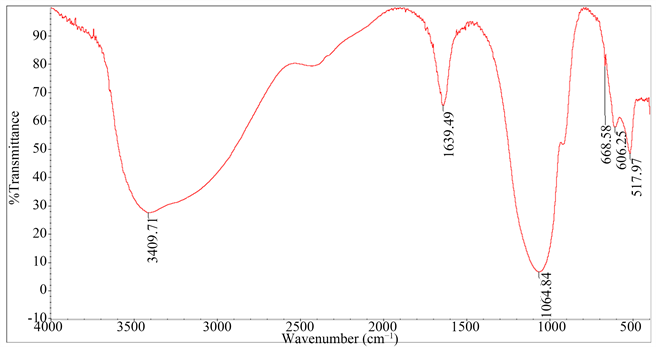
Figure 3. Infrared spectrum of the original sample
图3. 原样品红外光谱图
上述图1所得混合物Ⅲ的红外光谱图如图2,原样品红外光谱图如图3。在原样品的红外图谱中可以看出,606.25 cm−1应为S-O弯曲振动峰吸收峰,而图3的517.97 cm−1应为P-O弯曲振动峰吸收峰,现在S-O对应的峰消失,可认为反应成功,但是除去多少硫酸钠并不能通过红外图谱看出,因为不排除峰合并这种状态,毕竟两个峰靠得近而且比较宽,606.25 cm−1左右的峰是否有残留,且有多少残留无法详细得知。
6. 总结
在本文中主要介绍了去除磷酸铁中硫酸钠的一种方法,该方法只需要用去离子水在一定条件下对样品进行处理即可实现,其工艺步骤少且操作简单便捷,而且经过处理后的磷酸铁,其铁磷比(Fe:P)也达到了0.98,铁磷比对于磷酸铁是否可用是关键指标,其重要性不言而喻,因此该方法不仅可以达到原本实验目的,且能极大提高磷酸铁的品质,有较高的实用和使用价值。