摘要: 目的:筛选慢性铝暴露致认知障碍人群,生信分析其血清外泌体miRNAs的差异表达,构建铝致认知障碍miRNA-mRNA调控网络图,预测其靶基因。方法:筛选广西铝矿区周边某村庄符合慢性铝暴露常驻60岁以上人群,根据MMSE评分表和血铝水平分为铝致认知障碍组6例和健康对照组6例;提取并鉴定血清外泌体,进行第二代高通量测序,筛选出差异表达的miRNAs;分别运用TargetScan数据库、miWalk数据库、miRDB数据库预测靶基因并取交集,运用Cytoscape软件构建miRNAs-mRNA调控网络图;对同时受到两个以上miRNAs调控的靶基因进行GO和KEGG功能富集分析。结果:成功提取并鉴定血清外泌体;完成第二代高通量测序,按照|logFC| ≥ 1,P值 < 0.05的条件,共筛选出130个差异表达的miRNAs,其中表达下调118个,上调12个;根据文献检索筛选其中的5个miRNAs为目的miRNA,即:hsa-miR-381-3p、hsa-miR-370-3p、hsa-miR-135b-5p、hsa-miR-708-3p、hsa-miR-1289;生信分析构建miRNA-mRNA网络调控图中,共有1170个节点、1232条边,显示共有65个靶基因同时受到两个以上miRNAs的调控;对这65个靶基因进行GO和KEGG功能富集后,显示其主要参与调控的生物过程有3个,即:有丝分裂纺锤体形成、蛋白磷酸化及转录负调控、NDA模板形成;细胞成分包括细胞质、轴突起始段、轴突旁节区、神经元投射等9个方面;分子功能包括蛋白质结合、DNA结合、微管结合、蛋白激酶活性、蛋白质丝氨酸/苏氨酸激酶活性等6个方面;KEGG富集到MAPK信号通路。结论:miR-381-3p、miR-370-3p在铝致认知障碍中表达下调,可能通过调控其靶基因FGF7在铝致认知障碍中发挥重要作用,为铝致认知障碍的诊断提供候选靶点。
Abstract:
Objectives: To screen people with cognitive impairment caused by chronic aluminum exposure, analyze the differential expression of serum exosomes miRNAs, construct the miRNA-mRNA regulatory network diagram of cognitive impairment caused by aluminum, and predict its tar-get genes. Methods: People over 60 years old in a village around Guangxi aluminum mining area were selected and divided into 6 aluminum-induced cognitive impairment groups and 6 healthy control groups according to MMSE scale and blood aluminum level. The serum exosomes were extracted and identified, and the second generation high-throughput sequencing was per-formed to screen out the differentially expressed miRNAs. The target genes were predicted by TargetScan database, miWalk database and miRDB database respectively, and the intersection was obtained. The miRNAs-mRNA regulatory network diagram was constructed by Cytoscape software. GO and KEGG function enrichment analysis of target genes was regulated by more than two miRNAs at the same time. Results: Serum exosomes were successfully extracted and identified. The second generation of high-throughput sequencing was completed. According to the condition of |logFC| ≥ 1, P value < 0.05, 130 differentially expressed miRNAs were screened out, of which 118 were down-regulated and 12 were up-regulated. According to the literature search, five miRNAs were selected as the target miRNAs, namely: hsa-miR-381-3p, hsa-miR-370-3p, hsa-miR-135b-5p, hsa-miR-708-3p, HSA-mir-1289. There are 1170 nodes and 1232 edges in the miRNA-mRNA network regulation map constructed by the bio-analysis, which shows that 65 target genes are regulated by more than two miRNAs at the same time. After the enrichment of GO and KEGG functions of these 65 target genes, it shows that there are three bi-ological processes that are mainly involved in regulation, namely, mitotic spindle formation, negative regulation of protein phosphorylation and transcription, and NDA template formation; Cell components include cytoplasm, axon initiation segment, axon paraganglion region and neuron projection. Molecular functions include protein binding, DNA binding, microtubule binding, protein kinase activity and protein serine/threonine kinase activity. KEGG is enriched to MAPK signal pathway. Conclusions: The expression of miR-381-3p and miR-370-3p is down-regulated in aluminum-induced cognitive impairment, which may play an important role in aluminum-induced cognitive impairment by regulating its target gene FGF7, thus providing candidate targets for the diagnosis of aluminum-induced cognitive impairment.
1. 引言
铝(Aluminum, AL)是地壳中第三大化学元素,在自然界中大量存在,铝及其化合物在日常生活、生产中应用广泛,可通过饮水、食物、烹饪用具及粉尘等多种途径进入人体。铝是人体非必需元素,进入人体后会在体内不断积累,特别是在脑内蓄积,造成的健康危害也愈来愈多 [1]。研究表明铝主要危害神经系统,引起认知功能障碍,尤其是损害学习记忆能力,与阿尔茨海默病(Alzheimer’s Disease, AD)等多种神经退行性疾病密切相关 [2]。长期铝暴露会导致人群出现神经系统症状,如学习记忆能力减退,轻度认知功能障碍(Mild-Cognitive Impairment, MCI) [3]。
外泌体是一类膜结合囊泡,在生理条件下所有活细胞都能产生,可随着体液广泛分布于全身各处。外泌体能携带蛋白质、脂质和非编码RNA等多种生物成分,可介导体内细胞远程通讯,通过转运和传递非编码RNA和编码RNA,继而参与细胞间的信息交流 [4]。MicroRNAs (简称miRNAs)是一类在生命进展中具有保守性和稳定性的内源性非编码RNA,主要存在于细胞核和细胞质中,参与基因表达调节,参与细胞分化与发育过程。miRNAs在生物体内普遍存在,而在中枢神经系统中表达丰富,其与神经元的形成、分化以及突触的重塑等密切相关。当神经元发生异常改变后,会伴随具有相应基因调控功能的miRNAs表达的改变,也关联神经系统生理功能能否正常发挥。AD是常见认知障碍性疾病类型之一,与多种因素相关,而铝是诱导类AD认知障碍的因素之一。参照临床诊断AD的常用诊断标准 [5] (“NINCDS-ADRDA”或2011版“NIA-AA”提出的诊断标准),严格筛选铝致类AD认知障碍人群。而AD的诊断依赖于一定的生物标志物,分为诊断标志物和进展标志物两种;其中AD诊断标志物主要是脑脊液Aβ淀粉样蛋白、tau蛋白测定(表现为前者降低,后者升高),脑部断层显像(PET)显示脑淀粉样蛋白扫描;进展标志物主要是脑结构磁共振成像(MRI)显示颞叶基底部、内侧或外侧萎缩,顶叶内侧皮质萎缩和FDG-PET显示颞顶叶皮质葡萄糖代谢下降 [6] [7] [8]。miRNAs存在各种体液中,从外周血中获得较为简单,其改变状态能在一定程度上反映机体的状态。故与以往常用的脑脊液检查相比较,脑脊液采集有创性大,外周血采样会比较安全方便,可减少病人痛苦。因此,与上述既往的AD诊断标志物 [8] 相比,通过采集外周循环血中miRNAs来研究疾病机制有优势。miRNAs由细胞而生,出现更早,检测的阈值低,具有疾病早期预警、诊断的应用前景和意义 [9] [10] [11] [12] [13]。
随着我国西部大开发的进展及广西铝矿的开发建设不断进行,铝矿区环境的巨变,矿区人民高铝暴露的压力增大,研究高铝暴露对当地居民健康的影响显得十分的重要和紧迫。因此,本文就铝致认知障碍者的血清外泌体miRNAs表达情况,并对差异表达的miRNAs靶基因进行分析,为铝致认知障碍的发病机制、筛选早期诊断标志物提供基础研究依据。
2. 材料与方法
2.1. 研究对象
选取广西某铝矿区周边村庄60岁以上的老年人作为研究对象,铝致认知障碍组的纳入标准:① 年龄介于60至90岁之间;② MMSE评分评定:采用上海精神卫生中心制定的标准,文盲得分 ≤ 17分、小学文化得分 ≤ 20分、中学文化得分 ≤ 22分、大学文化得分 ≤ 23分。③ 血铝水平 ≥ 3357.19 μg/L。排除标准:① 存在其他类型的痴呆或认知障碍,如帕金森病痴呆;或其他可引起痴呆的中枢神经系统疾病,如脑肿瘤、脑创伤、中枢神经系统炎性疾病;② 存在显著的精神疾病,如精神分裂症或严重的抑郁症等;③ 存在酒精或药物滥用等情况;④ 有严重的视力、听力障碍而不能配合完成MMSE检查。健康对照组的纳入标准:① 年龄 ≥ 60岁;② 既往体健、无重大疾病史;③ 近3个月内未服用过任何药物;④ MMSE评分正常;⑤ 血铝水平 < 3357.19 μg/L。
2.2. 主要试剂
外泌体提取试剂盒(ribo EXOTM Exosome Isolation Reagent for plasma or serum)购自锐博生物科技有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶快速配制试剂盒、ECL超敏化学发光液均购自碧云天生物技术有限公司;兔单克隆抗CD63 (Anti-CD63 antibody[SY21-02] ET1607-2)、ALIX抗体(Anti-ALIX antibody[JM85-31 ET1705-74])、辣根过氧化物酶(HRP)标记的兔抗IgG (Alpaca anti-rabbit IgG-HRP antibody HA1031)均购自华安生物技术有限公司。
2.3. 主要仪器
−80℃超低温冰箱(美菱,型号:DW-HL340),4℃冰箱(容声,型号:BCD-575WYM),高速冷冻离心机(湘仪,型号:H2500R),去离子纯水机(和泰,型号:Medium-RS30UF),western电泳仪(天津诺禾致源生物信息科技有限公司,型号:EA600)。
2.4. 主要方法
2.4.1. 血清标本的采集
所有受试对象禁食12 h后,于次日上午8点空腹状态用采血管采集外周静脉血5 ml/人,血液样本室温静置30 min,接着放4℃冰箱保存;取出置高速冷冻离心机内,以3000× g离心5 min后,取上层淡黄色血清,在冰上操作分装于1.5 ml EP管中,后置于−80℃冰箱备用。
2.4.2. 血铝水平的测定
取出储存在−80℃冰箱的血清样本并置于−20℃、4℃、冰上依次解冻,取400 μl,加1600 μl去离子水和20 μl的1%HNO3,2000× g离心5min,4℃保存一周待测。采用石墨炉原子吸收法测定血清铝含量。
2.4.3. 血清外泌体的收集
取出储存在−80℃冰箱的血清置于冰上解冻,室温下,2000× g离心20 min,去除残留细胞、碎片,转移上清至新管。使用血清外泌体提取试剂盒进行血清外泌体的提取,严格按照试剂盒说明书的操作进行。加入1/3体积的外泌体分离试剂,颠倒混匀或移液器吹打混匀,直至完全混匀样本(此时溶液呈浑浊),将样品放入4℃冰箱,静置30 min。接着4℃,15,000× g离心2 min,移液器小心地吸去上清,离心获得外泌体沉淀,放入−80℃冰箱保存用于后续实验。
2.4.4. Western Blot检测外泌体标记蛋白
将提取的外泌体沉淀经BCA试剂盒进行蛋白定量,使用10%SDS-PAGE凝胶电泳分离,转印至PVDF膜上,用5%脱脂奶粉封闭2 h,漂洗3次,每次5 min;加入按1:800比例稀释的兔单克隆抗CD63、ALIX抗体,4℃摇床过夜,漂洗3次,每次5 min;二抗室温孵育2 h后,漂洗3次,每次5 min;均匀滴上ECL超敏化学发光液,进行曝光拍照。
2.4.5. 高通量测序
用Trizol从样本中提取total RNA,琼脂糖凝胶电泳切胶选择18~30 nt的片段。分别连接3’接头和5’接头,然后对连接了两侧接头的small RNA进行反转录和PCR扩增。最后琼脂糖凝胶电泳回收并纯化约140 bp的条带,完成文库构建。构建好的文库使用 Agilent 2100以及qPCR进行质控,并上机测序。测序过程由基迪奥生物有限公司完成。
2.4.6. 筛选差异表达miRNA
对上述数据运用R/Bioconductor统计语言对芯片数据进行处理,将表达谱中的原始数据读入R操作平台,对数据进行标准化处理,运用limma包分析并筛选差异表达基因,筛选条件为P < 0.05,|logFC| ≥ 1;并绘制火山图。
2.4.7. miRNA-mRNA调控网络的构建
筛选出差异表达miRNA之后,进行miRNA靶基因预测。分别运用Target Scan数据库,miRDB数据库、miWalk数据库进行靶基因预测,选取3个数据库中均存在的基因作为靶基因。运用cytoscape3.8.2软件构建miRNA-mRNA调控网络图,筛选出由2个或多个miRNAs共同调控的靶基因。
2.4.8. 对靶基因进行GO和KEGG分析
使用DAVID6.8生物信息学资源数据库对靶基因进行GO和KEGG通路富集分析。以P < 0.05为差异有统计学意义。
3. 结果
3.1. 血清外泌体的分离鉴定
蛋白免疫印迹(Western Blot, WB)检测外泌体标记蛋白分子,表明提取的外泌体均表达CD63,ALIX标记蛋白分子,如图1。纯化的样品中含有外泌体颗粒。

Figure 1. WB Identification of the expression of exosome marker protein molecules
图1. WB鉴定外泌体标记蛋白分子的表达
3.2. 差异表达miRNA的筛选结果
筛选铝致认知障碍组和健康对照组血清外泌体差异表达的miRNA,筛选条件为|logFC| ≥ 1,P < 0.05,共筛选出130个差异表达的miRNAs,其中118个下调表达,12个上调表达,并绘制火山图,如图2。经文献检索选择尚未在铝致认知障碍中报道,且参与AD致认知功能障碍的hsa-miR-381-3p (下调)、hsa-miR-370-3p (下调)、hsa-miR-135b-5p (下调)、hsa-miR-708-3p (下调)、hsa-miR-1289 (上调)作为本研究的候选miRNA。
3.3. miRNA-mRNA调控网络分析
对候选miRNA进行靶基因预测。选择在Target Scan数据库,miRDB数据库、miWalk数据库中均预测到的基因作为靶基因,对5个miRNAs靶基因作调控网络图,如图3。该网络中共有1170个节点,

Figure 2. Volcanic map of difference miRNA
图2. 差异miRNA的火山图

Figure 3. Regulatory network diagram of miRNA target gene. Note: the green diamond is miRNA, and the oval is miRNA target gene predicted in the Target Scan database, miRDB database and miWalk database, among which purple is the target gene regulated by two miRNAs
图3. miRNA靶基因调控网络图。注:绿色菱形为miRNA,椭圆形为Target Scan数据库、miRDB数据库、miWalk数据库中均预测到的miRNA靶基因,其中紫色为受到2个miRNA调控的靶基因
1232条边。该网络共含有1165个靶基因,其中受到了两个或多个miRNA共同调控靶基因有65个,分别是:AAK1、ANK3、AP3M1、ATRN、BHLHB9、C18orf25、CA12、CAMK1D、CENPO、CHD2、CLOCK、CMTM4、CREBRF、DCAF10、EBF1、EML1、FAM168B、FGF7、FRMD4B、GRB10、HNRNPL、IPO9、KCTD15、KDM5B、KIF11、KIF1B、KLF12、MAP4、MBNL1、MCL1、MEGF9、MKNK2、MYEF2、NFASC、NSL1、PBX1、PLEKHA6、PSD3、R3HDM2、RAB15、RAB6B、RBPJ、RNF170、RPS6KA6、RRAS2、SBSPON、SH3PXD2A、SLC25A24、SLC30A4、SLC6A17、SMOC1、SNX8、SPRED1、STRN3、STX7、SYT11、TAOK1、TBCK、TET3、THEMIS、TRIM33、VCAN、VCPIP1、ZBTB39、ZHX3。
3.4. 靶基因的GO和KEGG分析
将受到两个或多个miRNAs共同调控的65个靶基因进行GO和KEGG通路分析得到19条功能注释,结果显示,生物过程包括有丝分裂纺锤体组织、蛋白磷酸化及转录负调控,NDA模板共3个方面。细胞成分包括细胞质、轴突起始段、轴突旁节区、溶酶体、神经元投射等9个方面,分子功能包括蛋白质结合、DNA结合、微管结合、蛋白激酶活性、蛋白质丝氨酸/苏氨酸激酶活性、转录因子活性,序列特异性DNA结合共6个方面,KEGG富集到MAPK信号通路1个信号通路。如图4。
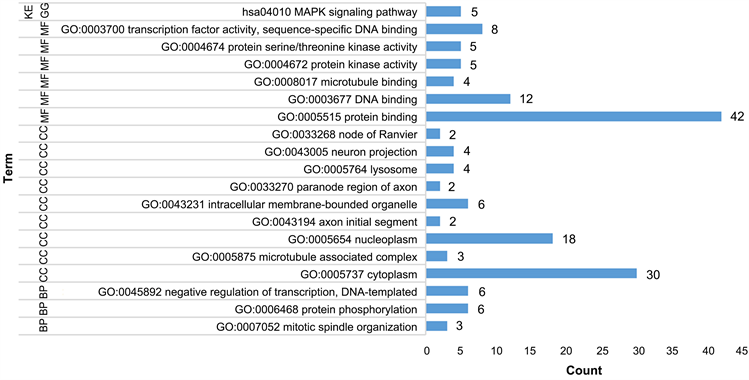
Figure 4. Target genes GO and KEGG, Remarks: BP: biological process; CC: Cell components; MF: Molecular function
图4. 靶基因GO和KEGG,备注:BP:生物过程;CC:细胞成分;MF:分子功能
4. 讨论
环境铝暴露可能导致机体铝的蓄积,造成神经细胞形态学的改变,从而影响学习记忆能力,导致认知功能障碍。流行病学研究发现,暴露于高铝饮水环境可使人群AD发病率明显升高 [14],且减少铝暴露可减少AD的发生 [15]。动物实验证实摄入过量铝可引起实验动物大脑铝含量增加,学习记忆能力下降,出现与AD病理过程相似的形态学改变 [16] [17]。广西铝矿区的快速发展给周边村庄带来经济发展的同时也给居民带来了持续增加的铝暴露压力。我们课题组在以往研究中也发现了矿区老年人的认知能力与非矿区老年人的认知能力有显著性差异 [18]。
MCI是介于正常衰老和痴呆之间的一种认知缺损状态 [19],表现为记忆力减退与年龄不相称,但没有达到AD的标准。MCI常常是AD发病的预警状态,是进行预防性干预的最佳状态 [20]。如果能够早期发现和监护MCI,并在此阶段进行干预,延缓MCI发展成为AD的可能具有重要意义。因此,研究铝与MCI的关联,对MCI的早期生物标记物的检测尤为重要。
miRNA是一种稳定存在于组织和体液中的小分子非编码RNA。越来越多的研究表明,疾病中异常表达的miRNA有作为疾病早期诊断生物标记物的价值。本研究中对广西某铝矿区周边的村庄的老年人进行血清样本的收集、提取并鉴定外泌体后进行高通量测序;筛选出130个差异表达的血清外泌体miRNA。结果显示,与健康对照组相比,铝致认知障碍组差异表达miRNA中表达下调的miRNA居多,有118个miRNAs表达下调,12个miRNAs表达上调。根据文献检索进行筛选,我们确定研究其中5个与认知障碍相关的显著差异表达miRNAs,即4个下调表达:hsa-miR-381-3p、hsa-miR-370-3p、hsa-miR-135b-5p、hsa-miR-708-3p,1个上调表达的hsa-miR-1289。
miRNA通过与其靶基因序列互补从而抑制靶基因表达,在基因转录和转录后水平发挥重要的调控作用。本研究中通过3个数据库预测了在铝致认知障碍中存在差异表达的5个miRNA靶基因,并绘制了miRNA-mRNA调控网络图,网络图中有65个靶基因同时受到多个miRNA共同调控。Jain等 [21] 的研究表明STRN3是参与维持内质网稳态的内在调节途径的一个组成部分。VCAN (versican)属于硫酸软骨素蛋白聚糖,能够调节细胞迁移和突触生长,积极参与神经系统的发展与成熟 [22];张建鹏等 [23] 的研究显示糖基化的VCAN在帕金森患者脑组织和血浆中表达上调,VCAN糖基化促使VCAN表达量升高,从而抑制帕金森患者受损的神经再生。因此,推测调控网络中miRNA及受到多个miRNA调控的靶基因可能参与了铝致认知障碍的发病与进展。
铝致认知障碍的机制可能是铝诱导多种细胞器(如内质网、线粒体)损伤,或蛋白质功能障碍,导致细胞内钙稳态的失调,激活一系列信号通路。对受到多个miRNA调控的靶基因中进行GO和KEGG分析,结果富集在MAPK信号通路,参与MAPK信号通路的靶基因包括RPS6KA6,FGF7,TAOK1,MKNK2,RRAS2。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是一类丝氨酸/苏氨酸激酶,由多种同工酶组成,主要包括细胞外调节蛋白(ERK)、c-Jun N-末端激酶(JNK)和p38MAPK。MAPK信号通路与细胞的生长、发育、分化、凋亡等均有密切联系,MAPK在中枢神经系统广泛表达,各种细胞外刺激信号,包括神经递质、神经营养因子、生长因子等均可通过MAPK通路影响突触传递、神经元的重塑、形态分化和生存等,从而参与神经系统多种疾病的病理过程。有研究表明MAPK信号通路参与Aβ的沉积和tau蛋白的过度磷酸化过程 [24]。
hsa-miR-381-3p的编码基因位于14号染色体的长臂上,属于miR-154基因家族,多项研究表明,hsa-miR-381-3p在肺癌、肝癌、结肠癌等恶性肿瘤中异常表达。同时也有研究发现miR-381-3p序列在不同物种之间高度保守,其靶基因富集于MAPK、Wnt、mTOR等信号通路 [25]。研究表明,在宫颈癌组织中miR-381-3p低表达而FGF7高表达,且明确提示了miR-381-3p和FGF7之间存在直接的靶向作用关系,且呈负相关,miR-381-3p下调GFG7的表达,从而抑制了宫颈癌细胞增殖、迁移和侵袭,阻滞了细胞周期以及促进细胞凋亡 [26]。成纤维细胞生长因子(fibroblast growth factor, FGFs)是由多种组织释放的具有广泛生理和生物学特性的信号分子家族。FGF7属于该家族,且FGFR2b是其高亲和力受体 [27]。FGF7结合促进FGFR2b二聚化,然后快速诱导一些信号通路,如RAS-MAPK和PI3K/Akt,他们在肿瘤发展中起着重要作用 [28]。Chen W等 [29] 在AD患者和Aβ诱导的SH-SY5Y细胞中miR-107的表达水平显著降低,证实miR-107可降低FGF7的表达水平,随后使FGFR2/PI3K/Akt通路失活。我们的研究中miR-381-3p也是低表达,在预测靶基因时hsa-miR-381-3p、hsa-miR-370-3p都预测到了FGF7,且FGF7也参与了MAPK信号通路,因此,我们推测在铝致认知障碍中hsa-miR-381-3p、hsa-miR-370-3p与FGF7存在靶向关系,且在MAPK信号通路中发挥着作用。
综上所述,环境铝暴露可能导致机体铝蓄积,损害人体学习记忆能力导致MCI,筛选出铝致认知障碍差异表达的血清外泌体miRNA及其预测的靶基因,hsa-miR-381-3p、hsa-miR-370-3p、hsa-miR-135b-5p、hsa-miR-708-3p、hsa-miR-1289有望成为铝致认知障碍早期诊断的靶点。
5. 研究的局限性与展望
本研究有实际的参考价值,但也存在一定的局限性。前期,本课题组主要通过横断面调查广西某铝矿区周边村庄60岁以上老年人群的认知能力,缺少纵向调研资料,也就缺少长期铝暴露致认知障碍的横向、纵向对比;本研究采用的认知能力量表作为评定认知功能水平的一种辅助工具,研究对象是否为确诊的铝致类AD认知障碍人群,尚需要结合严谨、充足的临床检查指标,如脑部影像学变化、脑部电生理学变化等检查;本研究开展期间受到疫情管控限制,采集血样本数量有限,可选取并用于基因测序的样本不足;测序结果尚需要更多体内外实验进行相关基因表达调控的验证等。鉴于此,本课题组接下来的工作将围绕上述不足展开。我们会针对铝矿区常驻老年人群进行纵向随访调研,以更好地了解其认知能力变化与铝暴露周期的相关性情况;并通过增加多元化认知能力评估量表来评价老年人群的认知水平,增加临床诊断所需相关临床检查指标;通过qPCR检测法对动物铝暴露实验、细胞铝暴露实验验证测序结果,目标验证候选miRNAs与其靶基因的靶向关系;此外,还可通过与乡镇卫生院联结共建,加强入村入户调研,进一步收集并增加样本量以继续进一步的研究。从而为减轻铝矿区工作者及周边高铝暴露认知障碍居民的家庭负担,为区域性健康稳步发展做出积极探索和贡献。
基金项目
国家自然科学地区基金项目(编号:31560294);广西少数民族人类学研究重点实验室。
NOTES
*第一作者。
#通讯作者。