摘要: 目的:探索靶免治疗对合并MVI的原发性肝癌术后近期复发的预防作用。方法:回顾性分析我院在2018年1月至2020年5月期间的116例合并MVI的原发性肝癌患者临床资料,根据肝切除术后治疗方法分为两组:对照组57例术后仅采用TACE术治疗,治疗组59例术后采用TACE + 靶免联合治疗,比较两组肝切除术后肝功能、T淋巴细胞亚群、肿瘤标志物变化,并随访1年,分析术后复发、无瘤生存情况。结果:治疗组患者1年后CA199 (301.12 ± 19.68) U/mL、癌胚抗原(92.13 ± 10.11) ng/mL、甲胎蛋白水平(428.33 ± 28.45) ng/mL均低于对照组1年后CA199 (332.37 ± 20.34) U/mL、癌胚抗原(113.13 ± 15.58) ng/mL、甲胎蛋白水平(467.89 ± 27.98) ng/mL (P < 0.05)。治疗组患者1年后CD8+ (29.74 ± 3.17)%、CD4+ (46.77 ± 5.58)%、CD3+(63.87 ± 5.67)%、CD4+/CD8+比值(1.95 ± 0.37)均优于对照组1年后CD8+ (27.49 ± 2.49)%、CD4+ (41.54 ± 4.48)%、CD3+ (60.12 ± 3.33)%、CD4+/CD8+比值(1.62 ± 0.27) (P < 0.05)。治疗组术后1年的无瘤生存率66.10%,高于对照组47.37%,1年内复发率8.47%,低于对照组26.32% (P < 0.05)。结论:合并MVI的原发性肝癌患者术后进行靶免治疗,不仅对肝功能影响小,还可降低肝切除术后肝癌的复发率,对合并MVI的原发性肝癌术后近期复发具有预防作用。
Abstract:
Objective: Explore the preventive effect of target immune therapy on the short-term recurrence of primary liver cancer with MVI. Methods: A retrospective analysis of the clinical data of 116 patients with primary liver cancer with MVI in our hospital from January 2018 to May 2020, and dividing into two groups according to the treatment method after hepatectomy: for 57 cases in the control group after operation, only TACE was used for treatment, and 59 cases in the treatment group were treated with TACE + target immune combined treatment after hepatectomy. The liver function, T lymphocyte subsets, and tumor markers were compared between the two groups after hepatecto-my. Follow up for 1 year to analyze postoperative recurrence and tumor-free survival. Results: After 1 year, CA199 (301.12 ± 19.68) U/mL, carcinoembryonic antigen (92.13 ± 10.11) ng/mL, and al-pha-fetoprotein levels (428.33 ± 28.45) ng/mL of patients in the treatment group were lower than those in the control group after 1 year, CA199 (332.37 ± 20.34) U/mL, carcinoembryonic antigen (113.13 ± 15.58) ng/mL, alpha-fetoprotein level (467.89 ± 27.98) ng/mL (P < 0.05). After 1 year, CD8+ (29.74 ± 3.17)%, CD4+ (46.77 ± 5.58)%, CD3+ (63.87 ± 5.67)%, CD4+/CD8+ ratio (1.95 ± 0.37) of patients in the treatment group were better than CD8+ (27.49 ± 2.49)%, CD4+ (41.54 ± 4.48)%, CD3+ (60.12 ± 3.33)%, CD4+/CD8+ ratio (1.62 ± 0.27) (P < 0.05). The 1-year tumor-free survival rate of the treatment group was 66.10% higher than that of the control group 47.37%, and the re-currence rate within 1 year was 8.47% lower than that of the control group 26.32% (P < 0.05). Con-clusion: Target immune therapy for patients with primary liver cancer with MVI after surgery not only has a small impact on liver function, but also reduces the recurrence rate of liver cancer after hepatectomy, and prevents the short-term recurrence of primary liver cancer with MVI.
1. 引言
肝癌是消化系统常见恶性肿瘤,经流行病学调查 [1],发病率位居恶性肿瘤第5位,具有预后差、发病率高特点。合并微血管侵犯(microvascular invasion, MVI)的原发性肝癌患者术后辅助治疗,目前以肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)为首选方案,能够阻断肿瘤供血动脉,促使肿瘤细胞缺血、缺氧,达到阻止肿瘤生长目的,但TACE无法使肿瘤完全坏死,术后复发率较高 [2]。近年来随着医学不断发展、更新,分子靶向治疗得到广泛推广。索拉菲尼是业内较为认可的一种靶向药物,作为多靶向全身抗肿瘤药物,能够调节血管内皮生长因子受体,抑制肿瘤细胞增殖,阻止新生血管形成,然而,该项疗效单方面使用,仅对肝细胞癌生长具有抑制作用,对合并MVI者,效果欠佳,故需寻找新的治疗方案 [3]。程序性死亡受体1 (programmed death-1, PD-1)在过去十年中彻底改变了多种恶性肿瘤的治疗方案,自2012年首次发表具有肿瘤免疫调节机制,开始广泛用于临床 [4],但PD-1抗体在国内上市较晚,疗效仍处于探索阶段,基于此,本文进一步分析索拉菲尼联合PD-1治疗效果,并以肝功能、肿瘤标志物、免疫功能、复发作为预后评估指标,进一步分析联合治疗在合并MVI的原发性肝癌患者中的作用性。
2. 资料和方法
2.1. 资料
纳入标准:① 符合肝癌诊断标准 [5],且均存在MVI迹象;② 均接受TACE治疗;③ 预计生存时间 > 3个月;④ 临床资料齐全。排除标准:① 肝功能失代偿者;② 近3个月接受过靶向药物治疗者;③ 对于免疫治疗药物过敏者;④ 同时患有其他恶性肿瘤者,如甲状腺乳头状癌、宫颈癌、门静脉癌栓;⑤ 存在严重抵触情绪者。
回顾性分析的116例合并MVI的原发性肝癌患者均在2018年1月至2020年5月收集。男性69例,女性47例,平均年龄(59.68 ± 4.74)岁,肿瘤直径大小(4.46 ± 2.42) cm;肿瘤个数:单个52例,多个64例;Child-Pugh分级:A级50例,B级66例。根据肝切除术后治疗方法分为两组,两组各项资料见表1,相比之下,无统计差异性(P > 0.05)。

Table 1. Comparison of general information
表1. 对比一般资料
2.2. 方法
对照组采用TACE术治疗,局麻,经皮穿刺股动脉,置入导管,抵达肝固有动脉,进行造影,根据血供情况制定化疗方案,选用表阿霉素、5-FU、吡柔比星作为化疗药,将其混合碘化油注入,并在术后给予常规保肝治疗和相应对症处理。治疗组进行索拉菲尼联合PD-1治疗,在TACE治疗后3 d口服40 mg索拉非尼,每日2次,PD-1选用Pembrolizumab,每日一次,每次200 mg,21 d为一疗程,两组均进行6~12个月治疗。
2.3. 观察指标
① 抽取受检者5 mL肘静脉血,一管用于检测肿瘤标志物,一管用于检测肝功能,均需静置10 min后,血清分离,离心10 min,以3000 r/min速率,放于冰箱内待检,采用微粒子酶免疫法检测糖类抗原199 (Cancer Associated Antigen199, CA199)、癌胚抗原、甲胎蛋白,采用迈瑞BS-280型号全自动生化分析仪检测总胆红素(total bilirubin, TBIL)、白蛋白(albumin, AIB)、丙氨酸转氨酶(alanine aminotransferase, ALT);② 比较T淋巴细胞亚群,使用赛默飞Attune Nxt流式细胞仪检测CD8+、CD4+、CD3+、CD4+/CD8+比值;③ 经12个月随访,统计复发率(经数字减影血管造影、超声检查发现阳性病灶)及无瘤生存率。
2.4. 统计学处理
采用SPSS22.0统计学软件处理,非正态分布的计量资料使用M (P25, P75)表示,组间比较使用Mann-Whitney U检验,符合正态分布的计量资料,用(
± s)表示,行t检验,计数资料行χ2检验,用(%)表示,P < 0.05表示数据有统计差异。
3. 结果
3.1. 两组肿瘤标志物比较
两组比较治疗前外周血清肿瘤标志物无统计学差异性(P > 0.05),治疗组治疗后1年的CA199、癌胚抗原、甲胎蛋白改善情况优于对照组(P < 0.05)。如表2所示。

Table 2. Comparison of tumor markers
表2. 对比肿瘤标志物
3.2. 比较肝功能
两组比较治疗前肝功能无统计学差异性(P > 0.05),两组接受治疗后TBil、AIb、ALT指标均较同组治疗前有所升高,但幅度较少。而比较两组治疗后TBil、AIb、ALT也无明显统计差异性(P > 0.05)。如表3所示。

Table 3. Comparison of liver function between the two groups
表3. 对比两组肝功能
3.3. 比较T淋巴细胞亚群
两组比较治疗前外周血清肿瘤标志物无统计学差异性(P > 0.05),治疗组治疗后6个疗程的CD8+、CD4+、CD3+、CD4+/CD8+比值改善情况优于对照组(P < 0.05)。如表4所示。

Table 4. Comparison of T lymphocyte subsets
表4. 对比T淋巴细胞亚群
3.4. 比较复发情况
治疗组1年内复发率低于对照组(P < 0.05)。如表5所示。

Table 5. Comparison of recurrence rates between the two groups
表5. 对比两组复发率
3.5. 比较生存情况
无瘤生存率比较,所有患者经1年随访,治疗组生存中位数11个月,生存率66.10% (39/59);对照组生存中位数8个月,生存率47.37% (27/57);生存比较存在统计学差异性(χ2 = 4.149, P = 0.042)。经Kaplan-Meier生存分析显示,两组患者生存时间比较差异有统计学意义(P < 0.05)。如表6、图1所示。

Table 6. Analysis of the mean survival rate after 1 year
表6. 1年后生存率平均值分析
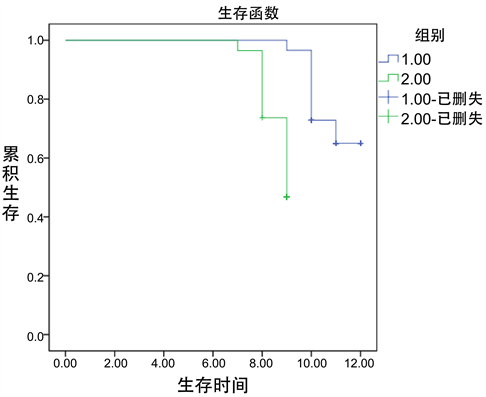
Figure 1. Analysis curve of disease-free survival rate after 1 year
图1. 1年后无瘤生存率分析曲线
4. 讨论
肝癌随着病情恶化,极易入侵血管,造成微血管侵害,因此通过外科切除无法达到根治目的,复发率较高 [6] [7]。TACE相比于传统外科切除术,具有可重复操作、恢复时间短、微创等优势,能够通过注入化疗药和栓塞剂,阻塞肿瘤供血动脉,达到杀灭肿瘤目的,但随着相关研究增多,学者发现其对合并MVI的原发性肝癌患者效果欠佳,且复发率无明显改变,因此,针对术后学者提议联合分子靶向药物治疗,从而降低复发率 [8]。索拉非尼作为靶分子药物中代表性药物,能够干扰信号传导,降低肿瘤增殖速率,达到抑制肿瘤、延长生存时间目的,尽管靶向分子治疗初期效果理想,但最终耐受问题不可避免 [9] [10]。2012年免疫疗法开始推广于临床,靶向PD-1途径彻底改变了更多实体瘤治疗方案,对生存时间产生了较大影响,具有一定意义 [11]。
本研究结果中,两组比较治疗后TBil、AIb、ALT无统计学差异性,说明索拉非尼和PD-1对肝功能影响性均较小,可在临床推广使用。同时,两组接受治疗后,CA199、癌胚抗原、甲胎蛋白水平改善情况均较治疗前有所改善,是因索拉非尼可高效抑制血小板衍化生长因子受体,降低肿瘤增殖速率,防止肿瘤细胞生长,降低肿瘤标志物,但治疗组治疗后肿瘤标志物水平改善情况更优于对照组,说明在索拉非尼基础上,联合PD-1更好调节、提高机体免疫功能,阻断肿瘤血供,抑制肿瘤细胞增殖,降低肿瘤标志物水平。PD-1相对分子质量是55000,由268个氨基酸组成,在活化单核细胞、T细胞中均具有广泛表达性,作为一种T细胞增殖负调节分子,能够维持机体免疫耐受,从而弥补索拉非尼不足,使得抑制肿瘤作用更好发挥 [12] [13]。此外,还有研究表明 [14],TACE可对机体T淋巴细胞造成损伤,影响机体免疫功能。而PD-1抗体能够缓解TACE造成的T淋巴细胞亚群损伤,维持机体正常免疫功能。本研究结果显示,治疗组CD8+、CD4+、CD3+、CD4+/CD8+比值改善情况也优于对照组,说明联合治疗对机体T淋巴细胞亚群起到一定保护作用。PD-1作为T淋巴细胞表面的一类受体,可选择性在癌细胞表面进行高表达,通过与T细胞结合,活化PD-1/PD-L1下游通路,传递负性信号,进而激活免疫活性,从而增强T细胞对肿瘤细胞杀伤,有望成为肿瘤免疫治疗领域中一大热点 [15]。
从远期疗效角度分析,肿瘤血管形成和肿瘤细胞增殖是肿瘤转移、生长的关键之一。索拉非尼作为多激酶抑制剂,进入人体后,可有效抑制血管内皮生长因子和血小板衍生生长因子,干扰信号通路,抑制肿瘤血管新生,降低肿瘤增殖速率,从而有效防止肿瘤细胞生长、转移;PD-1是一种免疫共抑制分子,能够对抗细胞增殖,增加细胞凋亡,阻断肿瘤血供,从而降低日后复发。而本研究结果显示,治疗组术后1年复发率低于对照组,无瘤生存率高于对照组,说明在索拉非尼基础上联合PD-1治疗更好发挥协同作用,有效阻断肿瘤血管生成,抑制肿瘤增殖,从而降低日后复发率 [16] [17]。分析原因在于:索拉非尼可通过抑制血管内皮生长因子受体,阻断MEK/ERK信号传导通路,防止肿瘤血管生成,抑制肿瘤增殖,在此基础上,联合PD-1更好阻止处于增殖期的癌细胞扩散,阻断肿瘤血供,杀灭参与未坏死的肿瘤细胞,从而提高临床疗效 [18]。
5. 结论
综上所述,索拉非尼联合PD-1治疗能够增强淋巴细胞对肿瘤抗原的杀伤力,抑制肿瘤生长、繁殖,运用于合并MVI的原发性肝癌患者中,更好清除肿瘤细胞,提高机体免疫力,降低日后复发率。
NOTES
*通讯作者E-mail: cjy7027@163.com