1. 引言
胰腺癌是一种发病率不断上升的致死性疾病,确诊通常已出现在晚期,此时放化疗是大多数患者最主要的治疗方式 [1]。近些年高强度聚焦超声发展迅速 [2] ,国内外多项研究证实HIFU能够延长患者生存期及缓解疼痛等临床症状 [3] ,然而,胰腺癌是预后极差的恶性肿瘤,局部复发或远处转移是不可避免的,因此在术前进一步进行危险分层,识别预后因素,能够为临床提供更有效的治疗策略。MRI [4] 具有软组织对比度高,多参数成像等优势,能够更好地突出和显示肿瘤。因此本研究旨在探讨术前动态增强MRI影像学特征在预测晚期胰腺癌(Advanced pancreatic cancer, APC)患者高强度聚焦超声(High-intensity focused ultrasound, HIFU)术后近期疗效中的应用价值。
2. 资料与方法
2.1. 研究对象
本研究为回顾性研究,经青岛大学附属医院伦理委员会批准,免除受试者知情同意。收集2019年7月至2021年5月于我院行HIFU治疗的APC患者的临床及影像学检查资料。患者纳入标准如下:1) 经组织病理学或CT和(或) MRI检查后诊断并分期的不可手术切除的胰腺癌患者;2) 在我院行HIFU治疗;3) 术前2周内行动态增强MRI检查;排除标准如下:1) 缺乏完整临床资料的患者;2) 失访或未进行MRI或CT随访的患者;3) MRI图像具有明显伪影,无法进行分析者;4) 随访时间 < 6个月的患者。最终53名患者纳入本研究。其中男30例,女23例,年龄在39岁~78岁之间(中位年龄62岁)。
2.2. 仪器与MRI检查方法
MRI数据采集在HIFU治疗前1周、治疗后1~3个月,均使用3-TMRI (GE HDX 3.0T系统,GE Healthcare)进行了MR成像。常规扫描序列包括:横轴面同相位及反相位T1WI、横轴面及冠状面脂肪抑制T2WI、横轴面DWI (b值为50,800 s/mm2)。MRI增强检查采用多期动态增强扫描方式,分为动脉期(20~30 s)、门脉期(50~60 s)、延迟期(180 s)。所有MRI图像分析由两名腹部专业放射科医师(分别具有7年及20年腹部影像学诊断经验)完成,并就所观察征象结果达成一致意见。首先,将每个患者平扫T1加权和T2加权图像、动态增强动脉期图像、门静脉期图像、延迟期图像上的肿瘤信号强度与正常胰腺实质进行比较。其次,评估弥散受限的存在,定义为扩散加权成像的高信号强度,在相应肿瘤的表观扩散系数图上为低信号。第三,评估影像学特征,包括侵犯周围血管,主胰管扩张,胰腺萎缩,边缘强化(定义为MRI图像门脉期上的中心区低强化,周边不规则环形强化区域)。
2.3. HIFU治疗
手术采用重庆海扶医疗科技股份有限公司生产的JC型高强度聚焦超声肿瘤治疗系统,进行单次局部消融治疗。治疗前要求患者术前3 d内禁食产气类食物,治疗前10 h禁食及导泻。治疗体位常规采用俯卧位,术前手术人员结合三维重建图像用机载超声探头来明确肿瘤位置、大小、形态以及与毗邻组织的位置关系,确保声通道的安全性,制定治疗计划,每5 mm一层,将病灶划分为多个连续切面,超声功率的选择依据肿瘤的血供情况进行选择,对靶区肿瘤进行点–线–面–体的三维适行治疗。
2.4. 评价标准
HIFU治疗后1个月,根据WHO实体瘤疗效评价标准判断近期疗效:1) 所有已知肿瘤病灶消失并维持至少4周,定义为完全缓解(complete response, CR);2) 肿瘤病灶双径乘积之和减少50%以上并维持4周,定义为部分缓解(partial response, PR);3) 肿瘤病灶双径乘积之和减少不足50%,定义为疾病稳定(stable disease, SD);4) 肿瘤病灶双径乘积之和增加 > 25%或出现新病灶,定义为疾病进展(progressive disease, PD)。总有效率(response rate, RR) = 病例数(CR + PR)/总病例数 × 100%;疾病控制率(disease control rate, DCR) = 病例数(CR + PR + SD)/总病例数 × 100%。根据评价标准将患者分为进展组(PD)和非进展组(N-PD)。
2.5. 统计学分析
使用SPSS 26.0软件进行数据分析。计数资料比较采用X2检验,以频数或百分数表示,计量资料比较采用独立样本t检验,以均数 ± 标准差(
)表示。采用Logistic回归分析HIFU术后短期不良预后的独立危险因素,受试者工作特征曲线(ROC)进一步评价其预测能力。以P < 0.05为差异有统计学意义。
3. 结果
3.1. 疗效评价
本研究共纳入53名APC患者,年龄39岁~78岁,中位年龄62岁,肿瘤大小1.6~7.0 cm,平均(3.8 ± 1.5) cm,其中肿瘤位于胰腺头部16例,位于胰腺体尾部37例。53例APC患者均可进行疗效评估:无CR患者,PR 12例,SD 22例,PD 19例,RR为22.6%,DCR为64.2%。
3.2. APC患者HIFU术后预后不良的相关危险因素分析
在术前临床及影像学资料的单因素Logistic分析中,肿瘤大小(P < 0.001)、延迟期信号强化(P = 0.045)、主胰管扩张(P = 0.034)以及边缘强化(P = 0.001)是短期不良预后的显著影响因素,余临床基线资料及影像学特征差异均无统计学意义(P > 0.05) (表1)。将有统计学意义的资料进一步纳入多因素Logistic回归分析,结果显示肿瘤大小(OR = 2.563, P = 0.008)及边缘强化(OR = 6.073, P = 0.04)是APC患者HIFU术后短期不良预后的独立性危险因素(表2)。

Table 1. Univariate logistic regression analysis of poor prognosis of APC patients after HIFU
表1. APC患者HIFU术后预后不良的单因素Logistic回归分析

Table 2. Multivariate Logistic regression analysis of poor prognosis after HIFU in APC patients
表2. APC患者HIFU术后预后不良的多因素Logistic回归分析
3.3. 肿瘤大小及边缘强化对APC患者HIFU术后近期疗效的预测价值
根据Logistic回归分析绘制ROC曲线,结果显示肿瘤大小、边缘强化及二者联合预测APC患者HIFU术后近期疗效的曲线下面积(AUC)分别为0.847、0.742、0.883,具有较好的预测能力。根据约登指数得出肿瘤大小的截断值为3.45 cm,此时预测灵敏度为89.5%,特异度为67.6%。(图1 (f))
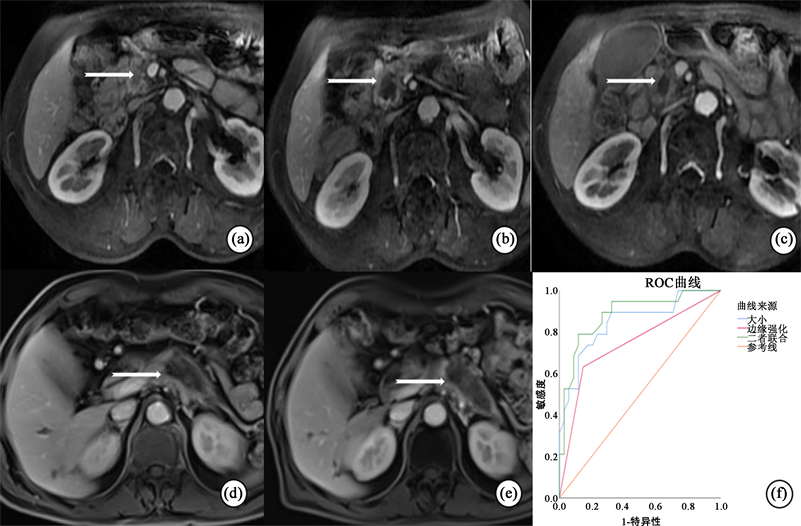
Figure 1. Typical cases and ROC curve for predicting prognosis
图1. 典型病例及预测预后的ROC曲线
4. 讨论
胰腺癌进展速度快,预后极差 [5] [6] ,尤其是对于不能手术切除的病例,尽管化疗和放疗取得了最新进展,但仍需探索和评估具有显著疗效的治疗方案。近十年来HIFU消融术在临床应用中积累了近万次治疗经验。国内外多项研究证实,HIFU对于不可切除胰腺癌有确切的益处,延长患者生存期,缓解患者疼痛等临床症状,还能与放化疗起到协同作用 [7] [8]。胰腺癌的高侵袭性决定了其在术后的复发或进展是不可避免的,因此本研究的目的就是在术前识别肿瘤复发或进展的危险因素并进行危险分级,结合放化疗或靶向治疗等方法,能使患者最大程度获益。
笔者认为HIFU消融治疗APC患者的益处是确切的,突出表现在延长患者生存期及缓解患者疼痛等临床症状上 [9] [10] ,在我们纳入研究的所有APC患者中,近2/3的患者病情在较长时间内得到控制,这个结果是值得肯定的。图1(a)~(c)分别为某患者术前、术后1个月、术后三个月的增强MRI图像,由图1(c)我们不难看出胰腺病灶内无造影剂进入,该患者的临床症状也明显减轻,生活质量明显提高;而图1(d)~(e)所示患者在术后3个月复查动态增强MRI时发现肿瘤体积较前增大,且发生了肝脏转移。因此在术前识别预后不良的危险因素具有重要的临床意义,对高危患者制订个性化治疗方案,结合放化疗或靶向治疗等方式或许能更大程度地改善患者预后。本研究通过回顾性分析所有APC患者的临床及影像学资料,结果显示肿瘤大小及边缘强化是短期预后不良的独立性危险因素。
肿瘤大小 [11] [12] [13] 已被报道是胰腺癌术后的重要预后因素,它在一定程度上反应了肿瘤的侵袭性。肿瘤的大小可以被认为是肿瘤进展的替代指标,Shuichi Mitsunaga等 [14] 认为3 cm或更大的肿瘤是胰腺癌患者的重要组织学预后参数,但我们的研究显示,肿瘤大于3.45 cm时与较差的预后相关联。分析其原因可能是:1) 接受HIFU手术的胰腺癌患者都是处于晚期,较可以手术的早期患者相比肿瘤体积普遍是偏大的;2) 研究的样本量及患者种族不同。此外,我们还发现胰体尾部的肿瘤普遍大于胰腺头部的肿瘤(中位数分别为3.9 vs 2.8 cm,P < 0.01),但由于本研究纳入的样本量较小,未来希望扩大研究对象数量来进一步验证。
边缘强化是指在增强MRI图像上中心区呈现为低强化,周边为不规则环形强化的区域。Sunyoung Lee等 [15] 研究表明在增强磁共振图像上表现为边缘强化的病灶较非边缘强化的病灶在组织学分级更具侵略性以及更频繁的肿瘤内部坏死,HATTORI等 [16] 将动态增强CT图像与病例结果相对照,发现低强化区域与肿瘤内部的坏死相关联,且坏死部分倾向于中心的部分。同理我们可以推测动态增强MRI图像上的低强化区域代表了肿瘤的内部坏死,而有活性的癌细胞移位到外周区域,因此在增强MRI图像表现为肿瘤的边缘强化。多项研究 [14] [17] [18] 结果显示,低分化的肿瘤分级和肿瘤内部的坏死常常与较差的预后相关,这些组织学特征在MRI就呈现为边缘强化这一影像学特征。这与我们的研究结果是一致的,在我们纳入的所有APC患者中19人在术后6个月内发生不同程度的进展,其中12名APC患者在术前增强MRI图像上表现为边缘强化。
实体恶性肿瘤的预后与TNM分期有着密切的关系,胰腺癌也不例外 [12] [19]。由于接受HIFU治疗的胰腺癌患者都是处于III期或IV期,已经失去了手术切除的机会,所以本研究没有对TNM分期这一临床指标进行观察。另有研究 [20] 表明,在增强CT图像上,视觉上等密度的胰腺癌通常比低密度的有更好的生存期。但我们的研究结果表明在MRI图像上等信号的胰腺癌并不是任何动态增强MR成像期(包括动脉期、静脉期、延迟期)的独立预后因素,分析其原因可能是MR成像与CT成像相比,MRI图像具有更高的对比度分辨率,因此在视觉上较少呈现为等信号的胰腺癌病灶。
本研究尚存在一定的局限性:1) 由于是回顾性研究,可能会存在潜在的选择偏倚;2) 本研究的样本量较小,未来还需要在大样本、多中心以及前瞻性研究中进一步验证;3) 我们的随访时间较短,未来还需要进行更长时间的随访及对随访结果进行生存分析等。
综上所述,在术前结合患者的临床及影像学资料对其进行危险分级具有重要的临床指导意义,对于肿瘤体积较大,动态增强MRI图像显示具有边缘强化这一影像学特征的APC患者,应为其制订个性化治疗方案,最大程度改善患者预后。
NOTES
*第一作者。
#通讯作者Email: 18661808272@163.com