1. 引言
原发性痛风表现为急慢性关节炎、关节畸形和痛风石等临床特征,常累及肾脏引起慢性间质性肾炎和尿酸结石,导致急性和慢性肾衰竭。急性心包炎的病因过去常见的是风湿热、结核及细菌感染性;近些年来也出现原因不明的心包炎,自身免疫性疾病、肿瘤、代谢性疾病导致心包炎。痛风合并心包炎的报道较为少见。
2. 病例介绍
患者男,44岁,主因“反复关节疼痛13年,加重伴发热6周”,于2020年11月20日入院。患者于13年前饮酒后出现右手中指近端指间关节疼痛,查血尿酸800 μmol/l,诊断为“痛风”,疼痛多于饮酒、食海鲜后反复发作,约10次/年,渐累及双侧第一跖趾关节、双侧踝关节、双侧膝关节、十指之间关节,自服“双氯芬酸钠”镇痛治疗。2020年10月因“左上肢肿胀”就诊于当地医院,诊断为痛风石合并感染,行手术切开引流,引流物为脓液。术后出现发热,体温最高38.5℃,间隔1~2天,反复发热,偶有畏寒、寒战,伴左膝关节、左踝关节疼痛,胀痛,局部红肿,皮温升高,渐波及右踝关节,右膝关节,伤口处无感染,用药后,体温下降。外院先后应用头孢他啶、头孢哌酮舒巴坦钠、奥硝唑、利奈唑胺、亚胺培南、美罗培南等抗感染治疗,症状无明显改善,复查肾功示肌酐进行性升高,出现血尿。既往:高血压、高血压性心脏病病史。入院查体:BP:141/93 mmHg。贫血貌,左上肢皮肤色素沉着,长约25 cm瘢痕,甲床、结膜苍白,双肺呼吸音清晰,未闻及干湿性啰音。心律齐,各瓣膜听诊区未闻及杂音,腹软,无压痛。双足第一跖趾关节、双手指间关节、双肘关节、双膝关节、双踝关节等多发痛风石,双膝关节、双手指间活动受限,双膝关节肿胀,浮髌试验阳性,双下肢轻度凹性水肿,四肢肌力、肌张力正常,余关节活动度正常,双下肢无静脉曲张。实验室检查:血常规:白细胞计数 17.79*109/L,中性粒细胞计数14.61*109/L,血红蛋白79 g/L,C-反应蛋白(CRP):87.43 mg/L。血凝常规:D-二聚体 3640.00 ng/mL,PT-比值0.64 INR。血沉:82.00 mm/60min。肾功:尿素氮15.46 mmol/L,肌酐205.00 μmol/L,尿酸541.00 μmol/L。抗O:386.00 IU/mL。降钙素原(PCT):0.543 ng/mL。尿液分析:红细胞计数3095.70/uL,尿蛋白3+,隐血3+,白细胞1+,浊度1+。小圆上皮细胞10.70/μL。白细胞计数94.40/μL。相关病原学检查结果均为阴性。胸部CT:双侧胸膜腔积液、左肺下叶肺实变,心影增大,心包积液,冠脉钙化。下腹部CT:双肾周渗出性改变可能。心脏超声检查:1) 左室心肌肥厚(轻度)、升主动脉扩张;2) 主动脉瓣反流(轻微)、二尖瓣反流(轻度)、三尖瓣反流(轻度);3) 左室舒张功能减低;4) 心包积液(中量);5) 左房扩大、左室扩大。初步诊断:痛风石痛风性关节炎发热待查高血压病3级(极高危)高血压性心脏病肾功能不全软组织感染。治疗过程:给予莫西沙星抗感染(5 d),秋水仙碱片抗炎镇痛治疗,同时给予碳酸氢钠碱化尿液,倍他乐克、硝苯地平、缬沙坦降压、控制心率,替普瑞酮抑酸护胃,海昆肾喜胶囊保肾治疗。
患者反复发热,体温最高39.7℃,并出现双膝关节、双踝关节疼痛进一步加重,胸痛,少尿。查体:主动脉瓣第二听诊区可闻及杂音,胸骨左缘三–四肋间可及心包摩擦音,双下肢凹陷性水肿,双膝关节红肿,浮髌试验阳性。辅助检查示高敏肌钙蛋白I (TnI) 0.126 ug/L,N末端B型尿钠肽前体4478.00 pg/mL,肌酐475.00 μmol/L,尿酸820.00 μmol/L。心电图示多导联ST-T段压低,T波倒置;留取血培养、尿培养未见细菌生长。患者发热伴胸痛,查体存在心包摩擦音,心电图较前发生动态改变,心超示存在中量心包积液(见图1(a)),膝关节影像学检查可见痛风石(见图2(a)~(c)),白细胞计数、CRP、PCT均升高,血沉增快;请心内科会诊考虑为急性心包炎,建议激素治疗。患者多关节疼痛、红肿,体温增高考虑为痛风急性发作,合并肾功能不全,肾小球滤过率14.26 ml/min,非甾体抗炎药、秋水仙碱等药物存在治疗禁忌,需加用激素抗炎镇痛,同时治疗急性心包炎。给与患者哌拉西林钠他唑巴坦抗感染,加用醋酸泼尼松15 mg tid治疗。患者肌酐475 μmol/l,持续性少尿,行CRRT治疗;1天后体温正常,关节疼痛较前缓解,3天后复查C-反应蛋白82.27 mg/L;降钙素原0.632 ng/mL;肌酐269.00 μmol/L,尿酸537.00 μmol/L;尿培养:肺炎克雷伯菌肺炎亚种。据药敏结果继续应用哌拉西林钠他唑巴坦抗感染治疗,体温无明显波动;1周后激素减量至20 mg bid,将哌拉西林钠他唑巴坦改为复方磺胺甲噁唑片2片bid治疗,患者病情平稳,无发热,尿酸、肌酐恢复正常。出院2周后随访,患者无发热,周身关节无疼痛、肿胀,尿量正常。血常规、CRP、PCT、TnI均恢复正常,血尿酸408 μmol/l,心包积液消失(见图1(b)、图1(c))。
 (a) 治疗前心脏超声图(超声可见心包腔内见液性暗区,主要分布于左室面,深度为:左室后壁1.7 cm,左室侧壁1.7 cm,中量心包积液,左心室射血分数52%);(b) 治疗后心脏超声图(超声可见心包腔内见液性暗区,主要分布于左室面,深度为:左室后壁0.5 cm,左室侧壁0.4 cm,少量心包积液,左心室射血分数57%);(c) 随访心脏超声(心包腔内未见液性暗区)。
(a) 治疗前心脏超声图(超声可见心包腔内见液性暗区,主要分布于左室面,深度为:左室后壁1.7 cm,左室侧壁1.7 cm,中量心包积液,左心室射血分数52%);(b) 治疗后心脏超声图(超声可见心包腔内见液性暗区,主要分布于左室面,深度为:左室后壁0.5 cm,左室侧壁0.4 cm,少量心包积液,左心室射血分数57%);(c) 随访心脏超声(心包腔内未见液性暗区)。
Figure 1. Cardiac ultrasound
图1. 心脏超声检查
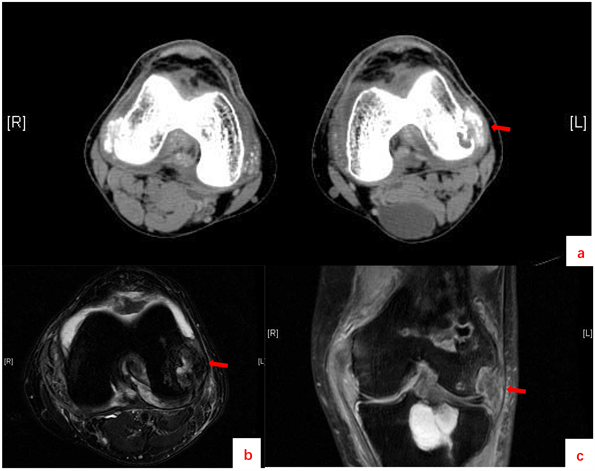 (a) 双膝关节CT (左股骨外侧髁区域可见小囊状骨质吸收区,外侧骨皮质显示不连续,相邻区域及膝关节周围软组织内可见多发不规则钙质样高密度影);(b) 左膝关节MR横断面(左侧股骨外侧髁骨质破坏,团状稍长T2信号影);(c) 左膝关节MR冠状面(左侧股骨远端地图样长T2信号影,内见片状脂肪信号)。
(a) 双膝关节CT (左股骨外侧髁区域可见小囊状骨质吸收区,外侧骨皮质显示不连续,相邻区域及膝关节周围软组织内可见多发不规则钙质样高密度影);(b) 左膝关节MR横断面(左侧股骨外侧髁骨质破坏,团状稍长T2信号影);(c) 左膝关节MR冠状面(左侧股骨远端地图样长T2信号影,内见片状脂肪信号)。
Figure 2. Knee imaging
图2. 膝关节影像学检查
3. 讨论
原发性痛风是由于长期嘌呤代谢障碍,导致血尿酸增高而引起组织损伤的一组异质性疾病。当血中尿酸浓度超过人体生理溶解阈值时,就会形成尿酸盐结晶并沉积于关节及其周围组织,表现为急慢性关节炎、关节畸形和痛风石等临床特征,常累及肾脏引起慢性间质性肾炎和尿酸结石,导致急性和慢性肾衰竭 [1]。痛风性关节炎首次发作多见于第一跖趾关节,或膝、踝、腕及肘等关节 [2]。未经治疗的患者首发症状20年后约70%可出现痛风石,常出现于第一跖趾关节、耳郭、前臂伸面、指关节、肘关节等部位 [3]。痛风性关节炎急性发作,表现为受累关节的红、肿、热、痛、活动受限,实验室检查可表现为红细胞沉降率、C-反应蛋白等炎症指标升高,血象白细胞及中性粒细胞计数也可能升高。
心包炎的主要类型为急性(<3个月)、复发性(反复发作的急性心包炎)和慢性(>3个月)。任何一种都可能导致严重的并发症,如缩窄性心包炎或心包填塞。急性心包炎的诊断标准:心包性胸痛与心包摩擦,新的广泛ST段抬高或PR段压低,新的或恶化的心包积液,炎性标志物如C-反应蛋白、红细胞沉降率和白细胞计数,存在心包炎症;满足两个以上标准即可诊断 [4]。推荐阿司匹林/非甾体抗炎药和秋水仙碱为一线治疗方案,皮质类固醇为二线治疗方案 [5] [6]。急性心包炎的病因过去常见的是风湿热、结核及细菌感染性;近些年来也出现原因不明的心包炎,自身免疫性疾病、肿瘤、代谢性疾病导致心包炎 [7] [8],发病率较低。痛风合并心包炎的报道较为少见。
该患者因“痛风石合并感染”行手术治疗后出现发热、多关节肿痛、血尿酸升高,给予抗炎镇痛、降尿酸、抗感染治疗,效果不显著,后出现心包摩擦音、高敏肌钙蛋白升高、心电图动态改变及心包积液,诊断为痛风性关节炎、急性心包炎;考虑为感染及手术应激诱发痛风急性发作伴随急性心包炎,因同时存在急性肾损伤,eGFR 14.26 ml/min,故选用糖皮质激素治疗心包炎及痛风性关节炎急性发作期。应用醋酸泼尼松后,关节肿痛较前减轻,体温正常,心包摩擦音、心包积液消失,炎症因子、尿酸、肌酐、高敏肌钙蛋白恢复正常水平,抗生素逐渐降级,病情未再反复。痛风急性发作可出现发热、炎症因子升高等类似细菌感染的表现,同时存在关节红、肿、热、痛,但抗感染治疗效果不佳,痛风急性期发作期应以抗炎镇痛为主,对于出现肾脏损害的病人,可启用激素治疗。痛风患者可出现心血管系统共病,如高血压、冠心病、动脉粥样硬化、中风、心力衰竭、周围血管疾病、心房颤动、血栓栓塞等 [9],也有如心肌病等罕见共病,Petra Šulentić等报道了一例慢性、长期和未治疗的痛风伴随扩张性心肌病 [10],目前尚未检索到痛风与急性心包炎的相关报道。
痛风的发生是由于谷氨酸钠尿酸盐(monosodium urate, MSU)激活固有的免疫系统,巨噬细胞介导的中性粒细胞浸润和激活,引起白介素1β (interleukin 1β, IL-1β)驱动的炎症 [11] [12]。MSU激活巨噬细胞NOD样受体热蛋白结构域相关蛋白3 (NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎症体,将其底物IL-1β前体和IL-18前体裂解为成熟形式 [13]。根据目前的证据,NLRP3炎症体同样在心包炎病理生理学中的扮演关键角色,IL-1α在心包中启动局部炎症反应并刺激免疫细胞(即中性粒细胞和巨噬细胞)以及通过NLRP3炎症体产生IL-1β,由于IL-1能够刺激自身的转录和翻译,因此会发生持续的炎症损伤 [14]。急性痛风发作未得到有效控制,不排除MSU刺激心包组织巨噬细胞激活NLRP3炎症体产生IL-1β的可能,具体发病机制需进一步研究。
患者治疗过程中血尿酸持续处于较高的水平,长期应用非甾体抗炎药(Nonsteroidal Antiinflammatory Drugs, NSAIDs)、秋水仙碱,同时合并感染,释放大量炎症因子,共同造成急性肾损伤(Acute Kidney Injury, AKI),出现少尿、肌酐进行性升高。考虑该患者急性肾损伤的原因为:1) 血尿酸持续处于较高水平,尿酸晶体沉积,导致肾小管压力增加,肾内压力增加,肾小静脉压缩充血;导致肾血管阻力增加,肾血流减少,肾小管压力升高,肾小球滤过降低,最终导致AKI [15] [16];急性肾损伤伴高尿酸血症时,通过降低血尿酸水平可减轻或逆转高尿酸血症继发肾脏损伤 [17]。2) 长期应用NSAIDs,其环氧化酶(Cyclooxy-genase, COX)抑制作用可干扰花生四烯酸转化为前列腺素,导致急性血管收缩,导致AKI的发生 [18]。3) 患者左上肢感染后造成全身炎症反应,过量的炎性因子导致肾血流动力学异常,造成肾缺血及灌注不足而导致AKI [19]。患者痛风病史较长,尿酸控制不佳,长期不规范应用NSAIDs,同时合并感染,均为AKI的高危因素;出现AKI后立即停用NSAIDs,换用激素控制痛风发作,应用CRRT清除体内代谢废物、炎症因子及尿酸晶体;随着血尿酸水平下降、炎症因子好转,患者肌酐水平降至正常。
综上所述,痛风急性发作及急性心包炎均可出现发热,应仔细询问患者病史,注重体格检查,避免遗漏像急性心包炎等病情危急的罕见合并症;其治疗中存在共通之处,选择药物时需兼顾。部分痛风患者长期应用NSAIDs,血尿酸控制不佳,易引起肾功能损伤,应密切监测肾功能,避免进一步肾损害。在痛风急性发作期,存在合并心包炎等少见疾病的可能,应重视其造成的脏器的损伤,及时诊断,早期治疗,避免漏诊、误诊。
利益冲突
所有作者均声明不存在利益冲突。
NOTES
*通讯作者Email: qdchenying@qdu.edu.cn