1. 引言
胃肠间质瘤(Gastrointestinal Stromal Tumor, GIST)是胃肠道最常见的间叶来源肿瘤,其年发病率约(10~20)/100万 [1]。因GIST位于胃肠粘膜下,活检困难,且有破裂播散风险,术前不易病理诊断。CT、MRI等可以发现GIST,但和其他间质来源肿瘤鉴别困难。此外,GIST缺乏特异的血清标志物。故术前诊断仍是GIST诊治的难点。
外泌体(Exosomes)是一种细胞产生并主动分泌到细胞外的微小囊泡样小体,其中包含微小RNA (miRNA)、DNA片段、蛋白质和短肽链磷脂等分子 [2]。已有研究显示外泌体miRNA在胃癌 [3]、肝癌 [4]、结直肠癌 [5] 和肺癌 [6] 等肿瘤诊治方面有临床价值,本课题组前期通过高通量测序筛选,检测5位胃间质瘤患者血浆外泌体miRNA表达谱,发现miRNA-423-5p表达较正常人上调2.72倍。本课题进一步研究胃间质瘤患者血浆外泌体miRNA-423-5p的表达情况,以及与临床资料之间的关系。
2. 资料与方法
2.1. 一般资料
选取2020年10月~2022年02月就诊于安徽医科大学第二附属医院的胃间质瘤患者48例。其中女性18例,男性30例,年龄27~69 (50.65 ± 18.35)岁。纳入标准:1) 经组织病理学确诊为胃肠间质瘤;2) 未接受任何形式的抗肿瘤药物治疗;3) 具有完整的临床病理学资料和随访信息。排除标准:1) 合并严重心、脑、血管等重要器官疾病;2) 具有其他组织来源肿瘤病史;3) 发生感染或妊娠。收集入组患者和10名健康人体检静脉血各10 ml,分离血浆,−80℃保存。我院伦理委员会已审核通过本研究(编号YX2020-102F1),患者均签署书面知情同意书。
2.2. 方法
2.2.1. 外泌体提取
首先取出血浆冰上解冻,4℃条件下离心(12,000 g, 30 min),留取上清液。随后使用0.22 μm的过滤器过滤,除去大颗粒囊泡,4℃条件下超速离心(120,000 g, 60 min),去除上清,留下外泌体粗提沉淀。再用预冷PBS溶液重悬沉淀,再次超速离心(4℃, 120,000 g, 60 min),最后得到的沉淀即为高纯度的外泌体,用小体积的预冷PBS重悬沉淀,立即使用或−80℃分装保存。
2.2.2. 外泌体鉴定
首先进行透射显微镜及纳米粒径分析(Nanoparticle Tracking Analysis, NTA):提取外泌体液用2%锇酸溶液固定,清洗脱水后用丙酮置换两次,放入盛有包埋剂的包埋板中,染色清洗后通过JEM-1230透射电子显微镜观察外泌体形状。NTA对外泌体的直径和浓度进行分析(上海研载生物科技有限公司)。然后利用Western Blot检测外泌体标志性蛋白表达,使用RIPA裂解液、蛋白酶抑制剂PMSF (碧云天生物科技有限公司)提取总的外泌体蛋白,10% SDS-PAGE凝胶进行蛋白转膜。在4℃条件下,将膜置入一抗溶液(CD63 1:1000, CD9 1:1000, CD81 1:1000)孵育过夜(CD63抗体,ABclonal,A5271;CD9抗体,Abcam,ab92726;CD81抗体,Abcam,ab109201)。随后在37℃下加抗二抗(Goat anti-mouse IgG, Jackson, 115-035-003)温育1 h,使膜与ECL (Beyotime, P0018S)反应5 min,最后暗盒X片曝光。
2.2.3. qRT-PCR检测外泌体miRNA
按RNAiso Plus (TAKAPA)试剂盒说明书提取外泌体RNA,用Prime Script II RTase试剂盒(TAKAPA)逆转录RNA,再以SYBR Premix EX Taq (Thermo)进行PCR扩增,miRNA-423-5p引物由上海生工合成,以U6为内参(表1)。PCR反应条件如下:95℃,2 min,预变性;95℃,15s,变性,60℃,1 min,退火延伸,40个循环进行扩增,每个样品重复3次。应用2−∆∆Ct法计算miRNA-423-5p的相对表达量。

Table 1. Sequences of the miRNA primers
表1. miRNA引物序列
2.2.4. 统计学处理
采用SPASS 26.0软件,计量资料呈正态分布并用(
)表示,组间比较用t检验,P < 0.05为差异有统计学意义。
3. 结果
3.1. 外泌体的提取和鉴定
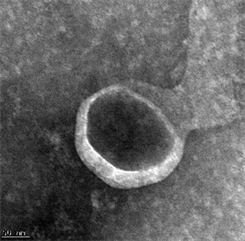
本实验通过透射电子显微镜、NTA、Western Blot对提取的血浆外泌体特性进行鉴定。在透射电镜下放大10,000倍条件下,观察到血浆外泌体 [7] 呈茶托样双层脂质膜结构(图1(A))。NTA分析发现其直径范围为50~300 nm,主要集中于93 nm,对其定量后浓度约为3.63 × 109个颗粒/ml (图1(B))。Western Blot检测外泌体特异性表达蛋白 [8] CD9、CD63、CD81(图1(C))。
3.2. 健康人和间质瘤患者血清外泌体中miRNA-423-5p的表达水平
胃间质瘤患者和健康人血清外泌体中miRNA-423-5p的表达水平采用qRT-PCR进行检测。结果显示,健康人群中miRNA-423-5p表达较低,胃间质瘤患者血清外泌体中miRNA-423-5p表达明显上调,较健康人群上调3.17倍(图2),差异具有统计学意义(P < 0.05)。
 (A)
(A) 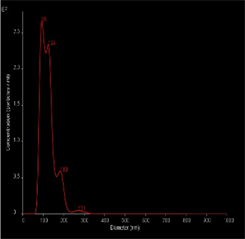 (B)
(B) 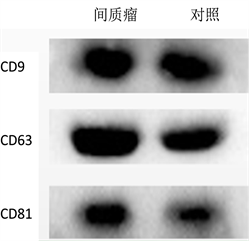 (C)A:在透射电子显微镜(比例尺 = 100 nm)下观测提取的外泌体;B:NTA所提取的外泌体的浓度和根据直径所获取的粒子分布;C:Western Blot检测外泌体特异性标志物CD9、CD63、CD81。
(C)A:在透射电子显微镜(比例尺 = 100 nm)下观测提取的外泌体;B:NTA所提取的外泌体的浓度和根据直径所获取的粒子分布;C:Western Blot检测外泌体特异性标志物CD9、CD63、CD81。
Figure 1. Identification of the blood plasma exosomes
图1. 血浆外泌体的鉴定

Figure 2. Expression levels of exosomal miRNA-423-5p in healthy humans and gastric stromal tumor patients
图2. 健康人和胃间质瘤患者外泌体miRNA-423-5p的表达水平
3.3. 血清外泌体的表达与间质瘤患者临床资料的关系
根据血清外泌体中miRNA-423-5p的表达水平,分析外泌体miRNA-423-5p表达水平与临床资料之间的关系。结果显示,血清外泌体miRNA-423-5p的水平与间质瘤患者性别、年龄无明显差异(P > 0.05),与肿瘤直径、核分裂像、危险度分级呈正相关(P < 0.05),见表2。

Table 2. The relationship between the miRNA-423-5p expression levels and the clinical data in the serum exosomes of patients with interstitial tumors
表2. 间质瘤患者血清外泌体中miRNA-423-5p表达水平和临床资料的关系
4. 讨论
外泌体是一种由活细胞分泌的直径30~100 nm之间的囊泡样小体,广泛存在于组织和循环体液中,同样也存在于肿瘤微环境中。由于其包膜有双层磷脂分子结构,可以保护内含的蛋白质、脂质和miRNA 等因子避免被各种血液中的酶降解,故可以作为天然的“信使”,在细胞与细胞,细胞与组织甚至器官之间传递信息。间质瘤外泌体相关研究较少,2014年Safinur等 [9] 首次从间质瘤患者血浆和细胞株(GIST-T1)培养上清中分离出外泌体,检测发现外泌体中包含有间质瘤特异蛋白,SMA、KIT、CD34、DOG-1和Dismin。本研究中,我们提取间质瘤患者血浆中的外泌体,检测显示具有外泌体典型的特征,如直径在100 nm左右的双层结构,表达外泌体标志蛋白CD9、CD63和CD81。
外泌体miRNA是目前肿瘤研究的热点之一,在胃癌、肝癌、结直肠癌等肿瘤中,已有研究发现外泌体miRNA参与肿瘤的发生、发展、转移以及耐药等环节 [10],在临床上具有诊断和预后判断方面的价值 [11]。李等 [12] 通过分析乙肝相关早期肝细胞癌患者以及健康人群外周血浆标本,发现血浆外泌体miR-15b、miR-224、miR-501表达水平较健康组明显升高(P < 0.05)。采用ROC曲线评估miR-15b、miR-224、miR-501三者联合检测用于乙肝相关早期肝细胞癌诊断的灵敏度、特异度、准确度较单一检测明显提高。Yang等 [13] 通过分析胃癌患者以及健康人群外周血浆标本,发现血浆外泌体miR-423-5p表达水平较健康显著升高(P < 0.001)。采用ROC曲线评估外泌体miR-423-5p与传统的肿瘤生物标志物如CEA、CA-199的诊断效果。发现外泌体miR-423-5p的诊断效果高于CEA和CA-199。Jia等 [14] 通过分析223例结直肠癌和130例健康患者的血浆标本,发现结直肠癌患者血浆外泌体中miR-24、miR-320a和miR-423-5p浓度均低于健康对照组,其中miR-423-5p的表达最低。联合检测3种miRNA,对结直肠的诊断灵敏度为0.90,特异性为0.70。郭等 [15] 通过分析发现结直肠患者血清外泌体miR-92a的表达水平较健康组明显上调(P < 0.05)。采用ROC曲线分析示血清外泌体miR-92a区分结直肠癌患者和健康人的AUC为0.836,特异度为80.8%,敏感度为67.1%。行Cox多因素分析显示血清外泌体miR-92a表达水平可作为结直肠癌患者预后判断的独立影响因素之一。本研究发现外泌体miRNA-423-5p在胃间质瘤患者中表达明显上调,间质瘤患者外泌体miRNA-423-5p表达较健康人上调约3.17倍,差异具有统计学意义(P < 0.05)。提示miRNA-423-5p在间质瘤诊断方面的潜在价值,在胃肠道恶性肿瘤中miRNA-423-5p多低表达,其可能成为鉴别诊断胃肠间质瘤和其他消化道肿瘤的标志物。
在消化道肿瘤研究中发现,miRNA-423-5p即有促癌也有抑癌作用。Liu等 [16] 通过研究发现胃癌组织中的miR-423-5p较匹配的非肿瘤组织明显增高,通过microRNA靶标预测工具发现TFF1是miR-423-5p的靶基因,进一步研究发现TFF1受miR-423-5p负调控,通过上调miRNA-423-5p/TFF1/cyclinD1/cyclinD3信号通路,可促进细胞周期进程,抑制细胞迁移和侵袭。Yang等 [13] 通过研究发现外泌体miR-423-5p在胃癌发展过程中可能发挥促癌因子的作用,通过microRNA靶标预测工具发现融合蛋白抑制因子(SUFU)是miR-423-5p的靶基因,外泌体miR-423-5p通过抑制SUFU的表达,从而增强了胃癌细胞的增殖和迁移。Kong等 [17] 通过研究发现存活小于1年的患者和存活超过5年胃癌患者相比,血清中miR-423-3p的表达明显上调。进一步研究表明miR-423-3p与高龄、肿瘤大小、肿瘤侵袭和远处转移显著相关。此外,miR-423-3p高表达水平的患者比低表达水平的患者整体生存率更差。柯瑞盛等 [18] 通过研究肝癌患者发现癌组织的miR-423-5p的表达水平高于癌旁组织,且高表达miR-423-5p与患者的淋巴结转移,TMN分期及生存预后较差等均呈正相关。进一步研究显示,肝细胞癌中TGFBR3是miR-423-5p的靶基因,miR-423-5p通过上调TGFBR3/PI3K/AKT信号通路促进细胞增殖、迁移侵袭和抑制细胞凋亡。Jia [19] 等通过研究发现结肠癌患者的血浆中miR-423-5p的表达较健康人明显下调。通过转染上调外泌体miR-423-5p,可以促进结肠癌细胞的凋亡,并抑制细胞增殖和菌落形成。提示miR-423-5p在结直肠癌中发挥抑癌作用。既往研究显示在胃肠间质瘤中,预后与肿瘤部位、大小、核分裂像以及危险度等级密切相关,且随着危险度的提升,术后复发转移概率明显提升 [20]。我们研究发现,胃间质瘤外泌体miRNA-423-5p表达与患者年龄、性别无关(P > 0.05),与肿瘤大小、核分裂象以及危险度呈正相关(P < 0.05)。提示外泌体miRNA-423-5p可能起到促进胃间质瘤发生发展,导致预后较差,生存期较短。提示外泌体miRNA-423-5p高表达可能是间质瘤患者预后不佳的标志。
综上所述,本研究表明,miRNA-423-5p在间质瘤患者血浆外泌体中高表达,其高表达可能与预后不良相关,可能成为GIST诊断及判断预后的标志物。