1. 引言
由酒精性肝炎、慢性乙型和丙型肝炎感染以及非酒精性脂肪肝等因素引起的肝细胞癌(Hepatocellular carcinoma, HCC)已成为最常见的癌症之一 [1] - [6]。HCC不仅恶性程度高、治疗难度大,而且预后差、复发率高,患者5年生存率才5%~9%。早期识别高危患者,探索新的生物标志物和治疗靶点进行诊断,深入了解HCC的分子发病机制是控制该疾病的先决条件。
NAP1L1作为核小体组装蛋白1 (NAP1)的同源物,具有核小体组装与重塑、调控细胞增殖、分化、凋亡和染色质修饰等生物学功能。近年来发现其可在多种恶性肿瘤组织呈高表达状态,并通过多种机制通路促进癌症的发生发展 [7] - [14]。在之前的研究中,长链非编码RNA CDKN2B-AS1通过使let-7c-5p海绵化,导致NAP1L1过表达,激活PI3K/AKT/mTOR信号通路,加快HCC细胞增殖,该过程可被PRDM8 抑制;也有文献报道NAP1L1在HCC中募集肝癌衍生生长因子HDGF/关键致癌转录因子c-Jun作为肿瘤促进剂来刺激癌细胞生长 [15] [16] [17]。总之,该蛋白可能对HCC具有潜在的预后价值,并可能为HCC的新生物标志物或诊断靶标提供新的线索。研究肝癌的发病与影响生存预后因素的基因,并寻找出有效的治疗方法已逐步成为临床研究的重点。
本研究通过使用ULCAN和Kaplan-Meier数据库对NAP1L1与患者预后之间的关系进行了全面评估。使用TIMER进一步研究了NAP1L1与肿瘤免疫细胞浸润和耗竭之间的联系。我们的研究结果为NAP1L1在肝癌中的功能作用提供了新的见解,从而突出了NAP1L1影响免疫细胞与肿瘤相互作用的潜在机制基础。
2. 材料和方法
2.1. NAP1L1在泛癌和肝癌中的表达
用TIMER2.0数据库(http://timer.cistrome.org/)在线分析TCGA数据集泛癌NAP1L1的表达差异(*P < 0.05, **P < 0.01, ***P < 0.001)。UALCAN数据库(http://ualcan.path.uab.edu/)和HPA数据库 (https://www.proteinatlas.org/)分析NAP1L1在肝癌组织与正常组织的表达差异。GEPIA 2.0数据库(http://gepia2.cancer-pku.cn/#index)分析NAP1L1表达水平与肝癌患者临床分期的关系。
2.2. HCC中NAP1L1的基因组改变
cBioPortal数据库(https://www.cbioportal.org/)分析来自HCC患者的DNA测序数据,来研究HCC中NAP1L1相关基因突变与患者临床特征和预后的相关性。
2.3. NAP1L1表达与癌症患者预后的关系
UALCAN数据库(http://ualcan.path.uab.edu/)分析NAP1L1的表达水平与无复发生存期(RFS)、疾病特异性生存期(DSS)、总生存期(OS)、无进展生存期(PFS)和临床病理特征相关性。
2.4. NAP1L1相关基因的PPI网络构建及功能富集分析
STRING数据库(https://cn.string-db.org/)分析TCGA数据集HCC队列中NAP1L1的共表达网络。GEPIA 2.0 (http://gepia2.cancer-pku.cn/#index)和DAVID数据库(https://david.ncifcrf.gov/)对共表达基因进行GO和KEGG富集分析。
2.5. NAP1L1表达与免疫浸润细胞的相关性分析
用TIMER数据库(https://cistrome.shinyapps.io/timer/)分析HCC肿瘤组织中NAP1L1的表达水平与肝癌中免疫细胞浸润程度和预后的相关性。
2.6. NAP1L1与免疫标志物表达的相关性评估
TIMER 2.0数据库(http://timer.cistrome.org/)探索泛癌NAP1L1的表达与免疫细胞浸润水平和免疫耗竭分子表达水平之间的相关性,GEPIA 2.0数据库(http://gepia2.cancer-pku.cn/#index)分析NAP1L1与HCC中免疫细胞浸润和免疫耗竭之间的关系。
3. 结果
3.1. NAP1L1在肝癌中的表达
我们首先使用UALCAN和TIMER数据库评估了NAP1L1在肿瘤组织中的表达。本研究发现NAP1L1
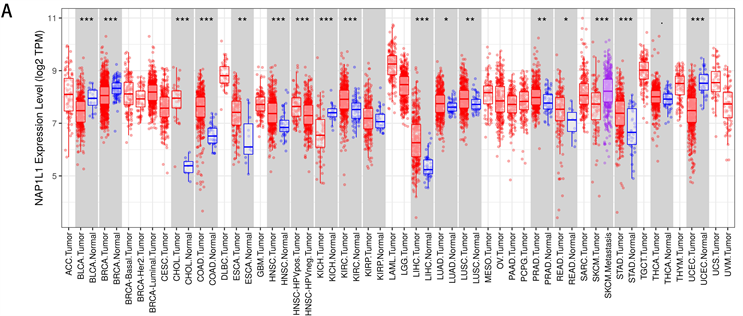
 (A) TIMER数据库中NAP1L1在不同类型肿瘤组织和正常组织中的表达水平(*P <0.05, **P < 0.01, ***P < 0.001);(B) UALCAN数据库探讨NAP1L1在肝癌组织中的表达差异;(C) GEPIA数据库中NAP1L1在不同分期肝癌组织中的表达水平;(D) HPA数据库中NAP1L1在正常组织中蛋白表达;(E) HPA数据库中NAP1L1在肝癌组织中蛋白表达。
(A) TIMER数据库中NAP1L1在不同类型肿瘤组织和正常组织中的表达水平(*P <0.05, **P < 0.01, ***P < 0.001);(B) UALCAN数据库探讨NAP1L1在肝癌组织中的表达差异;(C) GEPIA数据库中NAP1L1在不同分期肝癌组织中的表达水平;(D) HPA数据库中NAP1L1在正常组织中蛋白表达;(E) HPA数据库中NAP1L1在肝癌组织中蛋白表达。
Figure 1. Expression of NAP1L1 in hepatocellular carcinoma
图1. NAP1L1在肝癌中的表达
分子在肝细胞癌(LIHC)、结肠腺癌(COAD)、胃腺癌(STAD)、肺鳞癌(LUSC)、食管癌(ESCA)、头颈鳞状细胞癌(HNSC)、肾透明细胞癌(KIRC)、胆管癌(CHOL)、肺腺癌(LUAD)、直肠腺癌(READ)和前列腺腺癌(PRAD)中表达升高,相反,在(BLCA)、乳腺浸润癌(BRCA)、肾嫌色细胞(KICH)和子宫内膜癌(UCEC)中,NAP1L1的表达明显低于正常组织(P < 0.05) (图1(A),图1(B)),且NAP1L1在肝癌不同分期中差异表达(图1(C)) (P < 0.05)。HPA数据库分析NAP1L1在肝细胞癌及肝脏正常组织中的蛋白表达差异,NAP1L1蛋白在肝细胞癌组织中表达更显著(图1(D),图1(E)) (P < 0.05)。
3.2. HCC中NAP1L1的基因组改变
为了研究HCC中NAP1L1基因突变,使用cBioPortal数据库分析来自HCC患者的DNA测序数据。结果表明,360名HCC患者中有32名(9%)的NAP1L1发生了突变(图2(A))。其中二倍体突变、获得性突变、扩增和轻度缺失突变为其最常见的改变,与二倍体突变和轻度缺失突变相比,获得性和扩增突变组中NAP1L1的表达水平更高(图2(B))。此外,不同分期和分级的患者中NAP1L1基因组拷贝数变异CNV)的频率分布表明,在早期HCC中NAP1L1 CNV频率较高(图2(C)、图2(D)) (P < 0.05)。
 (A) OncoPrint概述了基于TCGA数据库的HCC中NAP1L1的基因组改变。(B) 不同NAP1L1 CNV组中的NAP1L1表达。(C) 在不同分期亚组中NAP1L1 CNV的频率分布。(D) 在不同分级亚组中NAP1L1 CNV的频率分布。
(A) OncoPrint概述了基于TCGA数据库的HCC中NAP1L1的基因组改变。(B) 不同NAP1L1 CNV组中的NAP1L1表达。(C) 在不同分期亚组中NAP1L1 CNV的频率分布。(D) 在不同分级亚组中NAP1L1 CNV的频率分布。
Figure 2. Genomic alterations of NAP1L1 in HCC
图2. HCC中NAP1L1的基因组改变
3.3. NAP1L1表达与癌症患者预后的关系
我们利用Kaplan-Meier数据库探索了NAP1L1的表达与肝癌患者预后之间的联系,结果表明NAP1L1高表达与RFS、PFS、OS和DSS显著相关(图2),发现NAP1L1高表达组患者OS、RFS、PFS和DSS显著低于低表达组(P < 0.05),表明NAP1L1表达水平升高与肝癌患者较差的生存预后显著相关(图3)。由于我们发现NAP1L1表达与肝癌患者预后不良有关,望通过探索其潜在机制来评估不同临床病理因素对肝癌NAP1L1基因表达及临床预后的影响(表1)。我们发现NAP1L1的高表达提示OS较差(P < 0.05),但AJCC-T分期为II期[HR = 1.86 (0.88~3.94), P = 0.1003]、微血管侵犯[HR = 1.95 (0.87~4.38), P = 0.1006]、种族为白种[HR = 1.29 (0.79~2.12), P = 0.3044]和接受过索拉非尼治疗[HR=2.34 (0.7~7.81), P =0.154]的患者者除外。并且NAP1L1的高表达与早期、亚裔、经索拉非尼治疗过和有肝炎史患者的PFS呈负相关(P < 0.05)。这些结果表明NAP1L1的表达与HCC患者的临床病理特征和生存预后具有密切关系。

Figure 3. Correlation between NAP1L1 expression and prognosis of patients with HCC in Kaplan-Meier database
图3. Kaplan-Meier数据库中NAP1L1的表达与肝癌患者预后的相关性

Table 1. Impacts of different clinicopathological factors on NAP1L1 gene expression and clinical prognosis in HCC
表1. 不同临床病理因素对肝癌NAP1L1基因表达及临床预后的影响
3.4. NAP1L1相关基因的PPI网络构建及功能富集分析
我们利用STRING数据库构建了以NAP1L1为中心的PPI网络,得到了与NAP1L1显著相关的10个基因为ESPL1、PLK1、FZR1、CDC20、ANAPC2、AURKB、AURKA、CDK1、UBE2C、ANAPC11 (图4(A)),这些基因的互相作用得分均大于0.4。并通过利用GEPIA数据库分析得到在HCC中与NAP1L1共表达的基因(TOP 100),将这些基因通过DAVID数据库进行功能和通路富集分析(GO和KEGG),得到的数据由微生信网络在线平台和GraphPad Prism 6软件进行可视化分析。KEGG信号通路富集分析主要参与剪接体和核糖体生物过程、核细胞质运输、真核生物中的核糖体生物生成以及病毒感染的进程(图4(B))。GO分析表明与NAP1L1共表达的基因在生物学过程(BP)中主要涉及转录起始、mRNA剪接,剪接体生物过程、翻译、RNA从细胞核输出的正向调节、病毒转录、DNA复制、蛋白苏木酰化和tRNA从细胞核中输出等过程的调控(图4(C)),细胞成分(CC)主要位于核质体、核糖核蛋白复合物、细胞膜、核小体、细胞质、大分子复合体、剪接体复合体和核包膜等(图4(D)),分子功能(MF)主要是促进分子结合和调节翻译起始因子活性(图4(E))。
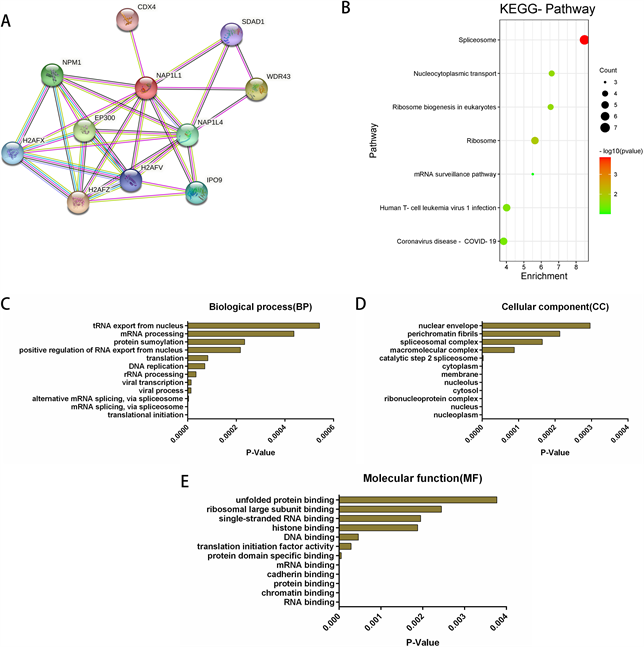 (A) STRING数据库中,与NAP1L1基因相关的蛋白质–蛋白质相互作用网络。(B) GEPIA与DAVID数据库来进行KEGG富集分析。(C)~(E) GEPIA、DAVID数据库进行了GO功能富集分析。
(A) STRING数据库中,与NAP1L1基因相关的蛋白质–蛋白质相互作用网络。(B) GEPIA与DAVID数据库来进行KEGG富集分析。(C)~(E) GEPIA、DAVID数据库进行了GO功能富集分析。
Figure 4. PPI network construction and functional and pathway enrichment analysis of NAP1L1-related genes
图4. NAP1L1相关基因的PPI网络构建及功能和通路富集分析
3.5. NAP1L1表达与肝癌免疫细胞浸润相关
在癌症患者中,存活率可由淋巴细胞浸润到肿瘤中的频率来预测,因此,用TIMER数据库探讨了 NAP1L1表达与肝癌中免疫细胞浸润程度之间的关系,发现肝细胞癌(LIHC)中NAP1L1表达水平与巨噬细胞、B细胞、树突状细胞、CD8+T细胞、中性粒细胞和CD4+T细胞的浸润程度呈正相关(P < 0.05) (图5(A)),且与肝癌患者存活率呈显著负相关(P > 0.05) (图5(B)),这表明NAP1L1在肝癌中对免疫细胞浸润具有很强的调节作用,并通过某种机制导致患者不良的预后。
 (A) TIMER数据库中NAP1L1表达水平与肝细胞癌(LIHC)免疫细胞浸润水平的相关性。(B) TIMER数据库中NAP1L1表达和免疫细胞浸润与肝癌预后的相关性。
(A) TIMER数据库中NAP1L1表达水平与肝细胞癌(LIHC)免疫细胞浸润水平的相关性。(B) TIMER数据库中NAP1L1表达和免疫细胞浸润与肝癌预后的相关性。
Figure 5. Correlation between NAP1L1 expression and immune cell infiltration in hepatocellular carcinoma
图5. NAP1L1表达与肝癌免疫细胞浸润相关
3.6. NAP1L1与免疫标志物表达相关性评估
接下来,我们使用TIMER 2.0数据库,基于泛癌中的免疫标志物,进一步探索了NAP1L1表达与免疫细胞浸润水平和免疫状态之间的相关性,发现不同类型肿瘤组织间具有明显的差异(图6)。为了进一步确定NAP1L1对LIHC的影响,我们使用GEPIA 2.0数据库分析NAP1L1与HCC中免疫细胞标志物之间的关系,我们发现NAP1L1表达水平与LIHC中各免疫细胞(除NK细胞)浸润程度成正相关(P < 0.05),与免疫耗竭分子PD-1、TOX、TIGIT、TIM-3、LAG-3和CTLA4的表达水平成正相关(P < 0.05) (表2)。这表明NAP1L1与免疫细胞浸润和免疫耗竭密切相关,NAP1L1可能通过某种方式上调免疫细胞中TOX的表达,从而在肝癌的免疫逃逸中发挥作用,因此需要进一步的工作来证实这种逃逸的机制。

Table 2. Correlation analysis of NAP1L1 expression levels and immunomarkers in hepatocellular carcinoma
表2. 肝癌中NAP1L1表达水平与免疫标志物的相关性分析
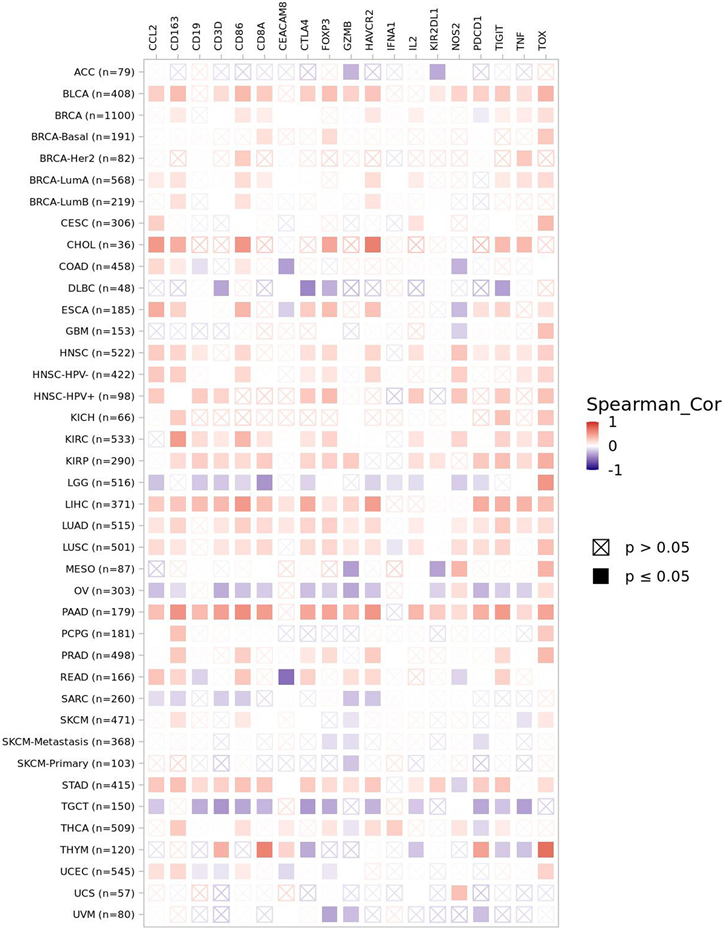
Figure 6. Correlation analysis of NAP1L1 expression and immunomarkers in pan-cancer
图6. 泛癌中NAP1L1的表达与免疫标志物的相关性分析
4. 讨论
据报道,在全球恶性肿瘤中,原发性肝癌发病率排第六位,并且是全球与癌症相关死亡的第四大原因,而肝细胞癌(HCC)占原发性肝癌的绝大部分(75%~85%) [18]。尽管尽早发现和治疗可以改善患者的健康状况,但是肝细胞癌(HCC)侵袭性强,生长快速且发作隐匿,早期无法及时诊断,大多数患者被确诊时已为晚期,大大降低了临床治疗疗效及预后,因此,探索HCC的发病机制并确定潜在的治疗靶分子具有重要意义。
在本研究中,通过使用GEPIA2.0数据库的分析,我们发现NAP1L1表达水平在HCC中过表达。为了验证其研究结果,用UALCA、TIMER以及HPA数据库评估了NAP1L1在肝癌和正常组织中的表达,相对于正常组织而言,HCC组织中NAP1L1的表达在不同临床肿瘤阶段也存在差异,且与肿瘤恶性程度呈显著正相关。Kaplan-Meier数据库的分析显示NAP1L1表达与患者预后之间存在显着的负相关。用cBioPortal数据库分析来自HCC患者的DNA测序数据,发现NAP1L1表达水平较高(基因突变)的患者预后更差。这些结果表明NAP1L1可能参与肿瘤的发生和发展,可能是HCC早期诊断的生物标志物。为了确定NAP1L1表达的调节因子,利用STIRNG数据库构建了以NAP1L1为中心的共表达网络(PPI网络),得到了与NAP1L1显著相关的基因。为进一步探究NAP1L1的功能机制,利用GEPIA、DAVID对其共表达基因进行了功能和通路富集分析,GO和KEGG分析结果表明与NAP1L1共表达的基因主要参与核细胞质运输、病毒感染、转录和翻译、剪接体以及核糖体的生物过程、分子结合、调节翻译起始因子活性等过程,可能促进了HCC的进展。TIMER 2.0和GEPIA2.0数据库分析中,我们发现NAP1L1广泛参与肿瘤免疫侵袭。在本研究中,我们探索到NAP1L1的mRNA表达与各免疫细胞浸润程度和免疫耗竭密切相关,这表明NAP1L1可能通过免疫细胞浸润和免疫耗竭参与HCC的发展。
本研究通过使用生物信息学分析证明了NAP1L1在HCC中的和生物学功能表达,并且表明了NAP1L1在HCC中过表达与HCC患者的预后呈显著负相关,表明NAP1L1是HCC的潜在生物标志物。此外,我们的结果还表明NAP1L1在调节免疫细胞浸润和免疫耗竭中的潜在作用。然而,这些研究发现均基于在线公共数据库分析获得,因此还需要通过大规模的临床和动物实验对其分子机制加以验证。