1. 引言
结直肠癌(colorectal cancer, CRC)是胃肠道中常见的恶性肿瘤。据2020年全球癌症统计显示 [1],结直肠癌新增病例超过193万例,与结直肠癌相关的死亡病例超过93万例,成为了仅次于肺癌的第二大杀手。目前临床上治疗结直肠癌的手段有多种,其中,外科治疗仍是迄今为止首选的根治性治疗方法。
外科治疗结直肠癌的主要流程包括肠组织癌变部位的切除和剩余肠组织的吻合。而局部组织的切除会引起短肠综合征 [2],影响肠道组织的消化、吸收功能。在切除肠组织后,选择合适的吻合方式对于肠道重建十分重要,如果吻合方式不合适,则会引起局部水肿、缺血,导致吻合口漏、吻合口狭窄等并发症。目前主流的吻合方式主要分为两大类,一种是以针线缝合 [3]、吻合器吻合 [4] [5] 和加压吻合为主的传统方式吻合;另一种是以能量方式吻合。其中,针线缝合的技术比较成熟,效果好、成本较低,但是它对操作者的要求较高,手术时间较长 [6];吻合器吻合操作简单,吻合速度快,但是吻合器的使用成本较高,而且这些吻合方式会引起一定程度的术后并发症 [7],影响其功能恢复。加压吻合的吻合环需要留在人体内一段时间才能排出体外,而且吻合环加工复杂,价格昂贵,不适用于大多数患者。近年来,随着医疗技术的发展,能量吻合的方式逐渐用于组织吻合,如超声能量吻合、激光能量吻合 [8] [9] [10] [11] 以及射频能量吻合 [12] [13] [14]。其中,射频能量吻合集切割、止血、吻合于一体,且不在吻合区残留异物,使得组织的吻合时间大大缩短,减少麻醉时间,降低手术感染的风险,有利于术后的恢复,但现有的射频能量吻合电极在吻合时存在吻合区域温度过高、非吻合区域热损伤大等问题。
为了提高吻合口质量,降低吻合区域附近组织的热损伤,本文设计了一种自冷却外翻式射频肠吻合电极,利用有限元仿真软件COMSOL Multiphysics,分析不同生理盐水流速对吻合区域温度场的影响规律,并与非自冷却电极吻合过程中组织温度的变化进行了对比。最后通过实验验证所设计的自冷却外翻式射频肠吻合电极的有效性,从而为射频能量吻合技术在临床上进一步推广应用奠定基础。
2. 材料与方法
2.1. 几何模型
2.1.1. 自冷却外翻式射频肠吻合电极
本文设计的自冷却外翻式射频肠吻合电极三维模型如图1所示,由绝缘壳、铜电极和绝缘栅等组成。在吻合小肠时,将两段待吻合的小肠分别翻到上下电极的绝缘栅上适当位置,使肠组织能够完全包裹住绝缘栅。生理盐水通过上下绝缘壳的进水口用蠕动泵注入,从出水口流出。将上下电极安装在压力装置上,并对其施加一定的机械压力,最后通射频电流将两段肠组织吻合到一起。
2.1.2. 自冷却吻合后的肠组织
由于肠组织中无较大的血管,因此在建模时对肠组织进行了简化,所建立的肠组织模型如图2所示,图中突起为绝缘栅格网的压痕,模拟吻合完成后的形状。
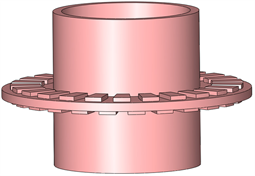
Figure 2. 3D model of self-cooling anastomotic tissue
图2. 自冷却吻合肠组织三维模型
2.1.3. 非自冷却电极
传统的吻合电极均为非自冷却结构,如图3所示,包括绝缘壳、铜电极和肠组织。
2.2. 射频能量吻合过程温度场仿真
2.2.1. 物理模型控制方程
对于生物热传导过程,本文基于Pennies传热模型描述生物组织中的传热过程 [15]:
(1)
式中,
是时间缩放系数;ρ是组织密度(kg/m3);C是组织的比热(J/(kg·K));k是热导率(W/(m·K))。在等式的右侧,ρb为血液密度(kg/m3);Cb是血液的比热(J/( kg·K));ωb是其灌注速率(1/s);Tb是动脉血温度(K);Qmet是新陈代谢的热源(W/m3);Qext是血管闭合系统产生的热(W/m3)。
由于本文是对离体肠组织温度场的变化进行热仿真,因此忽略血液灌注和代谢热等,Pennies传热方程可简化为:
(2)
射频焊接温度场仿真分析还需用到“电流”接口的控制方程,其表达式为:
(3)
式中,V是电势(V),σ是电导率(S/m),Je是外部产生的电流密度(A/m2),Qj是电流源(A/m3)。
对于本文的温度场分析,式(3)中Je和Qj均为零,因此控制方程可简化为:
(4)
“电流”接口的边界条件为:
V = 0负电极
V = V0正电极
其他边界。
2.2.2. 仿真模型
为了提高有限元仿真模型的计算效率,缩短计算时间,需要对模型进行简化,自冷却和非自冷却电极都为环状电极,根据其工作原理,把两种电极简化为如图4所示。
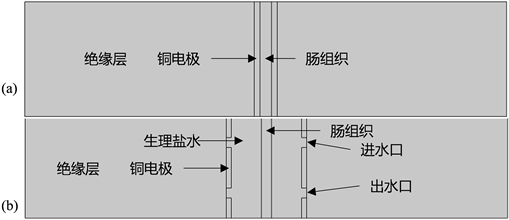
Figure 4. Simplification model of electrode. (a) Non self-cooling electrode; (b) Self-cooling electrode
图4. 电极简化模型。(a) 非自冷却电极;(b) 自冷却电极
2.2.3. 材料参数及边界条件
本文基于COMSOL Multiphysics软件开展有限元仿真分析,模型中各部分的材料属性如表1所示。赵灵犀等 [16] 研究表明,离体肠组织的电导率、导热系数及恒压热容等参数会随着温度的变化而变化,具体如表2所示。

Table 2. Material parameters of intestinal tissue
表2. 肠组织材料参数
注:T为实时温度(℃);T0为人体初始温度,37℃。
网格划分时,对模型进行三面体网格划分,如图5所示。非自冷却电极的网格包括13,078个单元、546个边界单元以及12个顶点单元,自冷却电极的网格包括14,032个单元、604个边界单元以及32个顶点单元。

Figure 5. Mesh of electrode. (a) Non self-cooling electrode; (b) Self-cooling electrode
图5. 电极网格划分。(a) 非自冷却电极;(b) 自冷却电极
仿真分析的载荷条件为:在电极上施加射频交流电,电压值根据示波器采样赋予,如图6所示。仿真分析的边界条件为:设定绝缘外壳、电极和生理盐水的初始温度为20℃。为分析生理盐水不同流速对冷却效果的影响,设定了3种流速,分别为0.001 m/s、0.01 m/s、0.1 m/s。
2.3. 吻合焊接实验
用3D打印技术打印两种电极,并完成装配。用0.9%的生理盐水将肠组织清洗干净备用。实验时,将肠组织按要求放置到电极中,参考赵灵犀 [17] 的吻合实验对电极施加154 kPa压合压强,利用LigaSure (Valleylab, USA)平台对肠组织进行吻合,吻合时间13.2 s。在自冷却电极吻合实验时,对电极通生理盐水。
2.4. 吻合口温度检测
将温度检测装置(PicoLogTC-08)的探头放置在两段待吻合的肠组织中间,记录吻合时的温度。
2.5. 吻合口强度测试
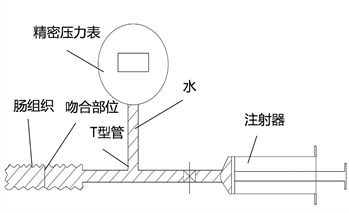
吻合口强度测试系统如图7所示。测试时将小肠一端用止血钳封闭,另一端与T型管的一端压紧,用注射器从T型管的另一端平稳缓慢注水,观察并记录吻合部位破裂时压力表的读数。
 (a)
(a) 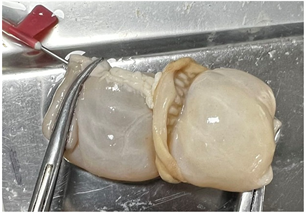 (b)
(b)
Figure 7. Anastomotic strength test. (a) Schematic diagram; (b) Physical diagram
图7. 吻合口强度测试。(a) 原理图;(b) 实物图
3. 结果
3.1. 有限元仿真
自冷却电极及非自冷却电极的温度场仿真分析结果分别如图8和图9所示。从图中可以看出,对于自冷却电极,当生理盐水的流速为0.001 m/s时,吻合中心的最高温度为138.72℃,生理盐水的(温度)颜色变化大;当生理盐水的流速为0.01 m/s时,吻合中心的最高温度为114.79℃;当生理盐水的流速为0.1 m/s时,吻合中心的最高温度为99.63℃。对于非自冷却电极,吻合中心的最高温度为161.91℃。吻合过程中吻合口中心温度随时间的变化曲线如图10所示,从图中可以看出,自冷却电极能够很好地减少吻合热量的聚集,使得组织的最高温度降低。当生理盐水的流速为0.01 m/s时,组织温度升高趋势减慢,生理盐水的温度上升不大;当生理盐水流速为0.1 m/s时,组织温度变化趋势保持平稳状态,生理盐水的温度基本不变,由此可以推断,生理盐水的冷却值已经达到了最大,即使再加大生理盐水的流速,对组织的冷却效果也不会有明显提升。因此,自冷却电极在如图6所示的电压载荷下,生理盐水的流速取0.1 m/s时,吻合温度适中,对组织的损伤较小,可达到最佳的吻合效果。
3.2. 吻合口温度
实验温度对比如图11所示,对于自冷却电极,吻合过程中吻合口的最高温度为107.72℃;对于非自冷却电极,吻合口的最高温度为160.93℃,二者相差53.21℃。
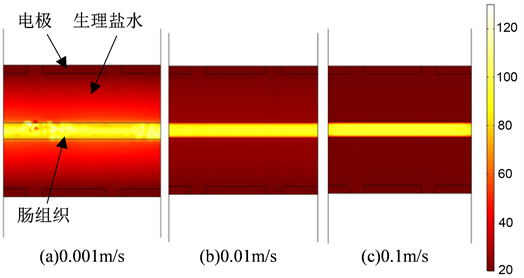
Figure 8. Temperature simulation of self-cooling electrode at different flow rates
图8. 自冷却电极不同流速下的温度仿真
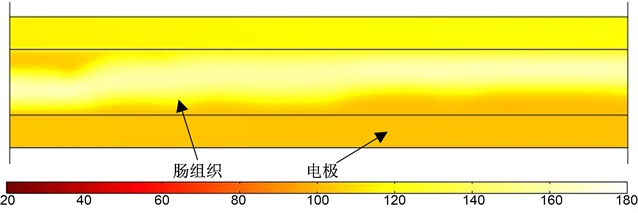
Figure 9. Temperature simulation of non self-cooling electrode
图9. 非自冷却电极温度仿真

Figure 10. Temperature versus time relationship during anastomosis
图10. 吻合过程中温度随时间的变化曲线
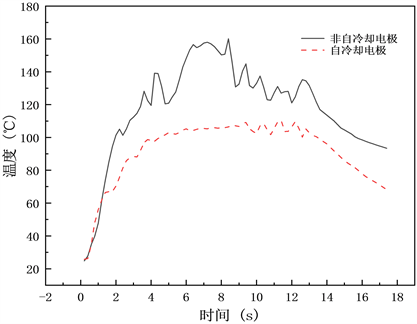
Figure 11. Comparison of experimental temperatures
图11. 实验温度对比
3.3. 吻合口强度
从吻合温度上来看,相同条件下,自冷却电极在吻合组织时,吻合区温度相对较低,对组织的热损伤更小,如果自冷却电极的吻合口强度能满足临床吻合口强度,那么就能证明自冷却电极比非自冷却电极在吻合肠组织时有优势,因此取自冷却电极吻合后的肠组织进行爆破压测试,测得最高爆破压为47.15 mmHg,最低爆破压为38.33 mmHg,平均爆破压为42.28 mmHg。
4. 讨论
通过有限元仿真分析及实验结果可知,在射频电源以及适当的机械压力下,利用自冷却电极能够将离断的小肠组织吻合到一起。仿真分析结果表明,在相同的功率、相同的吻合时间以及相同的压合压强下,与非自冷却电极相比,自冷却电极吻合肠组织时吻合区的温度更低,从而对吻合口区域附近组织造成的热损伤更小,同时该结果还表明,自冷却电极能够在较高的吻合功率和较短的吻合时间内,把肠组织吻合到一起,比非自冷却电极吻合的时间短,进而缩短了手术时间和麻醉时间,减少了对患者的损伤。此外,自冷却电极在吻合过程中,流动的生理盐水能够带走一部分热量,减少了热量的累积,且生理盐水的沸点与水接近,能够在一定程度上防止肠组织的温度过高。
周华彬 [18] 等人的研究表明,正常人体的回肠基础压力为6.9 mmHg,其最高峰值不超过15.4 mmHg。本文利用自冷却电极吻合肠组织后的平均爆破压为42.28 mmHg,大于正常人回肠峰值压力,表明利用自冷却电极能够较好地把离体的猪小肠吻合在一起,并且吻合强度达到临床需求。
5. 结论
通过对自冷却电极和非自冷却电极的有限元仿真分析及吻合实验,验证了本文所设计的自冷却电极的可行性和优势。自冷却电极吻合区域的温度比非自冷却电极的要低,对周围组织产生的热损伤也会小。自冷却电极在吻合时,生理盐水在导电的同时也把吻合产生的热量带走了一部分,减少了吻合过程中热量的累积和热扩散,从而降低了吻合区域附近肠组织的热损伤。经过对吻合后肠组织的爆破压进行测试,自冷却电极吻合后肠组织的爆破压能够满足临床需求(大于15.4 mmHg)。使用自冷却电极吻合肠组织能够缩短吻合时间,降低了患者的手术时间以及麻醉时间,减小了伤口暴露的时间,有助于患者的术后恢复。
基金项目
上海市科技创新行动计划资助项目(22S31902200);上海市普陀区特色专科项目(2019tszk01)。
NOTES
*通讯作者。