1. 引言
肺癌的发病率和死亡率均位于恶性肿瘤的首位,最常见的肺癌类型是腺癌,约占所有肺癌病例的40%,具有较强侵袭性和快速致命的特点,且总生存期小于5年 [1]。化疗不仅花费较高,长时间的化疗对患者的身心健康也会产生很大的影响。肺腺癌术后存在复发转移的风险,尚未得出统一的结论 [2]。
中医学认为肿瘤乃是正气虚弱,脏腑功能失调,进而气血郁滞,变生瘢瘦所致,故正气强弱对于维持机体健康具有重要的作用。目前现代医学和中医学就人体自身免疫力(正气)对肿瘤治疗的重要性认识趋向一致,中西医联合治疗发挥干预增效作用在肿瘤治疗中的研究受到广泛关注和重视。本研究所采用的扶正抑瘤汤为甘肃老中医赵建雄教授所研制的配方,由红芪、当归、莪术、墓头回等中药按照一定的配比组合而成 [3] [4]。
网络药理学是基于生物学和计算机融合,对药物–疾病–靶点进行可视化分析,揭示药物与疾病作用关系的机制的新学科。更好的研究中药与疾病间相互作用,更加清晰的显示多种因素之间的对应关系及相互作用,提供了新的研究方法。本研究是基于网络药理学方法及分子对接,对扶正抑瘤汤治疗肺腺癌的机制进行探讨和研究。
2. 材料和方法
2.1. 扶正抑瘤汤化合物及靶点预测
通过TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)分别对扶正抑瘤汤中的中药“红芪”、“当归”、“墓头回”、“莪术”进行ADME检索,按照生物利用度(OB) ≥ 30%,类药性(DL) ≥ 0.18筛选出符合要求的药物活性成分及其相对应的靶点。
2.2. 肺腺癌的疾病靶点基因收集
通过GeneCards数据库(https://www.genecards.org/),以“lung adenocarcinoma”检索肺腺癌的疾病相关靶点,获取其相应基因。
2.3. 绘制Venny图并获取药物与疾病交集基因
利用Venny图(https://bioinfogp.cnb.csic.es/tools/venny/),导入药物有效成分靶点和疾病基因,获取交集基因,绘制Venny图。
2.4. 构建交集基因蛋白互作图(PPI)
通过STRING数据库网站(https://string-db.org/),将1.3中所获得的交集基因导入STRING数据库平台,限定物种为人类,调整最小要求交互分数为中等可信度0.400,将筛选出的蛋白数据导入到Cytoscape3.8.0,利用插件CytoHubba,设置筛选节点(node)为权重(degree),得到蛋白Top10,生成蛋白互作网络图并获得相关参数。
2.5. 进行GO分析和KEGG分析
在R软件中安装DOSE、clusterProfiler、enrichplot、pathview的程序包,完成GO富集分析和KEGG富集分析,富集分析可得到分子功能(MF)、生物过程(BP)和细胞组成(CC)的气泡图,KEGG可得到气泡图、通路分析图。
2.6. 获取扶正抑瘤汤中药物活性度最高的有效成分
将1.1扶正抑瘤汤中药物的有效成分及其相对应的靶点以及1.4中所获得的交集蛋白基因,导入到Cytoscape 3.8.0中,利用插件CytoHubba,得到作用效果最强的药物成分。
2.7. 构建成分–靶点–疾病–通路网络
将1.1中整理的扶正抑瘤汤中药物成分及其对应的靶点基因,1.2中获得的疾病名称及其相关基因,1.3中获得交集基因,1.5中获得的KEGG通路,导入到Cytoscape3.8.0,构建成分–靶点–疾病–通路网络图。
2.8. 核心靶点与关键化合物分子对接
在PubChem数据库(https://www.rcsb.org/)中查找核心靶点所对应化合物结构并下载。在PDB数据库(https://www.rcsb.org/)中查找并下载靶点结构。用Chem3D软件对蛋白结构按最低的结合能进行优化,用PyMol对受体结构进行去水分子,去残基的处理。通过AutoDockTools对处理过的受体进行加氢处理,运用AutoDock Vina软件进行分子对接,最后通过PyMol对对接结果进行可视化。
3. 结果
3.1. 扶正抑瘤汤化合物及靶点预测
在TCMSP数据库中获得符合筛选要求的有效成分20个,对应靶点550个,其中红芪有效成分14个,对应靶点和基因346个;当归有效成分2个,对应靶点和基因52个;墓头回有效成分1个,对应靶点和基因136个;莪术有效成分3个,对应基因和靶点16个,将靶点合并去除重复基因后,共得到有效成分17个,基因194个。扶正抑瘤汤有效成分,见表1。

Table 1. Active ingredients of Compound Fu Zheng Yi Liu Tang
表1. 扶正抑瘤汤有效成分
3.2. 肺腺癌的疾病靶点基因收集
通过GeneCards数据库检索“lung adenocarcinoma”得到疾病基因共计8639个。
3.3. 绘制Venny图并获取药物与疾病交集基因
利用Venny图绘图网站绘制Venny图,共获得扶正抑瘤汤与肺腺癌交集基因共175个,分别为NOS2、PTGS1、CHRM3、ESR1、PTGS2、JUN、CASP3、CASP8、PRKCA、PON1等。见图1。
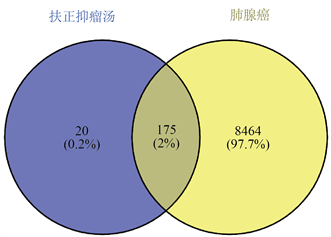
Figure 1. Venny diagram of the intersection target of Fu Zheng Yi Liu Tang and lung adenocarcinoma
图1. 扶正抑瘤汤与肺腺癌交集靶点的Venny图
3.4. 交集基因的蛋白互作图(PPI)
通过STRING数据库,获取交集基因相关参数,导入到Cytoscape3.8.0,利用插件CytoHubba,得到10个最重要的蛋白,分别为AKT1 (蛋白激酶)、IL-6 (白细胞介素-6)、MAPK3 (丝裂原活化蛋白激酶)、VEGFA (血管内皮生长因子)、JUN、CASP3、MYC (MYC原癌基因)、EGF (表皮细胞生长因子)、PTGS2 (环加氧酶2)、EGFR (表皮生长因子受体),颜色由深到浅代表degree分数由高到低,degree分数越高表示中心度值越高,见图2。推测这些靶点可能在扶正抑瘤汤中治疗肺腺癌中发挥重要作用。
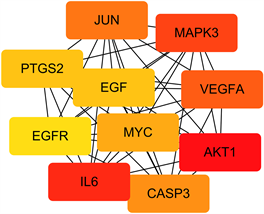
Figure 2. Top ten protein interaction relationships of intersection genes
图2. 交集基因蛋白交互关系前十位
3.5. GO和KEGG富集分析结果
通过R语言完成GO富集分析和KEGG富集分析,分子功能(MF)富集结果(见图3)主要集中在DNA-结合转录激活因子活性,RNA聚合酶II-特异性(DNA-binding transcription activator activity, RNA polymerase II-specific)、受体配体的活性(receptor ligand activity)、细胞因子受体结合(cytokine receptor binding)、

Figure 3. Molecular functional bubble plots for GO functional enrichment analysis
图3. GO功能富集分析分子功能气泡图
细胞因子活性(cytokine activity)、酰胺结合(amide binding)等条目。生物过程(BP)的富集结果(见图4)主要集中在对脂多糖的反应(response to lipopolysaccharide)、对细菌来源的分子的反应(response to molecule of bacterial origin)、对类固醇激素的反应(response to steroid hormone)、对营养水平的反应(response to nutrient levels)、对氧化应激的反应(response to oxidative stress)等条目。细胞组成(CC)富集结果(见图5)主要集中在膜筏板(membrane raft)、膜微区(membrane microdomain)、膜区域(membrane region)、转录因子复合物(transcription factor complex)、囊泡管腔(vesicle lumen)、核染色质(nuclear chromatin)等条目。

Figure 4. Biological process bubble plots for GO functional enrichment analysis
图4. GO功能富集分析生物过程气泡图

Figure 5. Cell composition bubble plots for GO functional enrichment analysis
图5. GO功能富集分析细胞组成气泡图
KEGG通路富集分析主要富集在血脂和动脉粥样硬化(Lipid and atherosclerosis)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、乙肝病毒感染者(Hepatitis B)、卡波西肉瘤相关的疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、人类巨细胞病毒感染(Human cytomegalovirus infection)、液体剪切应力和动脉粥样硬化(Fluid shear stress and atherosclerosis)等条目,见图6。因此推断,扶正抑瘤汤治疗肺腺癌的机制可能与上述的信号通路有着密切的联系。

Figure 6. KEGG pathway enrichment analysis
图6. KEGG通路富集分析
3.6. 获取扶正抑瘤汤中药物活性度的有效成分的排列顺序
将1.4中得到的交集基因蛋白数据导入到Cytoscape 3.8.0,利用插件CytoHubba,得到药物成分与疾病基因的作用关系图,颜色越深表示degree数值越高,中心度值越高。药物活性度的有效成分排列顺序为槲皮素(MOL000098)、柚皮素(MOL004328)、β-谷甾醇(MOL000358)、刺芒柄花素(MOL000392)、维斯体素(MOL000500)等。推测这些药物成分在扶正抑瘤汤治疗肺腺癌中发挥重要作用,见图7。
3.7. 构建成分–靶点–疾病–通路网络
将数据整理成Excel表格,交集基因保存为txt文本文档格式,把两个文件导入到cytoscape3.8.0中,得到成分–靶点–疾病–通路网络图,见下图8。红色代表肺腺癌,紫色代表药物,浅粉色代表药物的主要成分,蓝色代表交集基因,粉色为KEGG,绿色为KEGG通路名称,图中共涉及节点216个,涉及边2161条,网络平均连接度(Avg. number of neighbors)为9.018,网络直径(Network diameter)为2,特征路长(Characteristic path length)为1.366。

Figure 7. Action of drug active components and disease genes
图7. 药物成分与疾病基因的作用关系图

Figure 8. Component-target-disease-pathway network diagram
图8. 成分–靶点–疾病–通路网络图
3.8. 核心靶点与关键化合物分子对接结果
根据网络图筛选出排名前5位的药物有效成分与PPI网络中筛选出的排名前10位的核心靶点进行分子对接,通过Pymol软件对其对接结果进行可视化分析,普遍认为,配体与蛋白相结合时所需结合效能 < 0则说明两者可以自发结合,且两者亲和力越强,所需的结合效能越低。对接结果显示,药物有效成分与核心靶点的最低结合效能均低于−5.6 Kcal/mol,见表2,表明两者具有较好的结合活性。可视化分析处理结果见图9~11,显示出药物成分与核心靶点的相互作用关系以及结合位点,验证了扶正抑瘤方主要通过上述活性成分作用于对应的核心靶点发挥治疗肺腺癌的作用。

Table 2. Molecular docking binding activities of ten core targets and two key compounds
表2. 10个核心靶点与5个关键化合物的分子对接结合活性

Figure 9. Molecular docking protein of AKT1 and quercetin
图9. AKT1与槲皮素的分子对接蛋白图
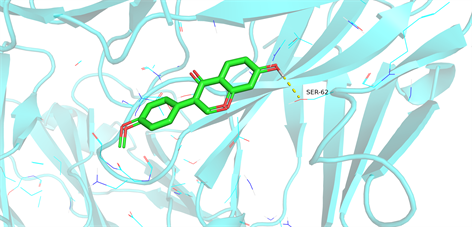
Figure 10. Molecular docking protein of IL6 and formononetin
图10. IL-6与刺芒柄花素的分子对接蛋白图
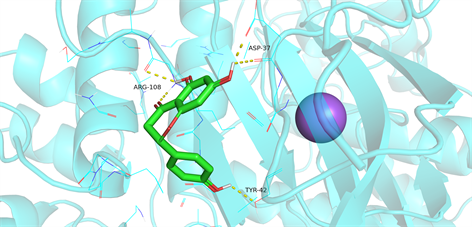
Figure 11. Molecular docking protein of MAKP3 and naringenin
图11. MAKP3与柚皮素的分子对接蛋白图
4. 讨论
本研究利用网络药理学及分子对接探讨扶正抑瘤汤治疗肺腺癌的分子机制。通过构建药物成分与疾病基因作用的网络关系图,发现药物活性度的有效成分排列的前三位分为槲皮素(MOL000098)、柚皮素(MOL004328)、beta-谷甾醇(MOL000358)。槲皮素是一种黄酮类化合物,槲皮素具有很好的抗肿瘤、抗氧化、抗炎等作用 [5] [6]。槲皮素还具有较强的促进细胞凋亡、调节细胞的周期活动、抑制其转移等作用,槲皮素可以通过调节凋亡蛋白(cleaved-PARP、Bax、Bcl-2)在A375SM黑色素瘤细胞中的表达来诱导细胞凋亡 [5] [6]。Yang等 [7] 证实,caspase-3在槲皮素诱导的肺癌细胞凋亡过程中起着重要的作用。顾超等实验研究表明 [8],槲皮素可特异性诱导人HeLa细胞凋亡,其诱导凋亡的机制可能与caspase-3、caspase-8活化有关。李林等实验研究表明,槲皮素浓度越高,细胞的凋亡率越高,槲皮素可能先通过激活Caspase-8,再激活Caspase-3来诱导细胞的凋亡 [9]。结合KEGG细胞凋亡通路图中,也可显示信号传导至Caspase-8,Caspase-8被激活后,再激活Caspase-3诱导细胞凋亡过程。叶艺旺等 [10] 研究显示,Caspase-8参与非小细胞肺癌的演变,与非小细胞肺癌的发生发展及转移有密切关系。经过欧颖璨的实验研究结果显示,经过槲皮素处理后的癌细胞,RIPK1和RIPK3蛋白表达量可以显著升高,槲皮素能诱导细胞的程序性坏死发生,RIPKI和RIPK3在柳皮素诱导的细胞程序性坏死中发挥明显的作用,槲皮素还能提高蛋白BAX的表达等作用 [11]。柚皮素是一种天然类黄酮,柚皮素的细胞毒性作用可诱导的凋亡过程可能是通过Bax激活的下摆立体途径在肺腺癌的A549细胞中发生着作用 [12]。β-谷甾醇是植物中一种主要的膳食甾醇,广泛存在于油脂、坚果和蔬菜植物中,β-谷甾醇能通过多通路、多靶点作用于生殖系统、神经系统、感染性疾病及肿瘤在内的等多种疾病 [13] [14]。交集基因的PPI图中所获得的最重要的10个蛋白,其中最重要的是AKT1 (蛋白激酶),AKT1、E17K在其内源性启动子的控制下,表达增强细胞生长和集落的形成,但是对于细胞的迁移和侵袭具有反常的抑制作用。激活的AKT1抑制细胞迁移和侵袭的机制基础是ZEB1抑制介导的E-钙黏着蛋白的表达增加,通过改变的β-catenin亚细胞定位进行转录,这种表型作用是AKT1所特异的,即E-钙粘蛋白表达降低 [15]。IL-6是一种功能广泛的多效性细胞因子。IL-6可以调节多种细胞的生长与分化,具有调节免疫应答、急性期反应及造血功能,并能在机体的抗感染免疫反应中起着很重要作用。由Islas Vazquez Lorenzo等研究所得的数据,与患者的中位总生存期(OS)相关,IL-6的升高幅度最大,可能是由于肺腺癌细胞产生IL-6所致 [16]。VEGFA (血管内皮生长因子)是一个重要的生长因子家族,参与调控血管生成和淋巴管生成有关的多种细胞过程 [17]。经李璟波等实验结果证实肺腺癌组织中VEGFR3的表达显著的高于正常的肺组织,VEGFR3的表达水平与肿瘤分化、分期及淋巴结转移成正相关,沉默的VEGFR3能够抑制细胞增殖、侵袭及迁移,并能够抑制VEGF-C对AKT信号通路激活的作用 [18]。MYC是较早被发现的一组癌基因,包括C-myc,N-myc,L-myc,分别定位于8号染色体,2号染色体和1号染色体。结构上由不编码蛋白质的第1外显子和编码蛋白质的第2、3外显子构成。C-myc原癌基因最先是从含有鸟骨髓瘤病毒MC29的转化基因(v-myc)的同源器官中发现,因为C-myc基因可以产生两种翻译产物C-Myc1和C-Myc2,因此它既可以诱导细胞的周期进程,又可以诱导细胞的程序性死亡,可能是通过C-myc与p21的失活比例完成的 [19] [20],有实验表明,不同类型的细胞或同组织细胞不同时期的C-mycc基因表达不同,C-myc在正常情况下所编码的蛋白能以生长因子的方式促进细胞的增殖,当C-myc基因表达失调时,可促进细胞的凋亡,但是当其表达失调时所诱导的细胞凋亡时,也能被bcl-2、v-raf、v-abl等基因所阻止,严格说C-myc本身不能直接导致细胞凋亡,可能是通过提高细胞对凋亡诱导剂的敏感性而发挥作用 [20]。EGFR是属于酪氨酸激酶型受体,EGFR可以与细胞外配体,例如表皮生长因子(EGF),结合形成二聚体,启动细胞内的信号转导,调节细胞的正常活动,通过细胞质内衔接蛋白和酶的级联反应来调节转录因子激活基因,影响细胞的增殖、分化、迁移、黏附以及凋亡过程 [21] [22]。伍锦凤 [23] 等研究显示EGFR突变率在非小细胞肺癌中占53.6%。庞诗晓 [24] 研究显示,晚期非小细胞肺癌对EGFR基因突变进行靶向治疗具有显著效果。GO和KEGG结果显示,扶正抑瘤汤通过多种生物过程以及信号通路参与治疗肺腺癌的过程。
本研究利用网络药理学,阐述了扶正抑瘤汤治疗肺腺癌的有效活性成分、关键基因和靶点、相互作用的机制。扶正抑瘤汤治疗肺腺癌体现了多成分、多靶点、多通路相互作用的特点。本研究不足之处在于搜索药物和疾病的数据库相对单一,可能会有遗漏,以后的研究目标是对数据库搜索更加广泛精准。部分核心靶点与关键化合物对接过程中未显示具体的对接位点,可能是分子对接准备过程中去氢、去水、去残基等操作,导致对接时未能显示对接位点。本研究未进行实验验证研究,需要进一步从实验的角度探索本结果。交集蛋白互作关系top10中,涉及的JUN、CASP3、MYC、PTGS2这4个基因与肺腺癌相互作用关系的研究相对缺乏,需进一步开展研究探索。
基金项目
国家自然科学基金(82160900);甘肃省卫健委卫生健康管理项目,编号:31340301;甘肃省重大疾病分子医学与中医药防治研究重点实验室新型冠状病毒防治研究专项,编号FZYX20-13;甘肃省高等学校产业支撑计划项目,编号:2020C-36。
NOTES
*通讯作者。