摘要: 目的:基于网络药理学方法探讨中药复方扶正抑瘤方治疗非小细胞肺癌(NSCLC)的作用原理。方法:用TCMSP数据库收集扶正抑瘤方中各中药里的化学成分,再从TCMSP数据库中检索各化学成分对应的靶标,收集以口服生物利用度(oral bioavailability, OB) ≥ 30%和类药性(Drug-likeness, DL) ≥ 0.18为标准筛选的活性成分及其预测靶标,导入CytoScape Version 3.8.2软件,绘制成分–靶标网络图,得到该方的效应靶标。以“非小细胞肺癌”为关键词,从GeneCards数据库查找疾病靶标,绘制韦恩图。将韦恩图中显示的药物化学成分与疾病的相同基因通过R x64 4.0.5软件转换出其对应的entrezID,进行GO富集分析和KEGG通路分析。再将相同基因导入String数据库进行蛋白–蛋白相互作用分析,获取蛋白相互作用信息后,导入CytoScape Version 3.8.2软件构建蛋白–蛋白相互作用网络。结果:共检索出14个小分子成分,5430个基因靶标,相同靶基因148个,其中度值排名较靠前的蛋白AKT1 (蛋白激酶1)、IL6 (白介素6)、VEGFA (血管内皮生长因子A)、MAPK3 (促分裂原活化蛋白激酶3)、JUN (JUN蛋白)、CASP3 (胱天蛋白酶3)、MYC (癌基因MYC)、EGF (表皮生长因子)、EGFR (表皮生长因子受体)、PTGS2 (人前列腺素内过氧化物合酶)、MAPK1 (丝裂原活化蛋白激酶1)、ESR1 (雌激素受体1)被认为是蛋白相互作用网络中的核心靶点;分析GO生物学过程、分子功能及细胞组分相关条目前20条及KEGG通路前20条,主要涉及癌症通路、MAPK3信号通路及肿瘤坏死因子信号通路、IL-17信号通路等。结论:扶正抑瘤方可能通过多成分、多靶点、多途径参与调控NSCLC细胞增殖与凋亡等多种生理过程,发挥对NSCLC的干预作用。
Abstract:
Objective: To explore the mechanism of Fuzheng Yiliu decoction in the treatment of non-small cell lung cancer (NSCLC) based on network pharmacology. Methods: The chemical constituents of fu-zheng antitumor prescription were collected by TCMSP database, and the corresponding targets of chemical constituents were retrieved from TCMSP database. The active ingredients screened based on oral bioavailability (OB) ≥ 30% and drug-like (DL) ≥ 0.18 and their prediction targets are col-lected and imported into CytoScape Version 3.8.2 software. The composition-target network dia-gram is drawn, and the effector target of this square is obtained. Taking “non-small cell lung cancer” as the key word, the disease targets were searched from GeneCards database and a Wayne diagram was drawn. The drug chemical components shown in Wayne diagram and the same gene of the dis-ease were transformed into their corresponding entrezID by R x64 4.0.5 software, and GO enrich-ment analysis and KEGG pathway analysis were performed. Then the same genes were imported into String database for protein-protein interaction analysis. After obtaining the protein interaction information, the same genes were imported into CytoScape Version 3.8.2 software to construct the protein-protein interaction network. Results: A total of 14 small molecular components, 5430 gene targets and 148 identical target genes were retrieved. Among them, AKT1 (protein kinase 1), IL6 (interleukin 6), VEGFA (vascular endothelial growth factor A) and MAPK3 (mitogen-activated pro-tein kinase 3) ranked high in degree value ), JUN (JUN protein), CASP3 (cypsin 3), MYC (oncogene MYC), EGF (epidermal growth factor), EGFR (epidermal growth factor receptor), PTGS2 (human prostaglandin endoperoxide synthase), MAPK1 (mitogen-activated protein kinase 1), ESR1 (estro-gen receptor 1) are considered to be core targets in protein interaction networks; the biological process, molecular function and cell composition of GO were analyzed in 20 related strips and the first 20 KEGG pathways, mainly involving cancer pathway, MAPK3 signaling pathway, tumor necro-sis factor signaling pathway, IL-17 signaling pathway, etc. Conclusion: Fuzheng Yiliu decoction may regulate the proliferation and apoptosis of NSCLC cells through multiple components, multiple tar-gets and multiple pathways, and play an intervention role in NSCLC.
1. 引言
随着社会的发展和生活环境的改变,肺癌成了我国城市人口中居第一位的恶性肿瘤死亡原因 [1],其中非小细胞肺癌(Non-small cell lung cancer, NSCLC)大约占全部肺癌的80%,而75%的患者在确诊时已到中晚期 [2]。尽管靶向药物治疗为有特异基因或信号转导通路的NSCLC患者延长了生存期 [3],可大部分NSCLC患者的治疗效果不是很理想。有研究 [4] [5] 证实,中医药复方不仅可以延长肺癌患者的生存期,而且能减少化疗和靶向治疗的毒副反应。
本研究通过网络药理学方法,以扶正抑瘤方 [6] 中具有抑制肺癌活性的主要成分和疾病靶点为研究对象,通过构建“药物–成分–靶点–疾病”网络并进行生物信息学分析,对扶正抑瘤方治疗NSCLC的物质基础和潜在作用原理进行较为系统的分析、预测,以期为该方剂的进一步开发利用奠定基础。
2. 材料和方法
2.1. 扶正抑瘤方化学成分数据集的建立
利用TCMSP数据库收集扶正抑瘤方各味中药的小分子化学成分,建立该方的化学成分数据集。
2.2. 扶正抑瘤方成分–靶标网络图的构建
从TCMSP数据库搜索候选化学成分的靶标,收集以口服生物利用度(oral bioavailability, OB) ≥ 30%和类药性(Drug-likeness, DL) ≥ 0.18为标准筛选的活性成分及其预测的靶标,导入CytoScape Version 3.8.2软件,绘制成分–靶标网络图,得到该方的效应靶标,通过网络图直观展示活性成分与潜在作用靶标之间的关系。
2.3. 扶正抑瘤方作用靶标的预测
以“Non small cell lung cancer”为关键词,从GeneCards数据库(https://www.genecards.org/)查找NSCLC对应的基因,作为疾病靶标。取疾病靶标与扶正抗癌方中化学成分预测的靶标的交集,并绘制韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/),作为扶正抑瘤方治疗NSCLC的潜在作用靶标。
2.4. 扶正抑瘤方作用靶标的注释分析
将获取的潜在作用靶标导入R x64 4.0.5软件,进行基因本体(Gene Ontology, GO)注释分析和Kyoto encyclopedia of genes and genomes (KEGG)信号通路富集分析,设定阈值P < 0.05。GO分类富集分析结果包括分子功能(Molecular function, MF)、生物过程(Biological process, BP)和细胞组分(Cellular component, CC) 3部分,通过P值评估蛋白注释功能的显著性。富集的信号通路取排名前20位的通路进行分析和展示,并将结果导入R x64 4.0.5软件,绘制KEGG信号通路的气泡图。
2.5. 扶正抑瘤方作用靶标蛋白–蛋白相互作用网络 (Protein-Protein Interaction Network, PPI)的构建
将获取的潜在作用靶标导入String数据库(https://String-db.org/)进行PPI分析(设置物种为Homo sapiens)。利用CytoScape (Version 3.8.2)中的cytoHubba计算网络中各个节点的拓扑性质,选出网络中的度值(Degree)高的节点作为PPI网络中的关键靶标。
2.6. 扶正抑瘤方治疗有效成分的预测
将潜在靶点上传至R x64 4.0.5软件,进行KEGG富集分析,选取P < 0.05,排名在前20位的通路进行分析,筛选出可能与治疗NSCLC相关的通路,作为关键通路,提取成分–靶标网络图。计算其网络拓扑性质,度值(Degree)排前1O位的化学成分即为该方治疗NSCLC的潜在有效成分。
3. 结果
3.1. 扶正抑瘤方中的主要化学成分
共检索获得扶正抑瘤方4味中药中14个小分子成分,见图1。其中墓头回的主要化学成分只有1个,即槲皮素(quercetin),其对应的MolID为MOL000098;红芪的主要活性成分有美迪紫檀素((+)-Medicarpin)、3,7-二羟基-4-甲氧基异黄酮(3',7-dihydroxy-4'-methoxy-isoflavone)、戊酸二氟米松(DFV)、刺芒柄花素(formononetin)、毛蕊异黄酮(Calycosin)、柚皮素(naringenin)、甘草素((2R)-7-hydroxy-2-(4-hydroxyphenyl) chroman-4-one)、驴食草酚(Vestitol)、龙胆香甘(Gentiacaulein)、西托糖苷(daucosterol_qt)等10个小分子化学成分,其对应的MolID分别为MOL011076、MOL011078、MOL001792、MOL000392、MOL000417、MOL004328、MOL004941、MOL000500、MOL005575、MOL008173;当归的活性成分有β-谷菑醇(beta-sitosterol)、豆菑醇(Stigmasterol)等2个小分子化学成分,其对应的MolID为MOL000358、MOL000449;莪术的活性成分也只有1个,即常春藤皂苷元(hederagenin),其对应的MolID为MOL000296。

Figure 1. Network diagram of active chemical constituents of Fuzheng and tumor suppressant prescription
图1. 扶正抑瘤方药物–有效化学成分网络图
3.2. 扶正抑瘤方潜在作用靶点
将扶正抑瘤方中的各味中药、中药对应化学成分和预测得到的靶标,以及三者之间的关系导入 CytoScape 3.8.2软件,得到中药–成分–靶标网络图,见图2。该网络图中的节点包括14个小分子化学成分,550个预测的作用靶标。再从GeneCards数据库中检索NSCLC差异性表达的基因,共得到5236个疾病靶标,将其与由成分预测得到的550个中药作用靶标取交集,可以看到筛重后的药物成分的靶标194,而得到的交集靶标为148个,这148个共同靶标即为扶正抑瘤方治疗NSCLC的潜在靶标,见图3。

Figure 2. Composition-target network diagram of Fuzheng and tumor suppressor formula
图2. 扶正抑瘤方的成分–靶标网络图
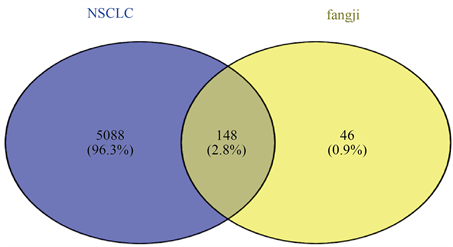
Figure 3. Venn diagram of potential therapeutic targets for non-small cell lung cancer
图3. 非小细胞肺癌潜在治疗靶标韦恩图
3.3. 扶正抑瘤方药物–靶标–基因–疾病网络图的构建与分析结果
将148个共同靶标以及相关联的候选成分输入CytoScape 3.8.2,绘制网络图,见图4。经进一步筛选后的成分–靶标网络图显示,扶正抑瘤方14个小分子化学成分可能作用于194个靶标。其中红芪可能作用于43个靶标,当归可能作用于13个靶标,莪术可能作用于3靶标,墓头回可能作用于135个靶标。度值(Degree)排名前7位的靶标(见图5)是AKT1 (蛋白激酶1)、IL6 (白介素6)、VEGFA (血管内皮生长因子A)、MAPK3 (促分裂原活化蛋白激酶3)、JUN (JUN蛋白)、CASP3 (胱天蛋白酶3)、MYC (癌基因MYC),分别与3、2、2、1、5、5和2个化学成分(同一靶标可对应不同化学成分)相关联。扶正抑瘤方通过其中的多种化学成分同时作用于这些主要靶标,发挥对NSCLC的治疗作用。结果体现了中药复方多成分、多靶点的作用特点。

Figure 4. Network diagram of the drug-target-disease of Fuzheng and tumor suppressor prescription
图4. 扶正抑瘤方药物–靶标–疾病网络图
 注:颜色越深,度值越高,代表作用于该靶标的化学成分越多,即该靶标越关键。
注:颜色越深,度值越高,代表作用于该靶标的化学成分越多,即该靶标越关键。
Figure 5. Protein-protein interaction (PPI) network of potential target of Fuzheng Suppressor decoction in the treatment of non-small cell lung cancer
图5. 扶正抑瘤方治疗非小细胞肺癌潜在靶标蛋白–蛋白相互作用(PPI)网络
3.4. 扶正抑瘤方治疗NSCLC信号通路的GO分类富集分析
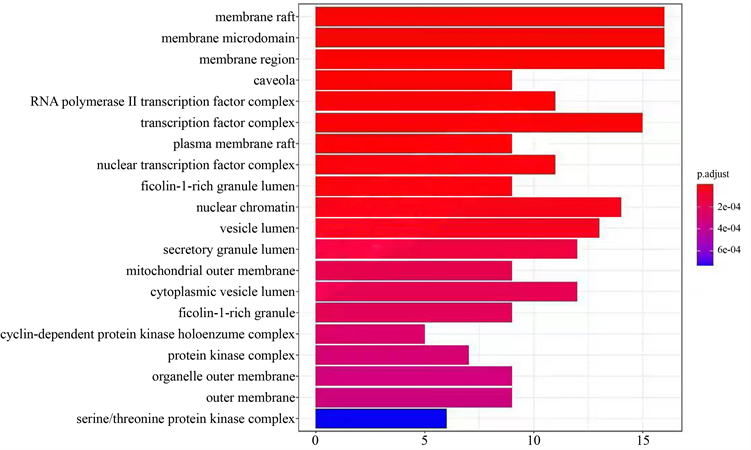
将蛋白–蛋白相互作用网络分析出的148个关键靶点上传至R x64 4.0.5软件进行GO富集分析。GO富集分析在关键蛋白模块功能中,分别取生物过程(Biological process)、细胞成分(Cellular component)和分子功能(Molecular function)前20个条目。生物过程主要涉及细胞对药物的反应、对营养水平的反应、对脂多糖的反应、对细菌来源分子的反应、对类固醇激素的反应等方面;细胞成分主要涉及细胞膜筏、膜区、转录因子复合物、核染色质等;分子功能主要涉及DNA结合转录激活活性,RNA聚合酶II的特异性、细胞因子受体的结合、受体配体活性、泛素样蛋白连接酶结合、磷酸酶结合等。GO分析结果显示,扶正抑瘤方成分在生物过程、细胞成分及分子功能与NSCLC的发生发展过程密切相关,见图6。

BP
 CC
CC MF
MF
Figure 6. GO enrichment analysis results
图6. GO富集分析结果
3.5. 扶正抑瘤方治疗NSCLC的KEGG通路富集分析
将扶正抑瘤方治疗NSCLC的148个潜在靶点导入R x64 4.0.5软件,绘制KEGG信号通路气泡图,见图7。结果显示,能参与调控NSCLC的信号通路有癌症通路、脂质与动脉粥样硬化、乙肝、丙肝、人巨细胞病毒感染、卡波西肉瘤相关疱疹病毒感染、糖尿病并发症的年龄-年龄信号通路、白介素17信号通路、肿瘤坏死因子信号通路、内分泌抵抗、低氧诱导因子1、流体剪切应力与动脉粥样硬化、查加斯病(美洲锥虫病)等。

Figure 7. Bubble diagram of KEGG pathway enrichment analysis
图7. KEGG通路富集分析气泡图
3.6. 扶正抑瘤方治疗NSCLC的关键蛋白模块及相互作用网络构建
将148个靶标蛋白输入String数据库,设置物种为Homo sapeins,其余使用默认参数,获取结果后导入CytoScape中构建PPI网络图,见图5。图中节点表示扶正抑瘤方的作用靶点,边表示蛋白之间的作用关系,节点的度值越高,表示该靶点在相互作用网络中越重要,可能起关键的作用。在此网络中,AKT1 (蛋白激酶1)、IL6 (白介素6)、VEGFA (血管内皮生长因子A)、MAPK3 (促分裂原活化蛋白激酶3)、JUN (JUN蛋白)、CASP3 (胱天蛋白酶3)、MYC (癌基因MYC)等靶标的度值排名较靠前,是蛋白互作网络中的核心靶点。再结合成分–靶标网络的分析结果,筛选出在两个网络中均处于核心位置的靶点共4个,见表1。这些靶点既在整个调节网络中起到枢纽的作用,又与扶正抑瘤方中的多个化学成分有相互作用,可能成为该方治疗NSCLC的关键靶点。

Table 1. Key targets of Fuzheng Suppressant prescription in the treatment of non-small cell lung cancer
表1. 扶正抑瘤方治疗非小细胞肺癌的关键靶标
4. 讨论
扶正抑瘤方中多种中药均具有抗肿瘤作用,墓头回中的抑瘤活性成分为槲皮素,槲皮素是一种颇具前景的抗肿瘤药物,其抗肿瘤作用在肺癌中已得到证实 [7] [8]。槲皮素是自然界中分布较为广泛的黄酮类活化物,被证实可通过抑制肿瘤细胞生长和转移等在包括非小细胞肺癌内在的多种肿瘤中发挥抗癌作用 [9] [10] [11] [12]。红芪中的诸多活性成分可大致分为HPS (红芪多糖)和黄酮两类,这两类活性成分可通过抑制肿瘤增殖、诱导肿瘤分化和凋亡、调控机体通道因子、提高机体免疫功能及协同化疗药物等方式防治肿瘤 [13]。有 [14] 研究发现HPS-1和HPS-3是HPS对人胃腺癌和肝癌细胞起抑制作用的关键活性组分,且抗肿瘤活性与其相对分子质量大小和单糖构成有关。HPS-1抑制人肺腺癌A549细胞增殖、凋亡的机制可能与其调控A549细胞氧化/抗氧化能力比例的作用有关 [15]。有专家 [16] 基于分子对接的方法研究拮抗肿瘤坏死因子受体1的红芪小分子化合物,结果表明槲皮素、异甘草素、柚皮素、毛蕊异黄酮及甘草素等黄酮类成分具有成为肿瘤坏死因子受体1拮抗剂的可能性。此外3-羟基-9-甲氧基紫檀烷对肝癌Hep G2细胞具有一定的细胞毒活性 [17]。当归及其活性成分可有效恢复免疫抑制状态、抑制肿瘤生长、诱导细胞凋亡、降低化疗的毒副作用、阻断和调控信息通路 [18]。莪术中的α-常春藤皂苷在体内及体外通过抑制非小细胞肺癌A549糖酵解水平从而抑制其生长,其机制为α-常春藤皂苷可能通过抑制c-Myc及HIF-1α而抑制其下游GLUT1、HK2、PKM2、LDHA、MCT4的表达 [19]。
本研究初步筛选得到扶正抑瘤方4味中药中14个活性成分,预测靶标550个,筛选出治疗NSCLC的潜在靶标148个。蛋白互相作用分析提示,AKT1 (蛋白激酶1)、IL6 (白介素6)、VEGFA (血管内皮生长因子A)、MAPK3 (促分裂原活化蛋白激酶3)、JUN (JUN蛋白)、CASP3 (胱天蛋白酶3)、MYC (癌基因MYC)的度值排名较靠前,被认为是蛋白相互作用网络中的核心靶点。研究表明c-JUN在氨基末端激酶信号通路中起着十分重要的作用,参与丝裂原激活蛋白激酶家族转导并调控细胞凋亡 [20];AKT是NSCLC中通过PI3K/Akt/mTOR信号通路调节细胞代谢的关键因子 [21]。IL6是一种多效性细胞因子,具有广泛调节的生物活性,包括肿瘤的发生、炎症、免疫应答以及造血功能 [22] [23]。IL6的过表达和疾病的病理学变化密切相关,如癌症及自身免疫性疾病 [24] [25]。更为重要的是,IL6可以自分泌或旁分泌的分泌方式逐渐产生慢性炎症微环境,这为肿瘤细胞的增殖和分化创造出了有利条件 [26]。目前IL6已被证实参加了肺癌、肝癌、结肠癌等多种肿瘤的发病过程 [27]。CASP3在肺癌组织的表达上有上调,因此CASP3可能成为可进行药物干预的分子标志物和靶点,C-CASP3在非鳞癌中表达高于鳞癌,在非鳞癌组织类型亚群患者中CASP3更可能作为潜在的干预靶点激活为C-CASP3而促进肿瘤细胞凋亡 [28];研究表明,MYC基因产物,尤其是c-MYC在诱导细胞凋亡过程中也起重要作用,c-Myc基因在非小细胞肺癌组织中的表达水平明显高于相应癌旁组织,沉默c-Myc基因能显著提高顺铂抑制非小细胞肺癌H1299细胞增殖的作用,c-Myc基因有可能成为NSCLC基因治疗的新靶点 [29];EGFR和VEGFA及其受体VEGFR在肿瘤的发生、发展中占据重要地位,研究肿瘤的发生、发展机制是为了寻找治疗肿瘤的有效方法,关于两者抑制剂联合使用的前景值得期待 [30]。MAPK是ras-MAPK信号传导通路的核心,激活的MAPK将信号传递到细胞核内,使核内许多转录因子如jun、fos、myc的某些氨基酸残基磷酸化而活化,促进和调节细胞生长和分化有关的基因的表达 [31]。
GO分类富集分析显示,从扶正抑瘤方成分中筛选出的靶点基因可以通过对细胞代谢和死亡的调控影响肿瘤细胞的增殖与凋亡,同时通过与含氧化合物反应导致肿瘤处于低氧的微环境,从而起到抑制肿瘤的发生发展,并可协同靶向药物或化疗药物起到增敏或减毒作用。
KEGG通路富集结果显示,扶正抑瘤方的治疗作用与多条信号通路有关,包括IL-17信号通路、TNF (肿瘤坏死因子)信号通路、HIF-1 (低氧诱导因子1)信号通路、糖尿病并发症的年龄–年龄信号通路等。NSCLC发生发展过程中有多种关键因子参与,如AKT1、VEGFA、JUN、MYC等通过激活相关的信号通路而影响NSCLC的发展。NSCLC的发生发展与血管生成也密切相关,VEGF及AKT2/STAT3信号转导通路是肺癌微血管生成的主要通路,阻断这些通路的活化能抑制血管生成相关因子的表达 [32]。
本研究以网络药理学方法探讨扶正抑瘤方治疗NSCLC的作用原理为目的。理论结果表明,扶正抑瘤方治疗NSCLC的作用原理涉及多个活性成分、作用靶标和关键通路,为其治疗效果的物质基础与作用原理的实验研究提供了参考。
NOTES
*通讯作者。