摘要: 目的:以硫氧还蛋白作为药物干预因素探索再灌注损伤药物治疗的最佳时机选择,通过动物实验探讨再灌注损伤药物前处理与后处理与疗效的关系。方法:使用雄性Sprague-Dawley大鼠建立缺血再灌注损伤模型,将28只Sprague-Dawley雄性大鼠随机分为A、B、C、D四组,A组缺血再灌注前药物注射组,于缺血再灌注前2小时腹腔注射硫氧还蛋白(20 μg/kg),B组缺血再灌注后药物注射组,于缺血再灌注后2小时腹腔注射硫氧还蛋白(20 μg/kg),C组为缺血再灌注前盐水注射组,于缺血再灌注前2小时注射2 ml盐水,D组为缺血再灌注后盐水注射组,于缺血再灌注后2小时注射2 ml盐水。于再灌注后48小时后每组随机选择5只大鼠处死,取皮肤行HE染色计数炎细胞。于再灌注后7天,对各组剩余大鼠进行拍照,并使用图像处理软件计算皮肤坏死率。结果:A组坏死率低于C组,B组坏死率低于D组,B组坏死率低于A组,HE染色切片炎细胞计数结果A组低于C组,B组低于D组B组低于A组。结论:再灌注后药物处理可以得到更优疗效。
Abstract:
Objective: Thioredoxin was used as a drug intervention factor to explore the best timing of drug treatment for reperfusion injury, and the relationship between drug pre-treatment and post- treatment of reperfusion injury and efficacy was explored through animal experiments. Materials and methods: Twenty-eight male Sprague-Dawley rats were randomly divided into four groups: group A, B, C, and D. Group A received drug injection before ischemia-reperfusion. Thioredoxin (20 μg/kg) was intraperitoneally injected 2 hours before ischemia-reperfusion. In group B, thioredoxin (20 μg/kg) was intraperitoneally injected 2 hours after ischemia-reperfusion. In group C, 2 ml sa-line was injected 2 hours before ischemia-reperfusion. In group D, 2 ml saline was injected 2 hours after ischemia-reperfusion. At 48 hours after reperfusion, 5 rats in each group were sacrificed, and the skin was taken for HE staining and the inflammatory cells were counted. At 7 days after reper-fusion, 2 rats in each group were photographed, and the percentage of skin necrosis was calculated. Result: The necrosis rate of group A was lower than that of group C, group B was lower than that of group D, and group B was lower than that of group A. The results of inflammatory cell count in HE stained sections of group A were lower than that of group C, group B was lower than that of group D, and group B was lower than that of group A. Conclusion: Drug treatment after reperfusion can get better results.
1. 引言
对于烧伤、病灶切除或伤口引起的皮肤缺损,医生会毫不犹豫地使用皮瓣进行修复,尤其是在整形外科。随着医学的进步,即使在普外科中,患者也较前更关注术后皮肤缺损对外观和功能的影响,而不仅仅是手术疗效。游离皮瓣是临床最常用的皮瓣类型之一,具有取样方便、隐蔽、组织覆盖好、临床功能恢复好等优点。然而,皮瓣的存活会受到缺血再灌注损伤等因素的威胁,组织中产生的大量氧自由基增加了氧化应激,巨噬细胞、中性粒细胞等炎症细胞聚集,血供减少,导致缺血。再灌注后组织酸中毒及高钾血症则最终导致了皮瓣的坏死。目前认为引起再灌注损伤主要机制包括白细胞–内皮细胞相互作用、活性氧和补体系统。所有组织都对再灌注损伤敏感,但这种敏感性因组织而异 [1]。在缺血再灌注治疗研究早期,人们曾尝试对拟行移植的供体进行预处理操作,如缺血预处理 [2]、高压氧预处理等 [3]。后来,富血小板血浆、脂肪来源干细胞及一系列产氢制剂等也被证实对缺血再灌注损伤有一定的治疗作用 [4] [5] [6] [7]。但其制备及处理过程都是极其繁琐的,往往不能通过单次干预获得较好疗效 [8]。然而,非布司他、艾塞那肽及硫氧还蛋白等药物的发现将缺血再灌注损伤的治疗推入了一个新阶段,药物治疗无论是从其获得的难易程度,还是操作简便行等方面均表现出巨大优势,也是近年皮肤缺血再灌注的主要研究热点。本研究则试图以硫氧还蛋白这一药物作为切入点,研究药物治疗的最佳时机选择。
2. 材料和方法
2.1. 实验动物
健康雄性SD大鼠28只,SPF级,6~8周龄,体重(200~250) g,均由济南朋悦实验动物繁育公司提供[SYXK (鲁) 2020 0018] [SYXK (鲁) 2019 0003]。所有动物均饲养于青岛大学附属医院科教楼动物实验中心,室内温度21℃~22℃,相对湿度40%~60%,光照周期为明/暗周期12小时。饲养密度为5只/笼,饲养期间动物可自由进食,保证水源充足。
2.2. 动物模型建立
4组大鼠均肌注氯胺酮(50 mg/kg)诱导麻醉。经角膜反射判断深度麻醉后,对大鼠腹部及腹股沟部的皮肤剪毛后进行脱毛膏脱毛,然后使昏迷大鼠平卧。以左侧腹壁浅动静脉为供血血管蒂,设计6 cm × 3 cm的扩展上腹岛状皮瓣。在麻醉条件下,将每只大鼠的左侧下腹壁皮瓣(6厘米 × 3厘米)从肌层分离,保留左腹壁下血管。然后用显微血管夹夹住左侧浅腹壁下血管(包括动脉和静脉),引起皮肤缺血。而后,采用外科缝线结扎右侧腹壁下血管,以避免穿通动脉供血引起实验误差。术后用外科缝线缝合皮肤切口。显微血管夹夹闭血管4小时后,肌注氯胺酮(50 mg/kg)维持麻醉。将所有大鼠右侧显微血管夹取下。血流在再灌注4小时后恢复。
2.3. 实验方法
适应性饲养7天后,我们将6~8周龄的SD大鼠随机均分为A、B、C、D四组,A组为缺血再灌注前药物注射组,于缺血再灌注前2小时腹腔注射硫氧还蛋白(20 μg/kg),B组为缺血再灌注后药物注射组,于缺血再灌注后2小时腹腔注射硫氧还蛋白(20 μg/kg),C组为缺血再灌注前盐水注射组,于缺血再灌注前2小时注射2 ml盐水,D组为缺血再灌注后盐水注射组,于缺血再灌注后2小时注射2 ml盐水。再灌注48小时后每组随机选择5只大鼠并将其处死后,选择血管蒂被夹闭处根部的全层皮肤(1.0厘米 × 1.0厘米)取下。用10%中性福尔马林浸泡,进行苏木精-伊红(HE)染色。将皮肤切片的显微结构在扫描显微镜下扫描成图,观察皮瓣组织结构的变化及血管附近和肌肉层间炎症细胞的渗透情况。用光学显微镜,在200倍放大倍数下,从每组标本切片中随机选取5个视野区域观察病理变化。再灌注7天后,各组剩余2只大鼠用华为Nova 9手机等位拍照,然后将照片传输到笔记本电脑上,用图像分析软件计算了皮瓣坏死率。最后,实验中的所有老鼠都被处死。
3. 结果
3.1. 腹腔注射硫氧还蛋白对大鼠皮瓣缺血再灌注损伤的影响
通过肉眼结合图像处理软件Image J对4组小鼠的坏死部位进行比较,如图1,A组坏死率(26.87%)低于C组(30.83%),B组坏死率(6.61%)低于D组(42.24%),由此可见,应用硫氧还蛋白对皮瓣缺血再灌注损伤有一定的保护作用。
 (A) (B) (C) (D)注:图A、B、C、D分别为A、B、C、D四组大鼠再灌注后24小时拍摄的图片,通过Image J软件分析后四组坏死率分别为,A组(26.87%),B组(6.61%),C组(30.83%),D组(42.24%)
(A) (B) (C) (D)注:图A、B、C、D分别为A、B、C、D四组大鼠再灌注后24小时拍摄的图片,通过Image J软件分析后四组坏死率分别为,A组(26.87%),B组(6.61%),C组(30.83%),D组(42.24%)
Figure 1. Skin photos of four groups of mice 24 hours after reperfusion
图1. 再灌注后24小时四组大鼠皮肤照片
3.2. 药物注射时间对大鼠皮瓣缺血再灌注损伤的影响
我们发现B组皮瓣坏死率明显小于A组,且A组坏死多集中在皮瓣边缘,B组皮瓣坏死肉眼几乎看不见。硫氧还蛋白注射液治疗缺血再灌注引起的皮瓣坏死疗效明显,再灌注后硫氧还蛋白注射在保护皮瓣坏死方面较术前硫氧还蛋白注射有明显优势。实验证明缺血再灌注损伤后皮瓣后处理的效果优于预处理,实验进一步证明了其可靠性,但由于各组间组织学和细胞学水平的差异无法用肉眼明确,我们进一步取小鼠皮瓣组织切片进行HE染色,如图2。对比不组别大鼠皮瓣HE染色切片结果发现,C、D组表皮细胞层变薄,以棘细胞层为著。显微镜视野可见多处皮肤坏死,大量脂肪细胞融合成巨大的脂肪液泡,嗜中性粒细胞、巨噬细胞等局部炎症细胞,皮下血管充血、扩张,可见嗜中性粒细胞浸润血管周围和肌层。在A组,上述情况明显缓解。在这四组中,B组最为突出,因为其新生血管较多,中性粒细胞浸润明显减少,脂肪细胞边界清晰,大小均匀。因此,从组织学和细胞学水平来看,B组获益显著。
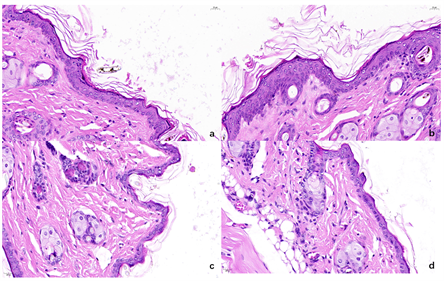 注:图a、b、c、d分别为A、B、C、D四组大鼠皮肤组织切片HE染色结果,可见C、D组表皮细胞层变薄,以棘细胞层为著。显微镜视野可见多处皮肤坏死,大量脂肪细胞融合成巨大的脂肪液泡,嗜中性粒细胞、巨噬细胞等局部炎症细胞,皮下血管充血、扩张,可见嗜中性粒细胞浸润血管周围和肌层。在A组,上述情况明显缓解。在这四组中,B组最为突出,因为其新生血管较多,中性粒细胞浸润明显减少,脂肪细胞边界清晰,大小均匀。
注:图a、b、c、d分别为A、B、C、D四组大鼠皮肤组织切片HE染色结果,可见C、D组表皮细胞层变薄,以棘细胞层为著。显微镜视野可见多处皮肤坏死,大量脂肪细胞融合成巨大的脂肪液泡,嗜中性粒细胞、巨噬细胞等局部炎症细胞,皮下血管充血、扩张,可见嗜中性粒细胞浸润血管周围和肌层。在A组,上述情况明显缓解。在这四组中,B组最为突出,因为其新生血管较多,中性粒细胞浸润明显减少,脂肪细胞边界清晰,大小均匀。
Figure 2. HE staining results of skin tissue sections of four groups of rats
图2. 四组大鼠皮肤组织切片HE染色结果
硫氧还蛋白注射时间在A、B两组间产生了明显的坏死率差异,再灌注后注射药物在动物实验中表现出更积极的保护作用。该药的积极作用主要是通过改善血液灌注,促进血管新生,缓解局部炎症反应,通过JNK-MAPK通路和SOD生成减轻缺血–再灌注引起的损伤。既往研究表明硫氧还蛋白(20 μg/kg体重)对皮瓣缺血–再灌注模型有保护作用,可减少皮瓣梗死体积。先前的实验努力证明了在再灌注前噬菌体过程中活性氧(ROS)浓度和自由基的产生上升到顶点 [9] [10],在内皮功能障碍和中性粒细胞粘连后突然再灌注重建供氧后,急性炎症反应也在早期开始 [11] [12]。本研究也有一定的局限性,如时间点设置应更密集,以使数据更有说服力,术前或术后注射硫氧还蛋白的时间应延长,以避免偶发事件,以获得更有说服力的结果。近10年来,对皮瓣缺血再灌注损伤的研究揭示了药物治疗的优越性,疗效显著,各种药物层出不穷。然而,这些药物的进一步发展受到侵入性操作和耗时的限制。然而,侵入性手术和耗时等因素阻碍了药物治疗的进一步发展。然而,最近的研究表明,后条件反射可以解决这两个问题。它是在手术后立即注射,不会因为剩余的麻醉效果而给病人造成额外的疼痛,此外,术后管理为一般选择性手术,特别是紧急手术的准备提供了充足的时间在早期的类似试验中,在缺血再灌注损伤前高频注射药物。频繁的注射给实验动物带来了疼痛,这在临床应用中也是一个威胁。侵入性操作和时间延迟成为广泛应用于临床的主要障碍“术后”一词最早提出于1996年 [13]。本文认为,“再灌注后处理”具有明显的优势,无论是择期手术还是急诊手术,外科医生都能掌握主动权,轻松地评估缺血再灌注损伤的情况,从而轻松、快速地对缺血再灌注皮瓣进行“损伤后治疗”。在这三种不同的后适应策略中,药理后适应策略比机械后适应策略更能避免对血管结构特别是主要血管的不必要压迫。结果表明,硫氧还蛋白可减少梗死体积,改善皮瓣血流量。药物在不同治疗时机的保护作用不同。实验证明再灌注后短时间内药物处理皮瓣损伤,能获得较好预后。
NOTES
*通讯作者Email: doctor_sun@163.com