摘要: 目的:报道1例上颌骨混合性上皮–结缔组织型磷酸盐尿性间叶性肿瘤(PMTMECT)患者的临床病理特征、治疗及预后。方法:回顾性分析1例PMTMECT患者的临床表现、病理特征、治疗及预后,并进行文献复习。结果:31岁男性患者,双侧髋关节疼痛加重伴腰背部疼痛入院。组织学形态结果显示:肿瘤组织由上皮和间叶两种成分组成,间叶成分由梭形细胞构成,肿瘤细胞呈血管外皮瘤样排列,可见“污浊”或絮状钙化基质。上皮成分类似牙源性上皮,以片状或不规则巢状广泛分布在肿瘤间。免疫组化染色显示肿瘤细胞表达间叶标志物Vimentin、上皮标志物AE1/AE3、Ki-67指数约5%。病理诊断为PMTMECT后,患者经手术切除治疗,目前随访2年,病情未复发。结论:PMTMECT肿瘤体积一般较小,临床无特异性表现,易漏诊,手术切除效果好。
Abstract:
Objective: To report the clinicopathological features, treatment and prognosis of a patient with mixed epithelial-connective tissue-type phosphaturic mesenchymal tumor of the maxilla (PMTMECT). Methods: The clinical presentation, pathological features, treatment and prognosis of a patient with PMTMECT were retrospectively analyzed, and the literature was reviewed. Results: A 31-year-old male patient with increased bilateral hip pain with low back pain was admitted to the hospital. The histological findings showed that the tumor tissue consisted of both epithelial and mesenchymal components, with the mesenchymal component consisting of spindle-shaped cells, and the tumor cells were arranged in a hemangiopericytoma-like pattern, with a “stained” or floc-culent calcified stroma. The epithelial component resembled odontogenic epithelium and was widely distributed among the tumors in sheets or irregular nests. Immunohistochemical staining showed that the index of tumor cells expressed mesenchymal marker Vimentin, epithelial marker AE1/AE3, and Ki-67 is about 5%. After pathological diagnosis of PMTMECT, the patient was treated with surgical resection and is currently followed up for 2 years with no recurrence of disease. Con-clusion: PMTMECT tumors are generally small in size, have no specific clinical manifestations, are easily missed, and have good surgical resection results.
1. 引言
磷酸盐尿性间叶性肿瘤(Phosphaturic mesenchymal tumor, PMT)是一种罕见的良性间叶肿瘤,也是肿瘤性软骨症(tumor induced osteoma, TIO)的主要病因。1987年Weinder首次提出PMT,截止目前全世界报道仅300余例 [1]。2013年PMT被正式纳入WHO软组织与骨肿瘤病理分类。2018年我国学者第一次提出新的组织学类型混合性上皮–结缔组织型PMT (phosphaturic mesenchymal tumor, mixed epithelial and connective tissue type, PMTMECT),该亚型好发于年轻男性,且均发生于牙槽骨 [2]。PMT肿瘤体积较小,生长缓慢,患者通常表现为不明原因的乏力、骨痛等,无特异性表现,随着对该疾病的认识,发现其组织病理学类型也非单一,容易漏诊。本文报道1例上颌骨PMTMECT并进行相关文献复习,旨在提高临床病理医生对该疾病的认识,避免误诊。
2. 材料与方法
2.1. 临床资料
男性,31岁,2020年5月起双侧髋关节疼痛近半年,加重伴腰背部疼痛1周入院,多于休息时发作,活动后缓解。实验室检查:血清无机磷0.49 mmol/L,血钙正常。ESR、CRP、HLA-B27阴性。骨标志物正常。双侧髋关节及骶髂关节MRI平扫示右侧股骨头及股骨颈骨折伴骨髓水肿。PET-CT提示左侧上牙槽骨上方、左侧上颌窦底部68Ga-DOTA-NOC高代谢。遂行导航系统下经鼻内镜引导左侧上牙槽肿瘤切除术,术中见肿物位于左侧上牙槽骨上方,左侧上颌窦底部的智齿旁,大小约1 cm × 0.5 cm,边缘光滑,界尚清。
2.2. 方法
送检标本经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,常规HE染色和免疫组化染色。免疫组织化学方法采用Max Vision两部法,所用抗体Vimentin、AE1/AE3、SMA、CK5/6、P63、CD56、Syn、bcl-2、D2-40,Ki-67均为福州迈新生物技术有限公司产品。
3. 结果
3.1. 巨检
灰白色组织一块,大小3 cm × 2 cm × 1.5 cm,局部见牙齿2颗,切面见灰白灰红色肿物,大小1.5 cm × 1 cm × 0.5 cm (图1)。

Figure 1. Show the general view of the tumor
图1. 示肿瘤大体观
3.2. 镜检
镜下见肿瘤组织由上皮和间叶两种成分组成,间叶成分由梭形细胞构成,形态温和,核分裂象罕见,呈疏松状,间质血管丰富,肿瘤细胞呈血管外皮瘤样排列,可见“污浊”或絮状钙化基质,局部粘液样变性,并见类软骨或骨组织形成。上皮成分类似牙源性上皮,以片状或不规则巢状广泛分布在肿瘤间。
3.3. 免疫组化
免疫组化染色显示肿瘤细胞表达间叶标志物Vimentin、上皮标志物AE1/AE3,灶性表达SMA、CK5/6、P63、CD56、Syn、bcl-2、D2-40,Ki-67抗原标记指数约5% (图2)。
3.4. 病理诊断
病理诊断:(左上牙槽)符合磷酸盐尿性间叶性肿瘤,混合性上皮–结缔组织型。
3.5. 术后随访
患者经手术切除,出院后双侧髋关节疼痛症状缓解,一般状况良好,目前随访2年4个月,未见复发。
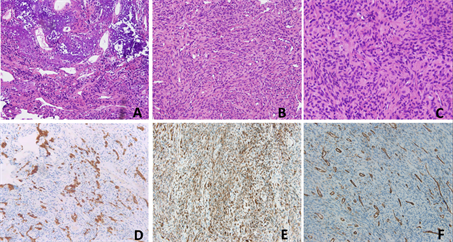 A示特殊的钙化性基质(HE染色 × 200);B示分枝状的血管(HE染色 × 400);C示肿瘤细胞呈短梭形,形态温和(HE染色 × 400);D示AE1/AE3表达(Max Vision法IHC × 100);E示Vimentin表达(Max Vision法IHC × 100);F示CD31表达(Max Vision法IHC × 100)
A示特殊的钙化性基质(HE染色 × 200);B示分枝状的血管(HE染色 × 400);C示肿瘤细胞呈短梭形,形态温和(HE染色 × 400);D示AE1/AE3表达(Max Vision法IHC × 100);E示Vimentin表达(Max Vision法IHC × 100);F示CD31表达(Max Vision法IHC × 100)
Figure 2. The histopathological characteristics and immunohistochemistry
图2. 示组织病理学特点及免疫组化
4. 讨论
磷酸盐尿性间叶性肿瘤(Phosphaturic mesenchymal tumor, PMT)是一种罕见的良性间叶性肿瘤,可以诱发骨软化症,所以PMT也被称为骨软化症相关性间叶肿瘤。目前研究认为PMT的主要发病机制为肿瘤分泌过量的成纤维生长因子-23 (FGF-23),抑制肾脏近曲小管上钠/磷共转运蛋白的表达,使肾脏重吸收磷减少,肾磷排出增加,出现骨软化症状 [3]。FGF-23还可以通过其他机制加剧骨矿化障碍,影响1α羟化酶活性,使1,25羟维生素D生成减少,引起获得性低血磷性骨软化症 [4],术后患者血磷显著升高,手术切除的肿瘤也可表达FGF-23 [5],因此FGF-23可作为PMT诊断的特异性抗体之一。
关于PMT的报道多为病例报告,目前国内外最大宗病例是由北京协和医院团队总结106例PMT的临床病理资料 [2]。PMT 好发于中年人,平均年龄42岁,最常累及四肢及头颈部。主要表现为肌肉疼痛、进行性无力,并伴有长期低磷血症的症状,容易和正常血钙性甲状旁腺功能亢进症及维生素D抵抗性骨软化症混淆 [6]。奥曲肽显像(99mTc-OCT)是目前诊断PMT的主要影像学手段,但仍有一定局限性,部分病例可呈假阴性 [7]。国内外采用68Ga-TATE检测及定位PMT,主要是通过68Ga标记生长抑素类似物DOTA-TATE进行PET-CT显像,这对隐匿性肿瘤尤其敏感 [8],本例患者肿瘤体积小,最终通过Ga68作为显像剂的PET-CT检测准确定位。
PMT比较罕见,其组织学表现多样,最初Weidner [9] 等提出4种组织学亚型,包括PMTMCT,成骨细胞瘤样亚型,非骨化性纤维瘤样亚型,骨化性纤维瘤样亚型。2004年Folpe [1] 等提出PMT肿瘤的组织病理学类型均为PMTMCT。2018年我国学者首次报道22例PMT中混有上皮和间叶两种成分,并提出一种新的亚型,命名为“磷酸盐尿性间叶肿瘤,混合性上皮–结缔组织型(PMTMECT)” [4]。该亚型好发于年轻男性,且均发生于牙槽骨。本例报道与文献相符。PMTMECT镜下肿瘤细胞形态温和,两种成分构成,上皮成分不规则分布整个肿瘤之间,类似牙源性上皮,而间叶成分呈梭形排列,细胞疏松,间质血管丰富,有些可呈现分枝状、小簇状,最主要的是可产生“污浊”嗜碱性的基质,这些基质可呈钙化表现,同时可类似骨组织或骨样组织。当肿瘤细胞丰富,细胞异型性明显,出现肿瘤性坏死,核分裂象 > 5/10HPF以及增殖指数升高需要考虑恶性PMT [10]。免疫组化与PMTMCT的免疫组化相似,可表达Vimentin、SSTR2A、FGF23、NSE、FGFRl、CD99、CD56、CD68、bcl-2和D2-40,上皮成分AEl/AE3阳性。有学者证实SSTR2A、CD56及ERG是该肿瘤的有效标记物 [11] [12]。另有文献报道,PMT可有SATB2的表达 [13]。本例间叶标记Vimentin和上皮标记AE1/AE3阳性外,其他如CD34、CK5/6、CD56等可局灶阳性。分子遗传学发现该肿瘤大部分具有FN1-FGFR1的融合,约6%病例具有FN1-FGF1的融合 [1]。
PMTMECT鉴别诊断主要包括:1) 牙源性纤维瘤,由胶原基质伴成纤维细胞和牙源性上皮构成,但上皮往往均匀分布,且缺少侵袭性,虽然PMTMECT上皮成分类似牙源性上皮,但上皮是以片状或不规则巢状广泛分布在肿瘤间;2) 滑膜肉瘤也是双相分化,但有明显的细胞异型性、核分裂活跃,分子标记SYT-SSX1/2/4融合可鉴别;3) 孤立性纤维性肿瘤,二者间质均富含血管且均可表达CD99、CD34及bcl-2,但孤立性纤维性肿瘤内无上皮成分,且STATA-6标记阳性 [14];4) 造釉细胞瘤,其底层肿瘤细胞呈栅栏状排列,细胞核有极向及星网状层样分化,可与PMTMECT相鉴别。
5. 结论
PMT通常是良性的,治疗以外科切除为主,90%患者可达到治愈,但应注意和恶性PMT相鉴别,后者肿瘤易复发和转移。PMTMECT是PMT的一个独立亚型,临床上对疑似肿瘤诱导性骨软化症,且无明确症状、体征者,可检查牙周情况以排除这一亚型。限于样本量较少,PMTMECT这一亚型仍处于研究中,对该类型患者术后仍需要进行临床随访并定期监测血清磷。
基金项目
陕西省科技创新团队(2020TD-048);陕西省人民医院领军人才项目(2021LJ-12)。
参考文献
NOTES
*通讯作者。