摘要: 众所周知,土壤环境中常见的锰氧化物对污染物的环境行为能够产生重要影响。但关于锰氧化物与重金属离子混合体系下,污染物的转化行为还不太清晰。因此,本研究探讨了环境中典型染料甲基橙在重金属铜离子(Cu
2+)与二氧化锰(MnO
2)混合体系中的转化行为。首先利用X射线衍射仪(XRD)、高分辨扫描电镜仪(FESEM)和比表面积仪(BET)对制备的MnO2的晶型、表面形貌和比表面积等性质进行分析。随后,通过室内批次实验探讨了Cu
2+和甲基橙含量以及反应溶液pH值等因素对反应体系中甲基橙的降解行为的影响。结果表明,总体上,Cu
2+显著抑制了反应体系中甲基橙的去除效率;随着反应溶液pH值的降低,反应体系中甲基橙的抑制效率呈现出明显的下降趋势。此外,添加的Cu
2+含量与反应体系中甲基橙的去除效率呈现显著的负相关;甲基橙含量的提升明显降低了甲基橙的抑制效率。分析证实,Cu
2+与甲基橙结合MnO
2表面活性位点之间的竞争关系决定了反应体系中甲基橙的去除效率。因此,本研究对深入理解实际土壤环境中锰氧化物对染料类污染物环境行为具有重要理论意义和现实意义。
Abstract:
As we all know, the common manganese oxides in the soil environment can have an important impact on the environmental behavior of pollutants. However, the transformation behavior of pollutants in the mixed system of manganese oxide and heavy metal ions is still unclear. Therefore, this study discussed the transformation behavior of methyl orange, a typical dye in the envi-ronment, in the mixed system of heavy metal copper ion (Cu2+) and manganese dioxide (MnO2). Firstly, X-ray diffraction (XRD), high-resolution scanning electron microscopy (FESEM) and specific surface area meter (BET) were used to analyze the crystal form, surface morphology and specific surface area of the prepared MnO2. Then, the effects of Cu2+, methyl orange content and pH of the reaction solution on the degradation behavior of methyl orange in the reaction system were discussed through laboratory batch experiments. The results showed that overall, Cu2+ significantly inhibited the removal efficiency of methyl orange in the reaction system. With the decrease in the pH value of the reaction solution, the inhibition efficiency of methyl orange in the reaction system showed an obvious downward trend. In addition, the content of Cu2+ was negatively correlated with the removal efficiency of methyl orange in the reaction system. The increase in methyl orange content obviously reduces the inhibition efficiency of methyl orange. The analysis confirmed that the competitive relationship between Cu2+ and the surface active sites of methyl orange combined with MnO2 determined the removal efficiency of methyl orange in the reaction system. Therefore, this study is of great theoretical and practical significance to deeply understand the environmental behavior of manganese oxides on dye pollutants in the actual soil environment.
1. 引言
偶氮染料因具有合成工艺简单、成本低、染色性能突出等优点而被广泛使用于各种行业,工业生产过程中的跑冒滴漏等现象以及废水的无序排放过程引起了该类污染物在不同环境介质中普遍存在,包括地表水 [1]、土壤 [2],甚至地下水环境 [3]。此外,长期暴露于该类污染物环境中的生物体还可以引起一定的健康风险,包括致癌性,突变性和过敏性等,从而对人类身体健康造成一定的生态风险 [4] [5]。因此,研究该类污染物在环境中的转化行为可为评价该类污染物的生态风险提供一定的理论意义和现实意义。
锰氧化物作为土壤次生矿物氧化组成中的重要组成成分,对进入到土壤环境中的污染物(重金属和有机污染物等)的地球化学行为产生重要影响 [6] [7]。由于锰氧化物具有较大的比表面积和氧化特性,因此可以通过吸附(静电和配体交换等作用)、氧化和水解等过程直接影响重金属(例如Pb、Cu、Co等) [8]、农药(例如甲基对硫磷、敌敌畏和甲胺磷等)和新型有机污染物(例如抗生素、内分泌干扰物)的环境行为 [9] - [14]。然而,实际水土沉积物环境中存在的锰氧化物并不单独存在,其往往与土壤环境中存在的金属离子、有机质和黏土矿物等相互结合形成胶结体,进而影响单独存在的锰氧化物对污染物的环境行为 [9] [15] [16]。例如在几种DOM典型组分对MnO2降解四环素影响的研究中发现 [9]:① HA和氨基酸(赖氨酸、色氨酸)的加入会对MnO2降解四环素产生抑制作用;② 其他的MnO2/有机酸体系对四环素的降解中,不同的有机酸对MnO2降解四环素有着不同程度的促进作用。
现阶段大多数研究学者都聚焦于含高浓度偶氮染料的废水强化处理(高级氧化技术、吸附、氧化、还原)以及实际水土环境中该类污染物的生物降解作用(细菌、真菌) [17] [18] [19] [20] [21],而对实际土壤环境中该类污染物的非生物转化过程的研究相对较少。尽管有部分学者发现锰氧化物的强氧化性能够快速去除偶氮类染料 [10] [22] (例如甲基橙、酸性红B),但很少有研究学者深入研究土壤水溶液中的重金属离子对反应过程影响。
本研究采用水热合成法合成了α-MnO2,并用X射线衍射、比表面积测试、场发射扫描电镜对其表征,分析其结构特性,并设计实验探讨了铜离子对二氧化锰降解典型偶氮染料甲基橙的影响及原因。
2. 实验与方法
2.1. 二氧化锰(MnO2)的制备
本研究中二氧化锰的制备方法采用水热法合成 [11] [23]。制备方法简要描述如下:将KMnO4水溶液(0.8 M, 400 mL)缓慢加入至MnSO4溶液(1.6 M, 300 mL)中,于90℃条件下不断搅拌反应6 h。随后用热水和超纯水反复洗涤制备的材料,直至过滤液为胶体状,最后于100℃温度条件下隔夜烘干,研磨过200目尼龙筛后保存于干燥皿内备用。
2.2. 主要试剂
高锰酸钾、无水硫酸锰、甲基橙、五水硫酸铜、醋酸、醋酸钠、MOPS缓冲液(pH6.5)、氨水、二乙基二硫代氨基甲酸钠(铜试剂)。以上药品均为分析纯。
以一定比例的醋酸和醋酸钠配制同浓度pH4.5及5.5的pH缓冲液,用于配制甲基橙和Cu2+反应溶液。
配制54 g/L的二乙基二硫代氨基甲酸钠(铜试剂)标准溶液,用于铜离子的显色。
2.3. 实验方法
本实验所有反应动力学均在250 mL锥形瓶内进行。首先配制含有一定量浓度的甲基橙/Cu2+反应溶液(pH用醋酸–醋酸钠缓冲液或MOPS缓冲液控制),随后称取一定量的MnO2加入至反应液,使用保鲜膜将反应瓶密封后置于恒温水浴摇床(25℃, 150 r/min)内开始反应。定时用10 mL注射器采集5 mL,取样后迅速用0.22 µm滤头过滤,滤液抛弃前2 mL,后3 mL在紫外分光光度计下测定其吸光度(波长464 nm)。取样时间分别为2、4、8、12、26 h (pH4.5条件下为0.5、1、2、4、8 h)。
铜离子含量的测定需先用氨水调节滤液pH至9,加入过量的二乙基二硫代氨基甲酸钠标准溶液(6 mL以上),定容后20 min内在紫外分光光度计下测定其吸光度(波长452 nm)。
2.4. 分析方法
处理后的滤液采用紫外分光光度计(Spectrumlab 752s)测定甲基橙或铜离子浓度。XRD表征采用X射线衍射仪(D8 ADVANCE, BRUKER);BET测试采用比表面积孔径分析仪(BELSORP Max II,麦奇克拜尔);FESEM表征采用场发射扫描电子显微镜(Gemini300,德国蔡司)。
3. 结果与讨论
3.1. α-MnO2的表征
图1为本研究中制备MnO2的XRD图谱。通过与标准卡片比对,本研究中合成的MnO2为a-MnO2 (JCPDS no. 44-0141)。图2为孔隙分布、N2吸附–解析附等温线图。由检测结果计算,合成的二氧化锰平均孔隙直径为10.43 nm,SBET为188.43 m2/g。
图3为MnO2的场发射扫描电镜图。由图可以看出合成的MnO2为纳米线形成大小不一的小球,再由小球无规则的团聚在一起形成球状颗粒,颗粒表面存在不同直径大小的孔隙通道。其中纳米线的长度为100 nm左右,小球直径范围约为0.1~1.5 µm。

Figure 1. X-ray diffraction pattern of MnO2
图1. MnO2的X射线衍射图
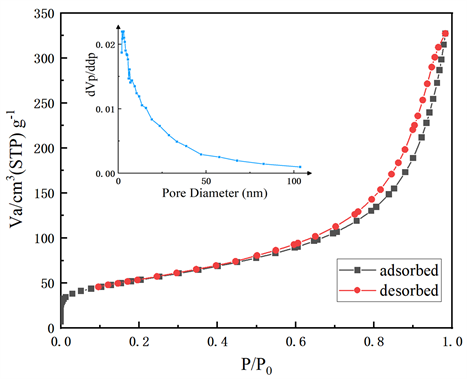
Figure 2. Pore size distribution diagram of α-MnO2 (inset) and N2 adsorption-desorption isotherm diagram
图2. α-MnO2的孔径分布图(内嵌图)及N2吸附–解析附等温线图

Figure 3. Field emission scanning electron microscope of α-MnO2
图3. α-MnO2的场发射扫描电镜图
3.2. Cu2+介导二氧化锰对甲基橙转化的影响因素
图4为pH5.5下MnO2/Cu2+对甲基橙转化的反应动力学。由图可看出Cu2+单独对甲基橙没有任何影响,但会抑制MnO2对甲基橙的转化。

Figure 4. Reaction kinetics of methyl orange at pH5.5
图4. pH5.5下甲基橙的反应动力学
3.2.1. 不同pH条件下Cu2+介导二氧化锰对甲基橙转化的分析
图5为不同pH条件下MnO2/Cu2+对甲基橙的反应动力学。由图能明显看出:① 在该pH范围内,pH越低,合成的二氧化锰活性越高,对甲基橙的转化效果越好;② Cu2+对二氧化锰转化甲基橙有着抑制作用,且在pH较高时的抑制效果更明显。由于H+浓度越高越容易发生以下反应:
,即pH越低时,二氧化锰的氧化能力越强。此外,H+释放了二氧化锰表面被Mn2+堵塞的活性位点 [24]。

Figure 5. Reaction kinetics under different pH conditions (the left picture shows the conversion of methyl orange by MnO2; The right picture shows the conversion of methyl orange by MnO2 and Cu2+
图5. 不同pH条件下的反应动力学(左图为MnO2对甲基橙的转化作用;右图为MnO2和Cu2+共同对甲基橙的转化作用)
3.2.2. 不同浓度铜离子对二氧化锰降解甲基橙的影响
现有多种研究表明金属氧化物对重金属离子有着吸附作用 [25] [26]。故在相同反应条件下,测定合成的二氧化锰对铜离子的吸附。图6是pH5.5下α- MnO2 对Cu2+的吸附等温线,表1为Langmuir和Freundlich方程拟合参数。由图和表可知,Langmuir等温吸附模型能更好的描述合成的二氧化锰对铜离子的等温吸附行为,理论饱和吸附量为87.88 mg/g。
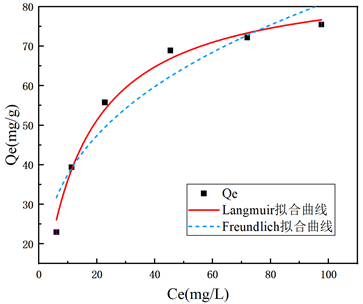
Figure 6. Adsorption isotherm of Cu2+
图6. Cu2+吸附等温线

Table 1. Fitting parameters of Langmuir and Freundlich equations
表1. Langmuir和Freundlich方程拟合参数
从图7可以看出:① 在一定浓度范围内,随着铜离子的浓度增加,体系对甲基橙的降解效果越差;② 相同铜离子浓度梯度下,当铜离子浓度逐渐增加,抑制效果提升越不明显。这是因为随着铜离子浓度增加,合成的二氧化锰对铜离子的吸附增量逐渐减少,趋近于吸附饱和。
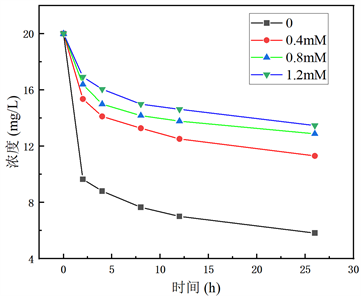
Figure 7. Effect of copper ion concentration on degradation of methyl orange by manganese dioxide
图7. 铜离子浓度对二氧化锰降解甲基橙的影响
3.2.3. 不同甲基橙浓度对反应体系的影响
图8是甲基橙浓度对Cu2+混合二氧化锰体系降解甲基橙的影响,从图中可以看出:① 甲基橙浓度越高,二氧化锰对其的吸附量越大;② 随着甲基橙浓度升高,添加了铜离子的与不添加铜离子的甲基橙在单位面积二氧化锰上转化量的比率先下降后上升(铜离子抑制率先升后降)。由于甲基橙初始浓度为10 mg/L时,二氧化锰对于甲基橙是过量的,即二氧化锰的活性位点对于该浓度的甲基橙是过量的,所以加入铜离子后,甲基橙的转化量依然较高。当甲基橙初始浓度为20 mg/L及以上时,二氧化锰的活性位点相较饱和,由于甲基橙和铜离子对于二氧化锰表面的活性位点形成竞争关系,所以当甲基橙浓度升高时,铜离子的与不添加铜离子的甲基橙在单位面积二氧化锰上转化量的比率也是上升的。

Figure 8. Effect of methyl orange concentration on degradation behavior of methyl orange in MnO2/Cu2+ reaction system
图8. 甲基橙浓度对MnO2/Cu2+反应体系中甲基橙降解行为影响
4. 结论
结果表明,在铜离子、二氧化锰、甲基橙三相体系中,二氧化锰作为氧化剂/吸附剂存在,铜离子和甲基橙形成竞争关系,具体表现为:
① 随着酸性增强,铜离子对二氧化锰转化甲基橙的抑制作用降低,原因是酸性越强,二氧化锰氧化性越强;
② 铜离子含量越高,对二氧化锰转化甲基橙的抑制作用越明显;
③ 甲基橙反应液浓度越高,二氧化锰/Cu2+对其的转化量越高,且添加了铜离子的与不添加铜离子的甲基橙在单位面积二氧化锰上转化量的比率先下降后上升。
造成这些影响的主要原因是铜离子占据了α-MnO2表面的活性位点,从而减少了α-MnO2与甲基橙的接触面积,进而抑制了α-MnO2对甲基橙的降解作用。
NOTES
*通讯作者。