1. 前言
锦鲤(Cyprinus carpio haematopterus)在分类上属于辐鳍亚纲,鲤形目,鲤科(Cyprinidae) [1],因其体型优美、色彩丰富、花纹多样,品系种类繁多,具有良好的成熟的鉴赏标准,观赏价值和养殖价值极高,目前锦鲤最大的养殖国家是日本,对于锦鲤养殖技术、循环水技术、饲料技术也处于领先地位。中国锦鲤养殖行业发展迅速,在广东、上海、北京等地已经建立多家大型锦鲤养殖场,养殖场的建立和扩大,也推动了循环水技术,饲料行业等相关产业的发展。
雌性锦鲤生长速度较雄性锦鲤快,雌性锦鲤的体型更为优雅,深受锦鲤养殖者的追捧和喜爱。在锦鲤商品中,雌性锦鲤因骨架品相和生产力往往比同等条件下雄性锦鲤价值高50%~100%,开展锦鲤的全雌化培育可极高地提高锦鲤的产值,因此在幼苗时期开展锦鲤雌雄判别具有重要的产业意义。
2. 材料与方法
2.1. 样品准备
实验对象为30 cm以下,观察外表形态和体色无法分辨出雌雄的鱼苗。分别从三个不同生长阶段的锦鲤养殖池中各随机捞出5条鱼,分为1、2、3组,每组5条锦鲤分别标记为A、B、C、D、E。
用MS222将鱼麻醉。在盆中加入适量的麻醉剂,静置一会儿,等锦鲤幼苗的活动减弱,略有侧偏,说明已经达到麻醉效果,麻醉剂的用量要与锦鲤鱼苗的体型大小相适应。对各组锦鲤测量体长、体重,手机拍照做好记录。给鱼取血时用报纸或湿布将鱼体包起,并把鱼的眼睛遮盖上,可以有效减少鱼的惊扰从而避免损伤。用采血针在鱼尾柄处采集尾静脉血液3~4 ml,加入用肝素钠溶液湿润过的离心管中。操作完的鱼苗及时用富含溶氧的清水冲洗去除麻醉。
将离心管放入冰盒并置于有冰袋的保温箱中便于运输,返回实验室后置于4℃冰箱中,在48小时内完成雌二醇、睾酮和卵黄原蛋白的检测。
2.2. 实验方法
2.2.1. 样品的采集方法
1) 用移液管取2 ml样品血液,加入灭菌离心管中,每个样本分为两组,分别标为E和T,E和T离心管加入数量相等的血样;
2) 加入抗凝剂(EDTA、草酸钠、肝素、枸橼酸钠),按1:9 (抗凝剂:血样),在冰上半小时之内对血浆进行分离,以减少血小板的对血浆蛋白的污染(也可以直接用抗凝管采集);
3) 将离心管中静置后血液放于离心机(可以调节温度的离心机),用离心机在4℃,设置为2500 rpm离心时间定为5 min,进行离心,将离心好的匀浆取上清液,然后弃去下面沉淀(血细胞);
4) 取上清液放于冷存管,分别标号。分装冻存备用,在2℃~8℃温度下可以放置保存约24~48小时;在20℃温度下,可放置保存1个月;−70℃温度条件下,可放置保存6个月。实验前需要做一个预实验,测试样品是否变质过期。
2.2.2. ELISA检测法
ELISA即酶联免疫吸附实验,原理:包被抗体或抗原,然后加入待检物,里面的抗原或抗体与包被板上产生特异性结合 [2],再通过酶来催化显色反应,显色反应后的吸光度OD值与酶的量相关,而酶的量与待检物相关,故可以检测待检物含量。
以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
通过测定鱼血清、血浆及相关液体样本中雌二醇(Estradiol)以及睾酮(T)的OD值,进一步分析得出锦鲤血清中的雌二醇以及睾酮含量。通过测定分析不同年龄阶段锦鲤的雌二醇和睾酮的含量可以进一步分析出最佳可以通过雌二醇和睾酮含量鉴定雌雄的年龄阶段。
2.2.3. 蛋白质检测法
鱼类的卵黄蛋白原是在雌二醇的作用下由肝脏的肝细胞合成,释放到血液中的一种含磷脂蛋白。卵黄蛋白原随血液循环到达卵巢时,掺入正在发育的卵母细胞并沉积在卵母细胞内形成卵黄蛋白颗粒。卵黄蛋白原为雌鱼在卵巢发育期所产生的特殊蛋白,亦称雌性特异血浆蛋白。
卵黄蛋白原的测定方法有免疫电泳法、测定碱不稳定性蛋白结合磷方法以及放射免疫测定法。本实验采用测定碱不稳定性蛋白结合磷的方法。
本方法的基本原理是先将鱼血清中的蛋白质用二氯醋酸(TCA)沉淀,用浓碱在高温下将沉淀的蛋白质分解,使其释放出含磷脂蛋白中的磷。再按照测定无机磷的方法测定磷含量。因为卵黄蛋白原中磷含量很稳定,故可以用无机磷的含量表示卵黄蛋白原的量。
无机磷的测定方法,选用钼酸试剂与磷结合成磷钼酸,再以还原剂(选用抗坏血酸)还原成钼蓝,与同样处理的已知标准溶液比色 [3]。
步骤如下:
1) 在离心管中加浓度为100 mL/L的TCA 1 mL及4 ml血清样品,放于冰箱0℃过夜(10小时);
2) 在高速离心机离心(约1600 r/min) 10 min,弃去上清液;
3) 用50 mL/L TCA在90℃ (水浴加热锅)孵育30 min冷却后,在4摄氏度进行离心10 min,弃去上清液;
4) 按乙醇–氯仿:乙醚:乙醇(体积比为1:2:2)–丙酮–乙醚顺序清洗沉淀物,每次洗完后离心,弃去上清液;
5) 加人1 mL浓度为5 mol/L的NaOH,将离心管密封后于110℃中水解2 h;
6) 将水解后的样品移入比色管中,加人1 mL浓度为5 mol/L的HCI中和,再加人4 mL显色液并用蒸馏水定容。将比色管在37℃中孵育2 h;
7) 在分光光度计780 μm波长处比色。
2.3. 试剂配制方案
2.3.1. 肝素钠溶液
肝素钠称取0.1 g,加5 ml的生理盐水将其溶解,配制成的溶液浓度为2800单位/ml,取50 ul的溶液湿润离心管,可以抗凝鱼血液3 ml左右。若同一只离心管需要存放更多血液需适量加入更多的肝素钠溶液。
2.3.2. 显色液的配制方法
1份3 mol/L H2SO4,2份蒸馏水,1份25 g/L钼酸铵,1份100 g/L抗坏血酸按照比例将各溶液混合,每次实验用时现配即可。
2.3.3. 卵黄原蛋白标准溶液
无水磷酸二氢钾(在105℃干燥12 h后) 0.4394 g于1000 mL容量瓶加蒸馏水溶解,加5 mol/L H2SO4 10 mL并定容。放入冰箱保存,此时浓度为0.1 g/L。应用时在100 mL容量瓶中稀释成不同浓度,形成梯度。
3. 数据与分析
3.1. 实验数据
通过预实验得知睾酮的纯度可以直接进行ELISA实验,雌二醇的浓度略高,吸光度值过高导致数值不稳定,将样品浓度稀释五倍后进行实验测定。锦鲤各组体长、体重、睾酮吸光度值及浓度值和雌二醇的吸光度值及浓度值见表1~3。

Table 1. Body length, body weight, testosterone absorbance and concentration, absorbance and concentration of Estradiol in Group A of Cyprinus carpio
表1. 锦鲤A组体长、体重、睾酮吸光度及浓度和雌二醇的吸光度及浓度

Table 2. Body length, body weight, testosterone absorbance and concentration, and absorbance and concentration of estriol in group B of Cyprinus carpio
表2. 锦鲤B组体长、体重、睾酮吸光度及浓度和雌二醇的吸光度及浓度

Table 3. Body length, body weight, testosterone absorbance and concentration, Absorbance and concentration of estradiol in Group C of Cyprinus carpio
表3. 锦鲤C组体长、体重、睾酮吸光度及浓度和雌二醇的吸光度及浓度
3.2. 数据分析
运用SPSS软件和ELISAcalc软件进行表格的制作和数据的分析,睾酮浓度与吸光度值的关系见图1,雌二醇E2浓度与吸光光度值的关系见图4。
3.2.1. 睾酮T相关数据分析
根据实验测得数据可知睾酮T的浓度与吸光度值的关系是一个二元曲线关系。

Figure 1. Relationship between testosterone concentration and absorbance value
图1. 睾酮浓度与吸光度值的关系
对A、B、C三组数据分别取平均值进行分析。如图2、图3所示,在一定的生长阶段,锦鲤体内睾酮的浓度与体长、体重的关系是随着体长体重的增加而减少。到达一定的阶段,睾酮在体内的含量达到最低,随后锦鲤体内睾酮含量会随着体重的增加而逐渐增高。

Figure 2. Relationship between testosterone concentration and body length
图2. 睾酮T含量与锦鲤体长的关系
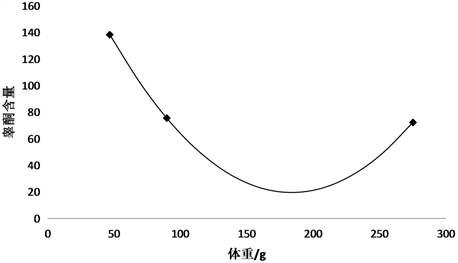
Figure 3. Relationship between testosterone concentration and body weight
图3. 睾酮T含量与锦鲤体重的关系
3.2.2. 雌二醇E相关数据分析
如图4所示,雌二醇E2的浓度与吸光度值的关系是一个二元曲线关系。

Figure 4. Relationship between estradiol concentration and absorbance value
图4. 雌二醇E2浓度与吸光度的关系
根据图5、图6体长体重与雌二醇E2的关系可以看出,雌二醇浓度与体长体重的关系是二元函数关系,在体长20 cm体重150 g前,雌二醇的浓度出现一个增长阶段,在体长20 cm体重150 g后出现一个降低趋势。在体长20 cm体重150 g左右时是数据测量的最佳时间。
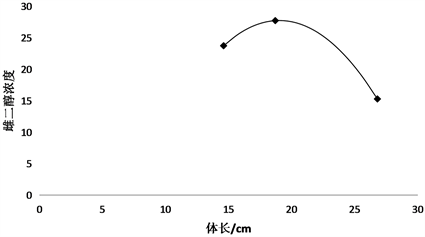
Figure 5. Relationship between estradiol concentration and body length
图5. 雌二醇E2含量与锦鲤体长的关系

Figure 6. Relationship between estradiol concentration and body weight
图6. 雌二醇E2含量与锦鲤体重的关系
3.2.3. 卵黄蛋白原相关数据分析
对血浆样品进行卵黄蛋白原的测量,A、B两组的样品含量几乎没有。C组的样品卵黄蛋白原微量,分光光度计的显色效果差。无法得出数据。分析原因是因为幼鱼体内的卵黄蛋白原含量少,并且提取血液量有限,此实验方法无法对有限样品内的卵黄蛋白原进行检测分析。
4. 结果与讨论
4.1. 实验结果与存在的问题
利用睾酮和雌二醇进行雌雄辨别的最佳阶段为20 cm (310天)左右,雌性锦鲤的睾酮与雌二醇的含量略高于雄性个体。对于卵黄原蛋白检测方法适用于体型更大的阶段。
实验时应提前对样品做预实验,如数据的吸光度值过大,可将样品稀释,以吸光度值调节到0.1~3之间为宜。根据检测指标的多少,在前期血样采集时,应对血液采集量做详细计划,否则易导致血量采集过少,导致后期对卵黄蛋白原检测时,可固定的蛋白质量过少,各组测得的吸光度值之间差距过小,最终无法做出一个明显的对比。经过分析,锦鲤幼鱼无法一次采集足够的血液进行卵黄蛋白原的检测,如若测量锦鲤体内的卵黄原蛋白的含量,应该进行内脏组织液的提取。在我们所有试验条件下无法就现有的试验方法进行测量分析,并区分出雌雄。
4.2. 锦鲤体内相关性激素及分子
鱼类的性激素大多数都是类固醇激素,鱼类的性类固醇激素是一种脂溶性甾体激素 [4]。鱼类的性激素主要有促性腺激素(GtH),雄性激素睾酮(T)、11-酮基睾酮(11-KT),雌性激素雌二醇(E2)、雌酮,以及孕激素孕酮(P)、17α-羟孕酮、20β-双羟孕酮。在雌性的鱼体内还有一种与繁殖有关的蛋白质,卵黄蛋白原,仅仅由雌鱼产生,为胚胎和开口前的幼仔鱼的营养来源,对锦鲤仔鱼生长发育有不可取代的作用 [5],在锦鲤整个生长发育阶段也起着非常重要的作用。
4.2.1. 锦鲤卵巢合成的雌激素和孕激素(oestrogen)
在锦鲤的卵巢中可以合成四种类固醇激素:雌激素,孕激素,雄激素和皮质类固醇。锦鲤的雌性激素主要有雌二醇和雌酮,都是由卵泡颗粒细胞合成的类固醇激素,其中活性最强的为雌二醇,雌酮的活性在生理发育中较雌二醇的活性弱。合成雌激素的前身物质是雄性激素,因此在雌性个体中还有相当部分的雄性激素 [6]。在雌性个体中的雄激素以睾酮的含量为最多,雌性锦鲤体内的睾酮的代谢物与雌性锦鲤的第二性征发育和性行为有关。在雌性个体内还有由卵泡颗粒细胞合成和分泌的类固醇激素孕激素(progestergen),17α-20β-双羟孕酮,还有卵泡的特殊鞘膜细胞合成和分泌的孕酮,和17α-羟孕酮,在成熟的雌性个体中的各类孕激素含量达到最大值。
在未成熟的性腺卵巢中已经可以产生雌激素,产生的雌性激素可以反作用于卵巢,对卵巢起一个正反馈的作用促进卵巢的发育。因为雄激素是雌激素合成的中间产物,在幼体的体液中也会有雄激素的存在。睾酮为合成雌二醇的前体物质,在雌性的体内必然会有一定量的睾酮。睾酮有刺激个体生长发育的作用,在雌性锦鲤体内含量会高于同龄的雄性个体,在一定程度上使得雌性比雄性个体体型大。
在幼鱼的体内合成孕激素的量微乎其微可以忽略不计,所以在幼鱼雌雄的检测过程中不对锦鲤幼鱼的孕激素含量进行检测。
4.2.2. 锦鲤精巢合成的雄激素
在锦鲤的精巢中,也同样可以产生多种性激素,其中最为主要的性激素为类固醇激素雄激素(雄酮、雄烯二酮、睾酮以及11-氧睾酮),其中最为活跃的雄性激素为11-氧睾酮,11-氧睾酮在其他的硬骨鱼类中也是最为活跃的雄激素。在其他品种鱼类中,雄鱼体内也会产生孕激素,锦鲤体内孕激素的含量需要进一步研究证实。
在雄性的精巢中则没有雌性激素的出现,雌激素主要是由雌性体内的卵巢细胞和卵巢内的其他组织细胞产生。在所有的取样的锦鲤的血浆样品中都有雌二醇的出现。有实验曾经用雌二醇水环境对鲤鱼进行养殖,使得雄性个体的血液中出现卵黄蛋白原。经分析是因为进入雄性体内的雌二醇刺激肝脏产生了卵黄蛋白原 [7]。另一角度说明,雌二醇可以通过水环境进入锦鲤的体内并对其生长发育产生一定的影响。据此了解,可能锦鲤场饲喂锦鲤的饲料有雌二醇的添加,也可能为其他雌性鱼分泌进入水环境的雌二醇。养殖场为循环水养殖,水体有限,也在一定程度上使得雌二醇更容易进入雄性鱼体内。
4.2.3. 雌性产生的卵黄蛋白原
卵黄蛋白原为一种脂鳞聚糖蛋白,高分子量蛋白 [8]。由雌性的个体的肝脏产生,在卵巢处的细胞被吸收了用。卵黄原蛋白主要为胚胎发育提供水分,脂肪,蛋白质等其他的营养物质。
根据目前的研究,卵黄蛋白原的合成方式主要有两种,即为内源性卵黄蛋白原的合成与外源性的卵黄蛋白原的合成 [3]。大部分的脊椎动物和昆虫的卵黄蛋白原的来源有两种,还有少部分的动物只有一种卵黄蛋白原的来源,如属于多毛纲的沙蚕的卵黄蛋白原是由卵母细胞中的高尔基体合成,属于甲壳类的河虾则由卵母细胞中的粗面内质网合成卵黄蛋白原。那么,鱼类中的锦鲤,卵黄蛋白原的主要来源则是依靠外源性的卵黄合成。
锦鲤的卵黄蛋白原主要是在肝脏合成,合成后由血液运送至卵巢,由卵巢内的细胞吸收并利用。成熟的雌性锦鲤,对卵黄蛋白原的吸收利用速度较快,体内血液中卵黄蛋白原含量会略低。雌性锦鲤仔鱼因为卵巢为发育成熟,卵巢细胞的功能不全,对体内产生的卵黄蛋白原的利用率低,体内的卵黄蛋白原含量略高。雄性锦鲤体内血液中也有卵黄蛋白原的存在,卵黄蛋白原是在肝脏细胞中产生的,肝脏细胞在雌二醇存在的情况下,会受到刺激产生卵黄蛋白原,并释放进入血液,但是雄性个体没有可以吸收利用的卵黄蛋白原的组织器官,血液中也就会有一定含量的卵黄蛋白原,幼鱼同等年龄的雌雄锦鲤体内的卵黄蛋白原的含量相差不大,甚至雄鱼卵黄蛋白原的含量高于同龄雌鱼。
4.3. 锦鲤早期雌雄辨别研究的意义
4.3.1. 锦鲤产业发展
目前,锦鲤养殖业在我国已经开始发展形成了一定的规模。在观赏鱼养殖较为发达的沿海地区,例如广东、福建、北京等省市锦鲤养殖业已经趋于成熟,在内陆地区湖北、四川乃至东北等地锦鲤的养殖业也开始发展成型。养殖面积大小不等的各种各样的养殖场,几亩大小的养殖场,大多是个体经营,也有的是小集体投资经营,如广东的珠江三角洲地区、天津地区、山东地区及东北等地区的一些养殖场;面积较大的养殖场占地面积达数十亩至百亩之间,这种养殖场在天津、东北、广东珠江三角洲地区都有;国内一些企业的养殖场,能达到数百亩甚至逾千亩的规模;中外(港澳台)合资企业还会有更大型的锦鲤养殖场 [9]。
4.3.2. 性别分化特征
作为鲤科鱼类,锦鲤是拥有性染色体的,雌雄异体,在生长发育过程中没有雌雄转换的行为,雌雄的发育由遗传基因决定,环境对锦鲤雌雄分化没有决定性影响。虽然在一些鱼类的整个生长阶段中,受环境的影响会出现个体的雌雄转换,但在锦鲤的整个生长发育过程中不存在这种雌雄的转换,成熟期的锦鲤第二性征也非常明显,对于养殖来说,一般当岁的鱼(10 cm~30 cm)不是很容易分辨出来,进入成鱼阶段的锦鲤,可以从体形、头形、胸鳍、腹部、肛门、动作等外表来进行锦鲤的雌雄鉴别 [10]。
4.3.3. 早期鱼类雌雄辨别的意义
雌雄判别不仅在锦鲤养殖中有重要的意义,在其他鱼类的养殖中也是非常重要的。鱼类的雌雄个体之间,在生长速度、体型体色以及其它性状方面有非常大的区别。如罗非鱼是我国重要的经济养殖鱼类之一,雄性罗非鱼的生长速度要比雌性快30%左右,养殖全雄罗非鱼既可解决其过度繁殖问题,又可以加速生长,提高群体产量,降低生产成本 [11];黄颡鱼肉质细嫩,味道鲜美,营养丰富,含肉率高,无肌间刺 [12];主要分布于我国黄渤海近海区的半滑舌鳎,雌性生长较雄性快,且其生长规格可达雄性的2~4倍 [13]。半滑舌鳎的全雌化和罗非鱼、黄颡鱼的全雄化养殖,大大提高了经济效益。对具有单一性别优势的这些鱼类,除了需要加快在全雌化、全雄化繁殖和优势基因方面的研究进程,还需要尽早地将幼鱼进行雌雄辨别并进行分池养殖。在养殖中若可以实现全雌化、全雄化或高雌化、高雄化,便可以控制繁殖时间和繁殖数量从而提高鱼类养殖的产量和质量。
4.3.4. 锦鲤早期雌雄辨别的研究展望
锦鲤在国内已形成了一定产值规模,目前国内普通锦鲤的年生产力已经可以达数千万尾;并已引起国际间同行(特别是日本同行)的密切关注,在日本、台湾和香港的多家锦鲤专业杂志上都曾以大篇幅陆续对我国的锦鲤产业进行过报道,同时,近几年间日本、台湾、香港以及欧洲等地区陆续有同行前来我国考察和洽商。但国内绝大部分养殖场还是依靠进口鱼苗或者引进母本进行养殖生产,仅有少部分的养殖场已经开展自有锦鲤种质的选育和改良。
锦鲤在养殖场和拍卖会多是通过观察体型、颜色和行为来辨别雌雄。具有这种能力的人,一般为多年从事锦鲤养殖的技术人员或多年从事锦鲤选美的品鱼师。但是对于更小的锦鲤鱼苗这些专业人士进行雌雄辨别也是非常困难的。对于锦鲤尤其一些名贵品种,需要从小进行选育,雌雄辨别的越早越有利。这就对锦鲤雌雄辨别技术提出了更高的要求。针对锦鲤雌雄判别的分子标记技术和人工智能识别技术是有效的判别手段,目前本实验室也在进行相关的研究和突破。本实验通过性激素检测的方法对锦鲤的雌雄判别,大大提高了锦鲤雌雄辨别的准确性,对提高锦鲤的遗传育种水平和锦鲤场的生产效率具有一定的价值。
基金项目
青岛水族技术协同创新中心合作项目(6602418043);青岛农业大学唐王锦鲤联合研究中心合作项目(6602420119);国家自然科学基金(32073029);山东省“一流水产学科”建设经费。
参考文献
NOTES
*通讯作者。