1. 引言
银杏树,通常也被人们称为“白果树”,是目前已知银杏科银杏属中最古老的一种落叶乔木。因此,它也具有“活化石”、“长寿树”的美称 [1] [2]。银杏浑身是宝,《本草纲目》中最早记载了其在咳嗽、哮喘、遗尿、化脓性皮肤感染和肠道蠕动虫感染等疾病和治疗方面的疗效 [3]。随着现代技术的蓬勃发展,银杏叶中的黄酮类物质在降低心肌耗氧量、消除自由基、增强免疫力、增加脑血管流量等方面发挥作用 [4] [5] [6] [7] [8]。我国的银杏叶资源位于世界前列,为了充分发挥黄酮类物质的生理活性,需要发展一种快速、高效、准确地从银杏叶中浸提黄酮类物质的方法。
银杏叶中含有黄酮类物质、萜内酯类物质、酚类、生物碱、氨基酸、多糖类、微量元素等多种物质 [9] [10] [11]。目前,从银杏叶中提取的黄酮类物质中生理活性最好的组分为黄酮醇类物质,黄酮类物质的提取方法有溶剂法 [7],超声波辅助提取法 [12],微波法 [13]、酶解法 [14]、超临界流体提取法 [15]。本实验采用酶和超声波辅助提取银杏叶中黄酮类物质的方法,通过考察酶用量、酶解温度、酶解时间、超声温度、超声时间、液料比等因素对银杏叶中黄酮类物质提取率的影响,并对提取工艺进行优化。
2. 材料与方法
2.1. 材料与试剂
银杏叶;芦丁标准品:安耐吉试剂公司;无水乙醇:天津科密欧化学试剂有限公司;硝酸铝:国药集团化学试剂有限公司;亚硝酸钠:莱阳市双双化工有限公司;氢氧化钠:天津化学试剂有限公司。
2.2. 仪器与设备
FA114电子分析天平:上海海康电子仪器厂;CJ1513植物粉碎机:永康铂欧五金制品有限公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限公司;EU-K2-10超纯水机:北京卓信博澳仪器有限公司;KMH1超声波清洗仪:河南信诺仪器设备有限公司。
2.3. 实验方法
2.3.1. 原材料预处理
银杏叶置于烘箱中烘制4 h,设置烘箱温度为30℃,取干燥后的银杏叶置于植物粉碎机中进行粉碎,将处理完全后的银杏叶粉末置于避光处备用。
2.3.2. 芦丁标准曲线的绘制
向50 mL烧杯中加入准确称取的10.1 mg芦丁标准品,加入60%乙醇溶液10.0 mL,搅拌溶解后转移至50 mL容量瓶中,加60%乙醇溶液至刻度线,摇匀得0.202 mg/mL芦丁标准溶液。取洁净干燥的10 mL容量瓶6个,用吸量管分别准确量取1.0、2.0、3.0、4.0、5.0 mL芦丁标准溶液于10 mL容量瓶中,加60%乙醇溶液至5.0 mL。向上述6个容量瓶中依次加入0.3 mL 5% NaNO2溶液,摇匀后静置3 min,再加入10% Al(NO3)3溶液0.3 mL,摇匀后静置3 min,最后加入5% NaOH溶液3.0 mL,加60%乙醇溶液至刻度线,摇匀后的配制成浓度为0.00、0.02、0.04、0.06、0.08、0.10 mg/mL的芦丁标准溶液。静置10 min后利用紫外可见分光光度计,在波长为500 nm处测定其吸光度A。以芦丁标准溶液的浓度C为横坐标,对应吸光度A为纵坐标,绘制芦丁标准曲线。
2.3.3. 银杏叶中黄酮类物质的浸提与测定
准确称取5.0 g (精确到0.0001 g)银杏叶粉末于250 mL圆底烧瓶中,加入一定量的纤维素酶,按照一定的料液比加入一定量的体积分数为60%乙醇作为浸提剂,在一定温度的磁力搅拌器中,酶解一定时间,升温使酶彻底失活,在一定温度的水浴中超声浸提一定时间。浸提完成后,趁热进行减压抽滤。准确量取5.0 mL滤液置于10 mL离心管中离心处理,用移液枪依次移取0.0 mL、0.5 mL待测溶液分别置于2个洁净的10 mL容量瓶中,加入5 mL体积分数为60%的乙醇,向上述2个容量瓶中依次加入0.3 mL 5% NaNO2溶液,摇匀并静置3 min;0.3 mL 10% A1(NO3)3溶液;摇匀并静置3 min;3 mL 5% NaOH溶液,摇匀并静置10 min,显色后用体积分数为60%乙醇定容;将第1个容量瓶中的溶液作为参照,利用紫外可见分光光度计在500 nm处测定各组试液的吸光度值,并将结果代入标准曲线方程,计算试液中银杏叶中黄酮类物质的浓度。再按照下面公式(1),计算银杏叶中黄酮类物质的提取率。
(1)
式中:y——银杏叶中黄酮类物质的提取率%。
c——样液中黄酮类物质浓度mg/mL。
——浸提液总体积mL。
n——稀释倍数。
m——称取银杏叶质量g。
3. 结果与分析
3.1. 芦丁标准曲线的绘制
以60%乙醇溶液为空白对照样品,不同浓度的芦丁标准溶液为样品,利用紫外可见分光光度计,在500 nm波长处测定其吸光度值A。以芦丁标准溶液浓度c为横坐标,对应吸光度A为纵坐标,绘制得到芦丁标准曲线。结果如图1所示,芦丁浓度c (mg/mL)与吸光度A在相应浓度范围内具有较好的线性关系,线性回归方程为A = 12.2574c − 0.0272,R2 = 0.9994。
3.2. 银杏叶中黄酮类物质的最佳浸提工艺
3.2.1. 酶用量对黄酮类物质提取率的影响
准确称取5份5.0 g银杏叶粉末,分别按照加酶量为0.1%、0.2%、0.3%、0.4%、0.5%加入纤维素酶,按照料液比1:20,加入100 mL 60%乙醇溶液,在30℃下酶解2 h。酶解结束后在100℃下灭活,转移至超声仪中在40℃下超声萃取10 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察加酶量对银杏叶中黄酮类化合物萃取率的影响。
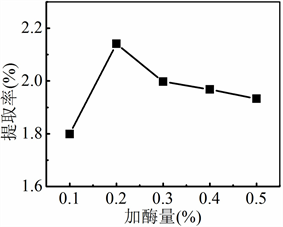
Figure 2. Effect of enzyme dosage on the extraction rate of flavonoids
图2. 酶用量对黄酮类物质提取率的影响
加酶量对银杏叶中黄酮类物质提取率的影响如图2所示,黄酮类物质的提取率随着纤维素酶的用量增加呈现先升高后降低的趋势。加酶量为0.2%时,黄酮类物质的提取率最高。加酶量过大时,水解作用受到抑制,萃取率降低。因此,最佳加酶量为0.2%。
3.2.2. 酶解温度对黄酮类物质提取率的影响
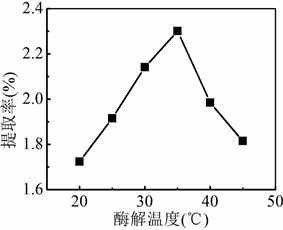
Figure 3. Effect of enzymatic hydrolysis temperature on extraction yield of flavonoids
图3. 酶解温度对黄酮类物质提取率的影响
准确称取6份5.0 g银杏叶粉末,按照加酶量为0.2%加入纤维素酶,加入100 mL 60%乙醇溶液,分别在20℃、25℃、30℃、35℃、40℃、45℃下酶解2 h。酶解结束后在100℃下灭活,转移至超声仪中在40℃下超声萃取10 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察酶解时间对银杏叶中黄酮类化合物萃取率的影响。
酶解温度对银杏叶中黄酮类物质提取率的影响如图3所示,黄酮类物质的提取率随着酶解温度的升高呈现先升高后降低的趋势。当酶解温度为35℃时,黄酮类物质的提取率最高。酶解温度超过35℃时,纤维素酶的活性降低,水解作用受到抑制,萃取率降低。因此,最佳酶解时间为35℃。
3.2.3. 酶解时间对黄酮类物质提取率的影响
准确称取6份5.0 g银杏叶粉末,按照加酶量为0.2%加入纤维素酶,加入100 mL 60%乙醇溶液,在35℃下分别酶解1 h、1.5 h、2 h、2.5 h、3 h和4 h。酶解结束后在100℃下灭活,转移至超声仪中在40℃下超声萃取10 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察酶解时间对银杏叶中黄酮类化合物的萃取率的影响。
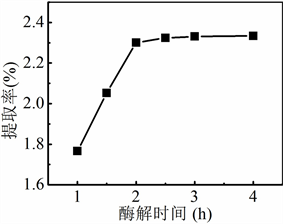
Figure 4. Effect of enzymatic hydrolysis time on extraction yield of flavonoids
图4. 酶解时间对黄酮类物质提取率的影响
酶解时间对银杏叶中黄酮类物质提取率的影响如图4所示,黄酮类物质的提取率随着酶解时间的延长呈现显著增加的趋势。当酶解时间超过2 h时,黄酮类物质的提取率增加不明显,因为酶解产物的浓度增大,抑制了水解过程。因此,较佳酶解时间2 h。
3.2.4. 超声温度对黄酮类物质提取率的影响
准确称取5份5.0 g银杏叶粉末,按照加酶量为0.2%加入纤维素酶,加入100 mL 60%乙醇溶液,在35℃下酶解2 h。酶解结束后在100℃下灭活,转移至超声仪中,分别在30℃、40℃、50℃、60℃和70℃下超声萃取10 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察超声温度对银杏叶中黄酮类化合物的萃取率的影响。
超声温度对银杏叶中黄酮类物质提取率的影响如图5所示,黄酮类物质的提取率随着超声温度的升高呈现先升高后降低的趋势。当超声温度为40℃时,黄酮类物质的提取率最高。可能是因为一些热敏性黄酮类化合物在高温下不稳定,使其溶液中的含量下降,测得的提取率下降。因此,最佳超声温度为40℃。
3.2.5. 超声时间对黄酮类物质提取率的影响
准确称取5份5.0 g银杏叶粉末,按照加酶量为0.2%加入纤维素酶,加入100 mL 60%乙醇溶液,在35℃下酶解2 h。酶解结束后在100℃下灭活,转移至超声仪中在40℃下,分别超声萃5 min、10 min、15 min、20 min和25 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察超声时间对银杏叶中黄酮类化合物的萃取率的影响。

Figure 5. Influence of ultrasonic temperature on the extraction rate of flavonoids
图5. 超声温度对黄酮类物质提取率的影响
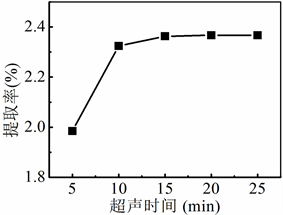
Figure 6. Influence of ultrasonic time on the extraction rate of flavonoids
图6. 超声时间对黄酮类物质提取率的影响
超声时间对银杏叶中黄酮类物质提取率的影响如图6所示,随着超声时间的延长,黄酮类物质的提取率呈现显著增加的趋势。当超声时间超过15 min时,黄酮类物质的提取率增加不明显,因为水解产物的浓度增大,抑制了水解过程。因此,较佳超声时间15 min。
3.2.6. 料液比对黄酮类物质提取率的影响
准确称取6份5.0 g银杏叶粉末,按照加酶量为0.2%加入纤维素酶,分别按照料液比为1:10、1:20、1:30、1:40、1:50和1:60 (m:v)加入60%乙醇溶液,在35℃下酶解2 h。酶解结束后在100℃下灭活,转移至超声仪中在40℃下超声萃15 min,萃取液按照“2.3.3”实验操作进行处理和显色,测定各试液的吸光度,考察料液比对银杏叶中黄酮类化合物的萃取率的影响。
料液比对银杏叶中黄酮类物质提取率的影响如图7所示,随着提取剂的用量增大,黄酮类物质的提取率显著提高。但从经济适用角度上考虑,并非液料比越高越好。因此,选择较优的料液比为1:40。
综上所述,通过实验探究和对实验数据的分析,得出最优的萃取工艺条件为0.2%的纤维素酶、酶解温度为35℃、酶解时间为2 h,料液比1:40,以体积分数为60%乙醇作为浸提剂,在35℃的条件下浸提15 min,此时银杏叶中黄酮类物质的提取率为3.05%。
4. 结论
本文主要通过控制变量法进行单因素实验,以芦丁标准品为参照物质,采用紫外可见分光光度法,建立了快速检测银杏叶中黄酮类物质的定量分析方法,并对银杏叶中黄酮类物质的提取条件进行筛选和

Figure 7. Relation between solid-liquid ratio and flavonoids extraction rate
图7. 料液比与黄酮类提取率的关系
优化。主要考察了酶用量、酶解温度、酶解时间、超声温度、超声时间等因素对银杏叶中黄酮类物质提取率的影响,最后得到较好的提取条件是:纤维素酶的用量为0.2%、酶解温度为35℃、酶解时间为2 h,料液比1:40,以体积分数为60%乙醇作为提取剂,在35℃的条件下超声提取15 min,此时银杏叶中黄酮类物质的提取率为3.05%。
基金项目
河南省高等学校重点科研项目(22B150024)、郑州师范学院大学生创新创业训练计划项目(DCZ2021015)、河南省大学生创新创业训练计划项目(202212949005)和郑州师范学院一流专业建设培育项目(YLZY-211609)资助。
NOTES
*通讯作者。