1. 引言
三阴性乳腺癌是指雌激素受体、孕激素受体和人表皮生长因子受体-2的表达均为阴性的乳腺癌,约占所有乳腺癌病理类型的15%~20% [1]。三阴性乳腺癌的预后差、复发转移率高、死亡率高,已成为近年来乳腺癌研究和关注的焦点 [2]。目前针对乳腺癌的治疗手段包括手术治疗、新辅助化疗、辅助化疗、内分泌治疗和靶向治疗等 [3]。因此,三阴性乳腺癌的早期诊断和及时有效的治疗是提高其5年生存率的关键 [4] [5],所以寻找敏感而特异性强的分子标志物、明确治疗的分子靶点以及正确的进行预后评估则是至关重要的任务。
miRNA是一类机体内源性表达的、长度在18~25个核苷酸的非编码小分子RNA,具有时空特异性,并参与基因转录后水平的调控,它通过与靶mRNA的3’非翻译区(3’UTR)不完全或完全互补配对,而引起靶mRNA的翻译抑制或降解 [6],这些仅占人类基因1%的miRNA分子,却调控着人类三分之一以上基因的表达、修饰、转录和翻译的过程 [7],因此,miRNA的发现可能成为极有应用价值的分子标志物,为恶性肿瘤的早期诊断和预后评估开启了一条新的道路。miRNA-200c是miRNA-200家族中最典型的明星分子,在胃癌、前列腺癌、结肠癌、卵巢癌等中低表达,与肿瘤的淋巴结转移、组织学分级等相关 [8] [9] [10] [11];E-cadherin是一种相对分子质量为120,000,依赖Ca2+的跨膜糖蛋白,其主要在上皮细胞表达,是上皮细胞间彼此连接的重要蛋白 [12] [13],其胞质尾部与α、β、γ和P120-catenin相互作用,构成E-cadherin-catenin复合物,复合物的稳定性及其与肌动蛋白纤维的连接形成黏附连接的核心,这对抑制单个上皮细胞的运动性和保持组织结构的稳态至关重要。大量研究证明E-cadherin的表达与肿瘤的侵袭、浸润、转移相关 [9] [11] [14]。
本项目用Realtime PCR检测miRNA-200c和E-cadherin在三阴性乳腺癌及其配对的癌旁正常组织中的差异表达,探索其表达与三阴性乳腺癌临床病理参数的相关性,用Spearman秩相关检测两者表达相关性,明确其在三阴性乳腺癌的发生、进展中的作用,为肿瘤的研究及治疗开辟新途径。
2. 材料与方法
2.1. 材料
选取2018年1月~2019年1月在武汉科技大学附属孝感医院进行手术并病理检查证实为TNBC的60例患者的组织及完整病例资料,同时选取60例切除肿瘤标本周围正常乳腺组织(距肿瘤边缘 ≥ 5 cm)作为对照组,所有的组织切下来后放入−80℃的冰箱保存,用于提取总的RNA。所有患者均为女性,年龄23~70岁,中位年龄50.4岁;患者术前均未进行新辅助化疗;所有患者免疫组织化学检测ER、PR及HER-2为阴性;对免疫组织化学检测HER-2为阳性(++)的患者同时进行FISH检测,排除HER-2阳性患者。临床分期:I期28例,II期23例,III期9例;组织学分级:I级28例,II级20例,III级12例;腋窝淋巴结转移患者21例,无淋巴结转移39例;Ki-67高表达46例,低表达14例。本研究通过医院医学伦理委员会批准,患者签署知情同意书。
2.2. 方法
2.2.1. 提取总的RNA
取100 mg组织放入液氮预冷的研钵中,将组织块迅速研磨成粉末,加入1 ml Trizol在1.5 ml离心管中充分匀浆,室温静置5 min;加入0.2 ml氯仿,振荡、静置、离心、取上清,再加入加入乙醇,萃取RNA,再用260 nm波长分光测定RNA浓度。
2.2.2. 试剂及仪器
实时荧光定量聚合酶链反应(RT-PCR)试剂购 自上海捷瑞生物工程有限公司,Prime Script反转录试剂盒、TRIzol试剂为日本TaKaRa公司产品,ABI7500 PCR仪为美国ABI公司产品,DNA Marker购自上海捷瑞生物工程有限公司,引物由上海捷瑞生物工程有限公司合成,SYBR Green I染料、RG-BOX紫外凝胶成像系统为美国Gene公司产品,ND-2000微量核酸定量仪购自美国Thermo Fisher公司;
2.2.3. cDNA的制备
取总RNA 2 μl,用反转录试剂盒(PrimeScript RT reagent Kit试剂盒)和随机引物合成cDNA。反转录反应体系:5 × Prime Script缓冲液4 μl,Prime Script反转录酶I 1 μl,反转录Primer Mix 1 μl,RNA 2 μl,随机6核苷酸引物1 μl, RNase Free dH2O补至20 μl;反转录反应条件:37℃ 15 min,85℃ 5 s,4℃保持。将反转录得到的cDNA −20℃保存备用。
2.2.4. miRNA-200c和E-Cadherin的表达
采用实时荧光定量PCR法(ABI 7500 PCR系统)检测miR-200c、E-cadherin mRNA表达水平,反应条件为95℃ 30 s,95℃ 5 s、60℃ 34 s共40循环。引物序列:miR-200c,F为5'-CCATGTGCTGGTGTGTGAA-3',R为5'-TGTGTTTTAGTTCAATGATGATCCA-3';内参β-actin,F:5'-GTGACGTTGACATCCGTAAAGACC-3';R:5'-GCTAGGAGCCAGGCAGTAATCT-3';E-cadherin,F:5'-AAGTGCTGCAGCCAAAGACAGA-3';R:5'-AGGTAGACCCACCTCAATCATCCTC-3',内参β-actin,F:5'-GTGACGTTGACATCCGTAAAGACC-3';R:5'-GCTAGGAGCCAGGCAGTAATCT-3';扩增完成后按仪器默认条件进行溶解曲线分析,为确定反应一致性,每次PCR重复3次。数据用RQ = 2−ΔΔCt表示相对定量结果,以U6作为内参,每个组织,样本独立实验三次。ΔCt = [Ct(miRNA) − Ct(U6)]或者[Ct(E-cadherin) − Ct(β-actin)],ΔΔCt = [ΔCt(癌) − ΔCt(正常)],2−ΔΔCt表示癌组织中的miRNA相对于正常组织的倍数差异,即miRNA在两组表达的相对差异。
2.2.5. 统计学原理
所有数据使用SPSS23.0软件进行。独立样本t检验分析TNBC及癌旁正常组织中miRNA-200c和E-cadherinmRNA的表达差异。以平均表达值作为截点将三阴性乳腺癌组织中miRNA-200c和E-cadherinmRNA的表达分为低表达组和高表达组,用卡方检验分别分析miRNA-200c和E-cadherin mRNA表达与临床病理指标的关系。Pearson相关系数检测结肠癌组织中miRNA-200c和E-cadherin mRNA表达的相关性,所有统计以P < 0.05有统计学意义。
3. 结果
3.1. 评价指标
miRNA-200c、E-cadherin以及内参β-actin的扩增效率各自生成,三基因扩增效率均为R2 > 0.995。三个基因扩增产物的溶解曲线均都只有一个峰,有很好的特异性,PCR产物均在高于84℃以上获得单一溶解峰,确定为目的产物。
3.2. miRNA-200c和E-Cadherin在不同组织中的表达比较
60例TNBC及癌旁正常组织中miRNA-200c、E-cadherin表达分别进行检测,结果表明与正常组织相比,miRNA-200c、E-cadherin在中表达TNBC明显降低,且差异具有统计学意义(P < 0.05,见图1)。
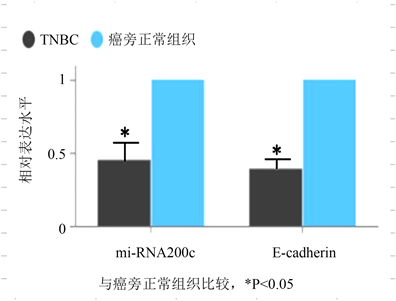
Figure 1. Expression of miRNA-200c and E-cadherin in TNBC and adjacent normal tissue
图1. miRNA-200c和E-cadherin在TNBC和癌旁正常组织中的表达
3.2. miRNA-200c和E-Cadherin在TNBC中的表达与临床病理学关系
分别以miRNA-200c和E-cadherin的平均表达值作为截断值,将表达值分为高表达组和低表达组得到计量资料。miRNA-200c和E-cadherin在TNBC中呈低表达,其表达值显著低于癌旁正常组织(P < 0.05,见表1);另外,miRNA-200c和E-cadherin的表达与肿瘤的组织学分级、淋巴结转移、分期显著相关(P < 0.05,见表2),而与患者的年龄、肿瘤大小、KI-67无显著相关性(P > 0.05,见表2)。

Table 1. Expression of miRNA-200c and E-cadherin in TNBC and adjacent normal tissues
表1. miRNA-200c和E-cadherin在TNBC和癌旁正常组织中的表达

Table 2. Relationship between miRNA-200c and E-cadherin expression and clinicopathology
表2. miRNA-200c和E-cadherin的表达与临床病理学之间的关系
3.3. miRNA-200c和E-Cadherin在TNBC中的表达的相关性
应用Pearson相关系数对TNBC中miRNA-200c和E-cadherin表达水平进行相关性分析,结果显示两者呈显著正相关(r = 0.521, P < 0.05)。
4. 讨论
肿瘤的发生及进展是多基因、多阶段的病理过程,转移是肿瘤的最恶性特征体现,也是肿瘤患者最主要死亡原因 [15];肿瘤的进展过程包括上皮–间质转化(EMT),基底膜的降解,肿瘤血管生成,肿瘤细胞迁移等过程,其中上皮间质转化在肿瘤的起始阶段起重要作用。
目前,研究表明miRNA在细胞增殖及侵袭、B细胞存活、胰腺分泌胰岛素、肿瘤发生及进展、转移方面研究是目前的热点。在乳腺癌中,miRNA在乳腺癌的发生、增殖、侵袭、转移中起着重要的作用 [16] [17] [18] [19]。miRNA-200 family又是miRNA中研究的热点,miRNA-200 family包括miRNA-200a、miRNA-200b、miRNA-200c、miRNA-141和miRNA-429五个成员 [20],miRNA-200家族在许多恶性肿瘤中存在差异表达,并与恶性肿瘤的临床病理参数相关,可用来指导病情评估及预后预测。来自意大利的Ceppi P [21] 等研究miRNA-200c在非小细胞肺癌中的表达及意义,结果显示:与正常组织相比,miRNA-200c在癌组织中的表达水平显著降低,且与组织分级、淋巴结转移呈负相关;Paterson EL [22] 等研究miRNA-200c结直肠癌中的表达情况,结果显示miRNA-200c在结直肠癌间质浸润早期呈表达下调,而在已经发生转移的部位呈高水平表达;miRNA-200c在胃癌、前列腺癌、卵巢癌等 [23] [24] [25] 肿瘤中均呈低表达,与肿瘤的淋巴结转移及肿瘤分期、组织学分级相关。本研究结果与上述研究一致,miRNA-200c的表达与TNBC的组织学分级、淋巴结转移、肿瘤分期相关(P < 0.05),肿瘤的淋巴结转移越多、分期越晚,肿瘤组织学分级越高,miRNA-200c表达越低,与肿瘤的大小、KI-67表达、患者年龄等没有显著关系;另外,Paterson E. L.等研究已经证明miRNA-200c可以阻止上皮间质转化(epithelial-mesenchymal transition, EMT)的改变,而EMT是肿瘤发生转移的基础 [26] [27] [28],鉴于此,我们可以推测miRNA-200c在三阴性乳腺癌发生及进展中可能扮演着重要作用。
E-cadherin是由cdh1基因转录成的依赖Ca2+的跨膜糖蛋白,其主要在上皮细胞表达,是上皮细胞间彼此连接的重要蛋白 [12] [13]。大量研究证明,E-cadherin在肿瘤的进展中减少及缺失,与肿瘤的淋巴结及远处转移密切相关 [14] [29] [30]。本研究与以上研究结论一致,E-cadherin的表达与TNBC的组织学分级、淋巴结转移、肿瘤分期相关(P < 0.05),与肿瘤的大小、KI-67表达、患者年龄等没有显著关系,我们发现肿瘤的淋巴结转移越多、分期越晚,肿瘤组织学分级越高,E-cadherinmRNA表达越低,我们推测E-cadherin在三阴性乳腺癌发生及进展中起负调节的重要作用。
另外,miRNA-200c和E-cadherin两者表达在TNBC中呈正相关,表明两者表达具有一致性,两者的表达均与肿瘤的分期、淋巴结转移、组织学相关,肿瘤的分期越高、淋巴结转移越多及组织学分级越高,两者蛋白表达强度越低,表明两者在肿瘤的转移中起重要的负调节作用,可能的机制是miRNA-200c通过调控E-cadherin的表达,引起肿瘤组织中钙粘蛋白表达降低,肿瘤紧密连接减少,肿瘤可以迅速向外转移;另外,肿瘤分化越低,肿瘤的侵袭性及越强,与周围组织连接越少,越容易向外浸润转移。
总之,miRNA-200c和E-cadherin可能均参与肿瘤进展,两者的表达与肿瘤的分期、淋巴结转移、组织学相关,属于肿瘤负调节分子,miRNA-200c可能通过调节E-cadherin的表达发挥作用,有待进一步实验研究。
基金项目
孝感市自然科学基金(XGKJ2019010014)。
NOTES
*通讯作者。