摘要: 目的:首先总结免疫介导的坏死性肌病(IMNM)的发病机制及其分型,其次总结该患儿的临床特点以及辅助检查,提高对该病的认识。此外免疫介导的坏死性肌病(IMNM)以肌酐激酶升高和组织学上散在坏死的肌纤维为特征,通常与抗信号识别颗粒(SRP)或3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)的自身抗体有关。通常进展迅速,病情严重,严重的病例常出现不良临床反应和复发。抗B细胞疗法常用于难治/复发病例,其次可能对与抗SRP抗体相关的IMNM患者更为显著。抗3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)阳性免疫介导的坏死性肌病(IMNM)常常由外源性物质诱发的,最常见的是他汀类药物,皮肤损害更常见。病理结果表明IMNMS的主要组织病理学表现为:肌纤维频繁坏死和再生,MHC-I在非坏死纤维中的可变表达和肌浆p62的恒定表达。在血清阴性的IMNM患者中,疾病可能伴随着癌症。治疗方面,利妥昔单抗或静脉注射免疫球蛋白等方法现在可以用于IMNM的治疗,而靶向治疗,如抗补体治疗,可能是难治性疾病患者的未来选择。
Abstract:
OBJECTIVE: To firstly summarize the pathogenesis of immune-mediated necrotizing myopathy (IMNM) and its staging, and secondly to summarize the clinical features as well as the ancillary in-vestigations in this child to improve the understanding of the disease. In addition, im-mune-mediated necrotizing myopathy (IMNM) is characterized by elevated creatinine kinase and histologically scattered necrotic myofibers, usually associated with autoantibodies against signal recognition particles (SRP) or 3-hydroxy-3-methylglutaryl coenzyme A reductase (HMGCR). Pro-gression is usually rapid and severe, with adverse clinical reactions and relapses often occurring in severe cases. Anti-B cell therapy is commonly used in refractory/relapsed cases and to a lesser ex-tent may be more significant in patients with IMNM associated with anti-SRP antibodies. An-ti-3-hydroxy-3- methylglutaryl coenzyme A reductase (HMGCR)-positive immune-mediated ne-crotizing myopathy (IMNM) is often induced by exogenous substances, most commonly statins, and skin damage is more common. Pathological findings suggest that the main histopathological mani-festations of IMNMS are: frequent necrosis and regeneration of myofibers, variable expression of MHC-I in non-necrotic fibers and constant expression of sarcoplasmic p62. In seronegative IMNM patients, the disease may be accompanied by cancer. For treatment, approaches such as rituximab or intravenous immunoglobulin are now available for IMNM, while targeted therapies, such as an-ti-complement therapy, may be a future option for patients with refractory disease.
1. 研究背景
免疫介导的坏死性肌病(IMNM)是2004年与多发性肌炎区别开来的一组炎症性肌病。少见,但病情进展迅速,分为三个亚类:抗SRP阳性IMNM、抗HMGCR阳性IMNM和血清阴性IMNM。在治疗方面,主要是利妥昔单抗或静脉注射免疫球蛋白等治疗方法,而靶向治疗,如抗补体治疗,可能是难治性疾病患者的未来选择。
2. 病例
主诉:自幼走路不稳来诊,复诊。
病史:4岁6个月学龄前女性患儿,因“自幼走路不稳来诊,复诊。”来院就诊,家长诉患儿自幼走路不稳定,症状无明显变化,能起床,能在辅助下上楼梯,一手辅助能蹲起,入眠好,精神可,大小便无异常。既往史家族史无特殊。
查体:体温正常,体重:14.0 Kg (16 Kg),精神可,消瘦状,呼吸平稳,面色正常,口唇红润,双肺无啰音,心音有力,律齐,腹软。肌肉菲薄,四肢肌张力可,活动自如,腱反射减弱,皮肤浅感觉、深感觉无异常;布氏征、克氏征及巴氏征阴性。
辅助检查:见图1、图2、图3、图4、图5。

Figure 1. Laboratory examination and imaging examination
图1. 实验室检查及影像学检查
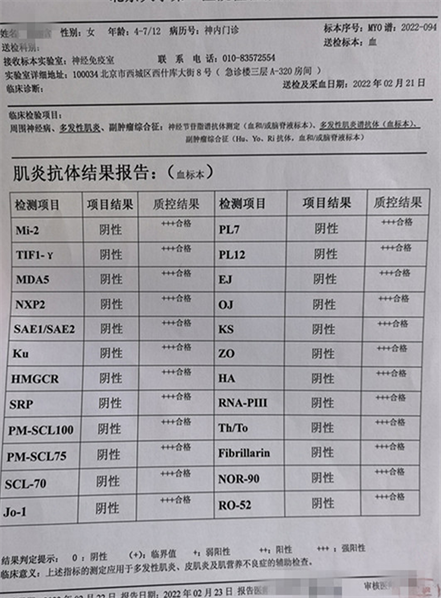
Figure 2. Results of myositis antibodies
图2. 肌炎抗体结果

Figure 5. Neuropathologic examination and diagnostic report
图5. 神经病理检查和诊断报告
神经病理检查和诊断报告:临床诊断:肌无力待查;结果符合轻微坏死性肌病样病理改变特点。
3. 概述
免疫介导的坏死性肌病是特发性肌病的一种类型,是以对称性,进行性亚急性或急性近端肌肉无力为特征的全身性自身免疫性疾病,还表现为极高的肌酸激酶水平(与肌肉坏死相关,同时是评估治疗效果的指标)、肌电图中上典型的刺激性肌病、无明显炎症反应的肌细胞坏死。肌肉活检可见肌纤维坏死和显著再生,没有淋巴细胞浸润,主要组织相容性复合物(MHC)I类表达不稳定,肌膜上C5B-9的可变沉积;巨噬细胞浸润参与修复过程。MRI下可见肌肉水肿,肌肉和筋膜炎症、脂肪浸润、肌肉纤维化和萎缩。治疗上主要应用人免疫球蛋白和免疫抑制剂。
IMNM的病理特征
1) 组织病理学早期特点明显的肌纤维坏死,无明显的炎性浸润,主要组织相容性复合物(MHC) I类表达,以及毛细血管上可变的补体沉积 [1]。
2) IMNM的关键病理标准即存在许多坏死的肌肉纤维作为主要的组织学特征,同时坏死的肌纤维表现出坏死和再生肌纤维不同阶段的特征(玻璃样的、颗粒状的、溶解的和再生的),血管周围炎性细胞稀疏或轻微;肌膜周浸润不明显。电镜下可以看到小血管或管毛细血管上的MAC沉积,肌膜内补体沉积明显,但内皮细胞内的管网状包涵体不明显 [2]。血清学抗体阳性的IMNM可通过血清学检查确诊,而血清学阴性的IMNM在排除药物和毒素诱发的肌病后,通过肌肉活检确诊 [1] [2]。
4. 分型
大多数IMNM与抗信号识别颗粒(抗-SRP)或抗-3-羟基-3-甲基戊二酰辅酶A还原酶(抗-HMGCR)肌炎特异性自身抗体有关,但仍有约20%的IMNM患者血清阴性。根据血清学特点将IMNM分为三个亚类:抗SRP阳性IMNM、抗HMGCR阳性IMNM和血清阴性IMNM [2] [3]。
4.1. 血清阳性的IMNM发病机制
1) 疾病活动度与抗体滴度相关 [2] [3]。
2) 抗SRP和抗HMGCR自身抗体与肌力和血清肌酸激酶水平相关,血清肌酸激酶水平是IMNM患者肌纤维坏死的生物标志物 [2]。
3) 肌细胞表位的作用:SRP或HMGCR可以体外存在于肌纤维表面,在那里它们可以被抗体直接靶向 [2]。
4) 抗HMGCR阳性的IMNM的遗传易感性:DRB1等位基因对抗HMGCR阳性的IMNM具有免疫遗传易感性 [4];这表明SRP或HMGCR表位优先由HLA-DR分子呈现给免疫系统,有利于破坏对这些自身抗原的耐受,导致自身抗体的产生 [2]。
5) 抗体的作用:被动转移抗HMGCR阳性IMNM或抗SRP阳性IMNM患者血清可诱发补体依赖性肌病,表明抗HMGCR和抗SRP自身抗体具有致病性。抗SRP和抗HMGCR抗体都能诱导肌纤维萎缩,并增加基因转录编码萎缩因子,如肌肉萎缩F-box蛋白(MAFBX;也称为ATROGIN 1)和E3泛素蛋白连接酶TRIM63 (也称为MURF1) [2]。
6) 补体依赖:研究表明将患者血清注入小鼠体内可造成小鼠肌肉力量下降,并伴有一定程度的肌纤维坏死和再生,将新鲜人体补体注入小鼠体内后,可增加患者血清的致病性,并且在肌肉组织内检测到IgG1和C1q的存在以及C5B-9、MAC的形成证明了经典的补体级联在血清阳性的IMNM患者中被激活,表明肌纤维坏死是抗体和补体依赖性的 [2] [5]。
4.2. 三种IMNM的不同特点
1) 抗SRP抗体阳性的IMNM:常出现肌外表现如间质性肺病、心肌炎等 [2]。容易出现面瘫、严重的肢体肌肉无力、吞咽困难、颈部肌肉无力、呼吸功能不全、肌肉萎缩等 [3]。肌纤维的坏死与再生与其他类型相比更加严重 [1]。
2) 抗HMGCR抗体阳性的IMNM:皮肤表现较其他类型多见 [6];与他汀类药物应用相关 [4] [7] [8],他汀类药物抑制HMGCR,会降低体外成肌细胞融合,并在体内损害骨骼肌再生,主要影响骨骼肌;并且可以诱导针对肌肉抗原的免疫应答 [2] [9]。他汀类药物也可以通过耗竭辅酶Q10引起线粒体功能障碍对肌纤维产生直接毒性作用 [10];血管周围炎性浸润与MHC-I的聚集表达比其他类型更频繁 [1]。肌肉病理常显示典型的免疫缺陷坏死性肌病 [8]。
3) 血清阴性的IMNM:发病机制尚不清楚,常无肌外表现,癌症患病风险增加 [2]。肌酸激酶常处于低水平 [3]。通常靠肌肉组织活检确诊。
5. 总结
IMNM根据血清学特点可分为三个亚类:抗SRP阳性IMNM、抗HMGCR阳性IMNM和血清阴性IMNM,是一种免疫介导的炎症性疾病,因此专家建议抗炎治疗和早期应用免疫抑制剂;抗体具有直接致病性,并且激活经典补体途径,导致肌纤维坏死,但缺少炎细胞的浸润,巨噬细胞的浸润参与肌纤维的修复,使得肌纤维明显再生。注射人免疫球蛋白抑制抗体的致病作用,会抑制疾病的进展,并且根据IMNM的发病机制的特点抑制补体的级联反应可能是治疗IMNM的新途径。
NOTES
*通讯作者。