摘要: 目的:探讨基于磁敏感加权成像(SWI)序列的支持向量机模型鉴别高级别胶质瘤与脑单发转移瘤的临床价值。方法:回顾性分析经病理确诊的103例高级别胶质瘤及脑单发转移瘤患者的SWI序列图像,在获得的图像上手动勾画感兴趣体积(Region of interest, ROI)并提取影像组学特征,所有病例按照70%:30%分为训练组和验证组,训练组用于筛选特征和建立机器学习模型,特征筛选由独立样本t检验,Mann-Whitney U检验和最小绝对收缩与选择算子(least absolute shrinkage and selection operator, LASSO)完成,特征筛选后的数据建立支持向量机(support vector machine, SVM)模型。应用受试者操作员特征(ROC)曲线评价模型的诊断性能,结果表示为曲线下面积(AUC),准确度、灵敏度、特异度,阳性预测率和阴性预测率。验证组数据用于进一步验证。结果:基于SWI序列建立了鉴别高级别胶质瘤及脑内单发转移瘤的诊断模型。训练组中,模型曲线下面积为0.951,诊断的特异度、灵敏度,准确度,阳性预测率及阴性预测率分别为0.889,0.800,0.857,0.889,0.800。验证组中模型曲线下面积为0.868。特异度、灵敏度,准确度,阳性预测率及阴性预测率分别为0.875,0.889,0.880,0.933,0.800。结论:基于SWI序列的支持向量机模型能有效提高术前鉴别高级别胶质瘤及脑内单发转移瘤的诊断效能。
Abstract:
Objective: To investigate the clinical value of a support vector machine model based on magnetic susceptibility weighted imaging (SWI) sequences to identify high-grade gliomas and solitary brain metastases. Methods: SWI sequences of 103 patients with pathologically confirmed high-grade gliomas and single brain metastases were retrospectively analyzed, and the volume of interest (ROI) was manually outlined on the acquired images and the imaging histological features were extracted, and all cases were divided into a training group and a validation group according to 70%:30%. Feature screening was done by independent sample t-test, Mann-Whitney U-test and least absolute shrinkage and selection operator (LASSO), and support vector machine (SVM) model was built on the data after feature screening. The diagnostic performance of the model was evaluated by apply-ing the subject operator characteristic (ROC) curve, and the results were expressed as area under the curve (AUC), accuracy, sensitivity, specificity, positive prediction rate and negative prediction rate. Validation group data were used for further validation. Results: A diagnostic model based on SWI sequences was established to discriminate high-grade glioma from intracerebral solitary me-tastases. In the training group, the area under the curve of the model was 0.951, and the specificity, sensitivity, accuracy, positive prediction rate and negative prediction rate were 0.889, 0.800, 0.857, 0.889, 0.800, respectively. The area under the model curve in the verification group was 0.868. The specificity, sensitivity, accuracy, positive predictive rate and negative predictive rate were 0.875, 0.889, 0.880, 0.933 and 0.800, respectively. Conclusion: The support vector machine model based on SWI sequences can effectively improve the diagnostic efficacy of preoperative identification of high-grade glioma and intracerebral solitary metastases.
1. 背景
高级别胶质瘤和转移瘤都是中枢神经系统中常见的恶性肿瘤 [1] ,术前诊断两者主要都是依赖影像学手段,但是高级别胶质瘤(High-grade glioma, HGG)与单发的脑转移瘤(brain metastases, BMs)在影像上鉴别相对困难 [2] 。两者都可以在常规的磁共振图像上表现为不规则的边缘明显强化,病灶中心多伴坏死与囊变,病灶周围片状的水肿区 [3] [4] 。但是这两种肿瘤治疗计划以及预后情况不同 [5] [6] ,所以术前鉴别高级别胶质瘤与转移瘤具有重要的临床意义。
近年来,随着磁共振技术的不断发展,磁敏感加权成像(susceptibility weighted imaging, SWI)技术在脑肿瘤的研究中越来越广泛。磁敏感加权成像主要是利用不同的组织间的磁敏感效应的差异以及血氧水平的依赖效应来进行成像。有研究证明,磁敏感加权成像能够充分显示不同组织的磁化率的差异,对微静脉结构、铁沉积、出血、钙化等一些物质的成像能力较好 [7] 。这些物质通常在磁敏感加权成像上表现为低信号结构。Park等 [8] 将这些低信号称为肿瘤内磁敏感信号(intratumoral susceptibility signal intensity, ITSS),根据其标准将肿瘤内部的低信号分为4级。0级:无低信号;1级:1~5个点状或细线状低信号;2级:6~10个点状或细线样低信号;3级:≥11个点状或线状低信号。目前有很多关于利用ITSS分级来区别胶质瘤与脑单发转移瘤的研究。但是ITSS分级是一种半定量的分析,其结果很容易因为主观选择而偏差。放射组学是从标准医疗成像中挖掘高通量的定量的图像特征,提取数据并将其应用于临床,可以提高诊断、预后和预测的准确性,在癌症研究中越来越重要 [9] ,放射组学现在已广泛的用于开发鉴别、预测和预后模型,尤其在脑肿瘤中的应用极为广泛 [10] 。因此我们假设通过放射组学能够充分挖掘磁敏感加权成像的图像信息,为鉴别高级别胶质瘤与脑单发转移瘤提供帮助。为此,我们开发了基于磁敏感加权成像序列的放射组学模型,以鉴别高级别胶质瘤与脑单发转移瘤。
2. 材料与方法
2.1. 资料与方法
回顾性分析2016年1月至2022年3月经山东省立医院收治的经手术病理证实的103例脑肿瘤患者的临床资料,其中高级别胶质瘤53例,脑内单发转移瘤50例。将所有患者按照7:3的比例分层随机抽样分为训练组(70%)和测试组(30%)。
2.2. 纳入标准
1) 手术病理检查证实为单发高级别胶质瘤或脑内单发转移瘤;2) 术前图像完备,包括CE-T1WI及SWI图像;3) 术前未经过放、化疗或口服药物等任何治疗。4) 图像质量较好,无伪影。
2.3. 检查方法
103例患者均采用西门子3.0T核磁共振及18通道头颅线圈进行检查。SWI序列参数:TR = 31 ms;TE = 7.2 ms;层厚2 mm,FOV 230 mm × 189 mm,层间距0 mm。CE-T1WI序列参数:TR = 1820 ms;TE = 10 ms;层厚5 mm,FOV 220 mm × 220 mm,层间距1 mm。用高压注射器经肘前静脉团注Gd-DTPA (剂量0.1 mmol/kg体重),注射流率3.0 ml/s,结束后立即推注生理盐水15 ml。
2.4. 勾画ROI
采集相关病人的SWI及CE-T1WI序列的DICOM格式图像并导入3D-Slicer软件(版本4.11.2),使用3D-Sliser对图像进行如下预处理:1) 重采样,所有图像重采样到1 mm3;2) 图像配准,将SWI的幅度图与CE-T1WI图共配准。在进行预处理后,根据CE-T1WI序列确定肿瘤的边界,ROI覆盖肿瘤的实体区域,包括肿瘤的囊变、坏死、出血。然后在将ROI转移到配准后SWI图上。胶质瘤的实性成分具有异质性,在不同序列上磁共振信号不同,如图1及图2所示。所有分割均由2名放射科医师共同讨论后确定瘤体边界,并手动分割肿瘤的体积感兴趣区。
图1为转移瘤患者一例,病灶位于左侧基地节区,(a~d)分别代表病灶CE-T1WI,T2-FLAIR,ADC图及SWI图,(e)图为在CE-T1WI序列上勾画ROI。
图2为高级别胶质瘤患者一例,病灶位于左侧额叶,(a~d)分别代表病灶CE-T1WI,T2-FLAIR,ADC图及SWI图,(e)图为在CE-T1WI序列上勾画ROI。

Figure 1. Image diagram of a patient with brain metastases
图1. 脑转移瘤患者影像示意图

Figure 2. Image diagram of a patient with high-grade glioma
图2. 高级别胶质瘤患者影像示意图
2.5. 特征提取
使用3D-Slicer软件从SWI图中提取特征。共提取851个体征,其中1) 形状和大小特征14个;2) 一阶统计量特征18个;3) 纹理特征75个;4) 小波特征744个。之后我们利用Z-Score方法对所有特征进行归一化处理。
2.6. 特征筛选及模型构建
为了减少无关和冗余信息,首先对训练集中的特征进行Kolmogorov-Smirnov检验,对于符合正态分布的数据进行独立样本t检验,对于不符合正态分布的数据进行Mann-Whitney U检验,选择P < 0.05的特征作为潜在的预测特征。然后使用最小绝对收缩和选择算子(LASSO)特征选择算法来进一步筛选特征。利用R语言结合筛选后的特征分别在训练组及验证组建立支持向量机SVM模型,使用应用受试者操作员特征(ROC)曲线和曲线下面积(AUC),灵敏度,特异度,准确度,阳性预测率和阴性预测率评价模型效果。
2.7. 统计学分析
使用SPSS22.0 (SPSS Inc.,芝加哥,伊利诺伊州,美国)评和R STUDIO (版本4.1.1,R包包括“e1071”,“pROC”,“glmnet”等)进行统计学分析。若P < 0.05,差异有统计学意义。
3. 结果
3.1. 临床资料
按照纳入标准,最终纳入103例患者,按照7:3的比例分层随机的原则分为训练组和测试组,其中训练组患者72例,测试组患者31例;训练组患者年龄(52.3 ± 6.2)岁,
男33例,女39例;测试组患者年龄(54.7 ± 7.3)岁,男14例,女17例;其中训练组高级别胶质瘤38例,转移瘤34例,测试组高级别胶质瘤16例,转移瘤15例。训练组与测试组患者的年龄、性别、肿瘤病理类型差异均无统计学意义(P > 0.05)。
3.2. 选择的特征
经过独立样本t检验及Mann-Whitney U检验,保留特征436个,P < 0.05。然后在使用最小绝对收缩和选择算子(LASSO)特征选择算法保留了7个放射组学特征。LASSO结果见图3,特征结果见表1。
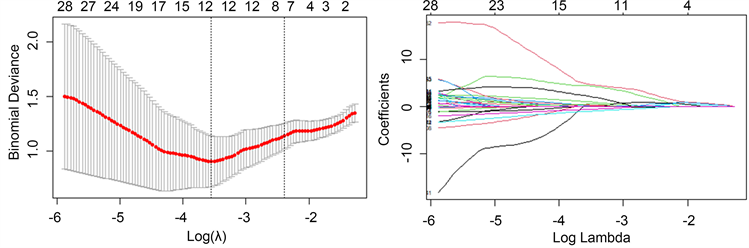
Figure 3. Schematic diagram of the least absolute shrinkage and selection operator (LASSO) feature selection algorithm
图3. 最小绝对收缩和选择算子(LASSO)特征选择算法示意图
3.3. 放射组学模型的性能
经过上述特征筛选,共筛选出7个放射组学特征,在此基础上建立支持向量机模型。AUC值在训练组为0.951。特异度、灵敏度,准确度,阳性预测率及阴性预测率分别为0.889,0.800,0.857,0.889,0.800。AUC值在验证组为0.868。特异度、灵敏度,准确度,阳性预测率及阴性预测率分别为0.875,0.889,0.880,0.933,0.800。模型效能结果见表2,训练组及验证组ROC曲线见图4。

Figure 4. Schematic diagram of model AUC
图4. 模型AUC示意图
4. 讨论
本研究表明,基于SWI的支持向量机模型在鉴别高级别胶质瘤及单发转移瘤具有良好的诊断性能。
脑内单发的转移瘤和高级别胶质瘤在常规MRI检查上的鉴别十分困难,由其当转移瘤发病史隐匿时,两者都可以表现为环形或者不规则的强化,周围大片状的水肿区。越来越多的功能序列用于鉴别高级别胶质瘤与脑内单发的转移瘤,如利用DWI,APT,ASL,MRS等序列成像 [11] [12] [13] [14] 。近年来,关于SWI应用于高级别胶质瘤与转移瘤的研究也越来越多。SWI序列可以显示出常规的MR序列无法显示的肿瘤内部的微量出血以及静脉结构,可以提供有关瘤内出血及肿瘤静脉血管的信息 [15] 。
恶性肿瘤由于肿瘤细胞代谢旺盛,耗氧量增加,所以肿瘤的新生血管增多以维持丰富的血液供应,但是恶性肿瘤的新生血管往往不够成熟,微血管容易破裂出血。高级别胶质瘤与脑内单发转移瘤均为恶性程度较高的肿瘤,但是高级别胶质瘤中由血管内皮细胞生长因子介导可以生成大量的肿瘤新生血管 [16] ,高级别胶质瘤中实质部分的血管增生程度以及范围大于转移瘤 [17] 。并且,胶质瘤具有很强的异质性,异型血管的生成共容易导致血管的破裂。所以,理论上高级别胶质瘤较转移瘤更容易出血。肿瘤供血动脉的生成往往同时伴有引流静脉的产生。静脉中含有丰富的脱氧血红蛋白,这些蛋白产生磁敏感效应在SWI序列中显示为低信号。有许多研究表明,借助SWI序列成像,发现高级别胶质瘤相对于转移瘤产生的静脉数目更多 [18] [19] [20] 。无论是血管破裂出血,还是静脉血管中的脱氧血红蛋白,在SWI序列上均为黑色的低信号。故SWI序列上高级别胶质瘤内部应该较脑单发转移瘤显示出更多的黑色低信号区。张志军等人利用SWI序列ITSS半定量评分鉴别胶质瘤与脑单发转瘤,研究发现高级别胶质瘤的低信号评分高于脑单发转移瘤 [21] 。Kim等人发现,和转移瘤比较,高级别胶质瘤中瘤内低信号更多,ITSS评分高者更多,利用ITSS 3级评分可以很好的鉴别高级别胶质瘤与脑单发转移瘤 [22] 。以上研究结果与我们的结论相一致。但是还有一些结果表明,利用SWI序列鉴别高级别胶质瘤与转移瘤主要依靠静脉数目差异,而ITSS评分无统计学意义 [23] [24] 。笔者认为造成这种研究差异的原因如下:1) ITSS是一种半定量的分析,主要统计点状及线状的明显低信号,而一些较为模糊的片状低信号被忽略。2) 目前关于SWI序列鉴别高级别胶质瘤于转移瘤的研究病例数均较少,多小于50例;且人工统计存在统计学偏差,尤其是当出血量和静脉数目比较多时,两者的低信号可能相互干扰。3) ITSS是利用低信号个数分级,遗漏了低信号形状以及信号强度等重要信息。在此基础上,笔者设想利用影像组学技术并扩大样本量能够弥补上述不足。
影像组学能够提取高通量医学图像将其转换为定量数据,相对于人工评判更为客观 [25] 。由于SWI图像上肿瘤边界模糊,故本研究先将CE-T1WI图像与SWI图像配准,然后在CE-T1WI图像上勾画全肿瘤的感兴趣区,最后将感兴趣区转移到SWI图像上。这样可以确保SWI序列上肿瘤全部信息被纳入。对比ITSS评分仅仅依靠数目划分等级,我们使用3D-Slicer软件提取了包括形状、强度、纹理以及小波变换特征在内的851个特征,充分的利用了两种肿瘤影像差异。结果表明,最后最优的7个特征均来自于经小波变化后的高阶特征,且均具有统计学差异(P < 0.05)。本研究利用筛选后的7个特征与支持向量机模型相结合,建立了高级别胶质瘤与脑单发转移瘤的鉴别模型。训练组及验证组的AUC值均较高,分别为0.951和0.868,且两组模型的敏感度,特异度及准确度等指标均较高。这与我们的设想相一致。
但是本研究仍然有一些局限性:1) 本研究的所有病例均来自于同一医院,属于单中心研究,今后应进一步扩大样本量并纳入其他中心的病例,使研究结果更具备普适性。2) 本研究以高级别胶质瘤与脑单发转移瘤的全肿瘤区为感兴趣区,但是两种肿瘤的瘤周环境也有较大的差异,今后应将瘤周区域也纳入研究。
综上所述,采用基于SWI序列的支持向量机模型能很好地鉴别高级别胶质瘤及脑内单发转移瘤,具有较高临床应用价值。同时相对于传统的ITSS半定量分析,本研究将SWI序列与影像组学技术结合,定量分析组学特征,为使用SWI序列鉴别高级别胶质瘤与脑单发转移瘤提供了一种新思路。
参考文献
NOTES
*通讯作者。