1. 引言
花鼠(Tamias sibiricus)是啮齿目(Rodentia)松鼠科(Sciuridae)的一种小型恒温哺乳动物,它的食物组成多样,因其具有数量多且遇见率高、地面活动易观察等特征,成为进行种群生态学及生境选择研究较为理想的动物 [1]。目前国内外对花鼠的研究主要集中在贮食行为、生境选择以及种群动态等方面,对花鼠肠道菌群的研究不多,对花鼠肠道菌群特征分析的研究是一个全新的方向。
动物的肠道内存在着几万亿的共生微生物群,这些群落被称为肠道菌群 [2]。肠道菌群由许多微生物群落组成,数量庞大、种类多样。它存在于动物消化道中,既是动物免疫屏障的重要组成部分 [3],更与动物的食物消化和营养摄入有着密切的联系 [4]。相关研究表明,肠道菌群与宿主的营养、代谢和免疫等方面相关,能够合成多种蛋白质,供宿主利用 [5],还与多种维生素的合成有关 [6];同时,能够降解和发酵一些碳水化合物,产生的能量可被宿主吸收和利用 [7];除此之外,一些正常的肠道微生物能与肠道上皮细胞接触,形成保护屏障,从而有效阻止病原菌的入侵,保障了宿主肠道内环境的稳定性 [8]。因此肠道菌群既影响着动物的生理状态,也可以视作动物生理状态的指征。
肠道菌群与宿主遗传和环境因素有关。研究表明,动物肠道菌群结构受季节、食性、外界环境等的影响。在啮齿动物的自然栖息地中,影响肠道菌群的因素有很多,其中环境因素被探究的较少。就野外观察来看,春夏季花鼠的食物种类较多。东北地区春季比夏季短暂,物候变化明显,夏季的食物种类略多于春季。秋季花鼠的食物种类较少,待红松种子成熟后,主要以红松种子为食。所以夏季对于花鼠来说是一个较为平稳的阶段,气候温暖,水分充足,生境中可供选择的取食对象也较为丰富。
花鼠处在整个森林生态系统中食物链的中间位置,它既是捕食者又是被捕食者,对整个生态系统的发展起到一定程度的影响,其肠道菌群的稳固也对森林生态系统的稳定起着重要作用。本研究拟了解花鼠夏季的肠道菌群结构,有利于从饮食结构、宿主、生理变化等多角度了解花鼠,对花鼠有更进一步的研究与了解,并为后续对森林与动物关系的研究打下基础。
2. 研究地点与研究方法
2.1. 研究地概况
本研究地选在凉水国家级自然保护区,位于黑龙江省伊春市带岭区南部,地理坐标是东经128˚48'8~128˚55'46,北纬47˚7'15~47˚14'38,保护区境内全为山地,海拔280~707.3 m,属温带大陆性夏雨季风气候,极端最低温达−43.9℃,极端最高气温达38.7℃,年平均气温在−0.3℃左右 [9]。
小兴安岭凉水自然保护区主要保护对象是以红松为主的温带针阔叶混交林生态系统 [10]。阔叶红松林的研究价值很高,是我国东北部东部山区典型的地带性植被,在我国东北温带针阔混交林植被类型中占有重要地位 [11]。根据当地的气候特征,我们将4~5月划为春季,6~8月划为夏季,9~10月划为秋季。
2.2. 研究方法
2.2.1. 花鼠粪便的收集
2017年7月在凉水国家级自然保护区原始红松林19林班内,随机放置捕鼠笼,笼内挂有棉花浸油制的诱饵引诱花鼠。共捕捉10只花鼠,并记录捕捉的时间、地点。在笼子下方放置干净的硫酸纸,及时收集花鼠粪便。将收集到的花鼠粪便放置于1.5 mL离心管中,用封口膜确保其密封性,然后置于−80℃的冷冻环境下保持花鼠粪便结构的稳定性以防止变质。
10个样本的序号按照时间顺序依次记录为tse001~tse010,t代表花鼠,s代表粪便,e代表本次样品采集,001~010代表每次捕捉的个体。
2.2.2. 粪样中DNA的提取和检测
选择采用OMEGA Soil DNA Kit (目录号D5625-01)试剂盒,试验方法严格按照该试剂盒上提供的方法执行。事先将SPW Wash Buffer加入无水乙醇稀释,同时,将加热器的温度调至65℃,70℃,90℃,然后进行粪便DNA的提取。收集得到DNA后,通过1.2%琼脂糖凝胶电泳检测DNA提取的纯度,再用紫外分光光度计对DNA进行定量。
2.2.3. PCR扩增及高通量测序
花鼠粪便中DNA的16s rRNA V3-V4的扩增及测序PCR扩增 [12]。16s rRNA V3-V4区引物(338F-806R)鉴定细菌的多样性。所设计的上游引物(Upstream primer)序列为5'-ACTCCTACGGGAGGCAGCA-3',下游引物(Downstream primer)序列为5'-GGACTACHVGGGTWTCTAAT-3'。
2.2.4. 16SrRNA文库的构建和高通量测序
文库的构建过程利用Illumina公司的TruSeq Nano DNA LT Prep Kit试剂盒。测序平台为Illumina MiSeq,在该平台进行2 × 300 bp双端(Paired-end)测序。
2.2.5. 生物信息分析
在剔除疑问序列后通过QIIME软件,使用UCLUST序列比对工具,对获得的序列按97%的序列相似度进行归并和OTU (Operational taxonomic unit,可操作分类单元)划分。OTU即为可操作单元,其数量可以代表样品物种的丰度 [13],丰度可以说明样品物种的丰富程度。
2.2.6. 物种多样性分析
β多样性分析主要是观测多组样本之间群落结构的差别与相似性。本研究的分析方法选择主成分分析(Principal component analysis, PCA)和NMDS分析(Nonmetric Multidimensional Scaling,非度量多维尺度分析),对群落数据排序后直接观察各组之间的差异。
2.2.7. 数据分析
采用独立样本t检验比较花鼠肠道菌群的差异。所有统计和分析均用SPSS Statistics 20.0软件分析,显著性水平设定为0.05。
3. 结果
3.1. OTU划分和分类鉴定
对测序获得的下机数据进行拼接、质控和嵌合体过滤后得到745,457条高质量有效序列(Effectivetags),reads的平均长度为450 bp。
全部样品共获得3094个OTU。根据97%的序列相似度作为划分阈值,并除去原始OTU丰度矩阵中的稀有OTU后,所有样品共注释到确定的11个门、21个纲、33个目、75个科、128个属。由于微生物种类繁多,并非所有的OTU代表序列都能鉴定到相应水平的分类学信息,把未被确定的OTU序列称之为Unclassified。在门、纲、目三个分类单元上,所有样本见OTU数目存在差异;在科、属、种三个分类单元上,各样本的OTU数目差距逐渐缩小。
从整体看来,tse003对应的柱体最高,说明它的OTU数量最多;tse009对应的柱体最矮,说明它的OTU数量最少;而其余样本对应的柱体大致相近,说明它们的OTU数目也较为相近(图1)。
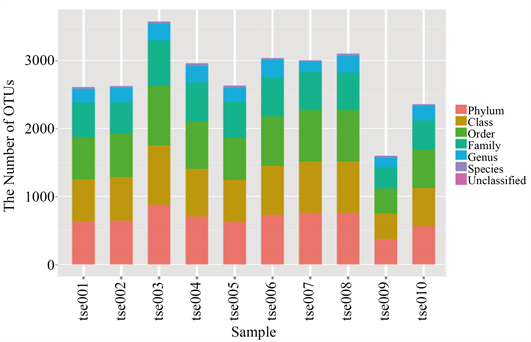
Figure 1. OTU classification and classification status identification results
图1. OTU划分和分类地位鉴定结果
3.2. 夏季花鼠肠道菌群的基本组成
根据OTU的地位鉴定结果,可以获得四个样本中花鼠肠道菌群在不同分类单元下的具体组成。
在以门分类水平,一共对应到11个菌门,分别是放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、脱铁杆菌门(Deferribacteres)、迷踪菌门(Elusimicrobia)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetes)、TM71菌门、柔膜菌门(Tenericutes)、疣微菌门(Verrucomicrobia)。优势菌门为厚壁菌门,平均相对丰度为43.98%。次优菌门为拟杆菌门和变形菌门,平均相对丰度依次为24.79%、23.90%。这三个菌门的丰度明显高于其他菌门,且三个菌门的丰度之和高达92.67%。其他菌门的平均相对丰度均小于3% (图2(a))。
在纲分类水平,一共鉴定到21个纲,包括拟杆菌纲(Bacteroidia)、芽孢杆菌纲(Bacilli)、梭菌纲(Clostridia)、疣微菌纲(Verrucomicrobiae)、放线菌纲(Actinobacteria)、黄杆菌纲(Flavobacteriia)、柔膜菌纲
(Mollicutes)、Coriobacteriia、4C0d-22菌纲、Chloroplast菌纲、脱铁杆菌纲(Deferribacteres)、迷踪菌纲(Elusimicrobia)、Erysipelotrichi菌纲、α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、ε-变形菌纲(Epsilonproteobacteria)、螺旋体纲(Spirochaetes)、[Brachyspirae]菌纲、TM7-3菌纲3。优势菌纲为梭菌纲、拟杆菌纲、γ-变形菌纲、芽孢杆菌纲,平均相对丰度分别为30.15%、24.77%、22.51%、12.80%。四个菌纲的丰度之和达90.23%以上。其余菌纲的平均相对丰度均在3%以下(图2(b))。
在目分类水平,有一个菌目暂未被确定,除此之外共注释到确定的32个目。优势菌目为梭菌目(Clostridiales)、拟杆菌目(Bacteroidales)、肠杆菌目(Enterobacteriales)、乳杆菌目(Lactobacillales),相对丰度分别为30.15%、24.77%、20.77%、11.34%,四个菌目的相对丰度之和为87.03%。其余菌目的平均相对丰度均在3%以下(图2(c))。
在科分类水平,共对应到65个确定的菌科。优势菌科为肠杆菌科(Enterobacteriaceae)、S24-7菌科、疣微菌科(Ruminococcaceae),平均相对丰度分别为20.77%、16.98%、10.85%,其余菌科的平均相对丰度均在3%以下(图2(d))。
在属分类水平,共注释到86个确定的菌属。优势菌属为乳杆菌属(Lactobacillus),在整体样本中的丰度最高,平均相对丰度为9.88%,其次为颤螺旋菌属(Oscillospira) (3.22%)和艾克曼菌属(Akkermansia) (2.47%) (图2(e))。
另外,将花鼠肠道菌群的各个分类水平的微生物类群进行数量统计,tse003最高,这说明该样本内的微生物类群多样性最高,相对丰度最大;tse007最低,说明该样本内的微生物类群多样性最低;其余样本柱体高度相差不大,说明各样本间微生物类群多样性较为相近(图3)。
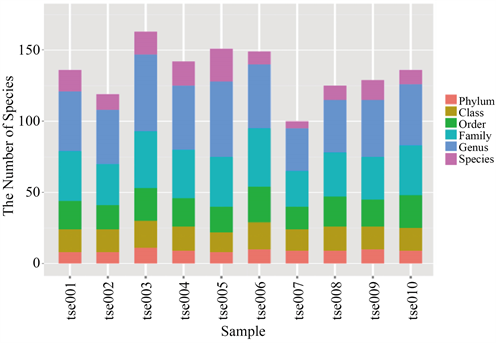
Figure 3. Number of microbial groups at each classification level
图3. 各分类水平的微生物类群数量
3.3. Beta多样性分析
3.3.1. 主成分分析
在属分类水平的群落组成结构进行主成分分析,tse009与其他样本间的距离最远,说明tse009与其他样本间微生物群落相似度最低,差异较大。其余个体距离接近,说明夏季花鼠肠道菌群结构大体相似。其中tse001和tse003,tse004和tse005之间的距离最为接近,说明两个样本间微生物群落相似度较高,差异度较小(图4)。
3.3.2. NMDS分析
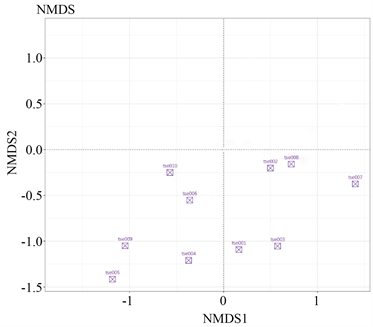
通过对花鼠肠道菌群样本距离等级排序,样本之间的距离越近,说明二者肠道菌群的结构相似度越高,差异越小。从图中可以看出不同样本花鼠肠道菌群距离相对集中,相似度较高(图5)。
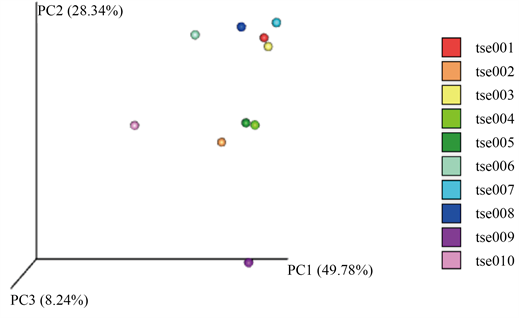 注:每个点代表一个样本,不同颜色的点属于不同样本,坐标轴括号中的百分比代表了对应的主成分所能解释的原始数据中差异的比例。
注:每个点代表一个样本,不同颜色的点属于不同样本,坐标轴括号中的百分比代表了对应的主成分所能解释的原始数据中差异的比例。
Figure 4. PCA analysis based on OTU abundance
图4. 基于OTU丰度的PCA分析
 (a)
(a) 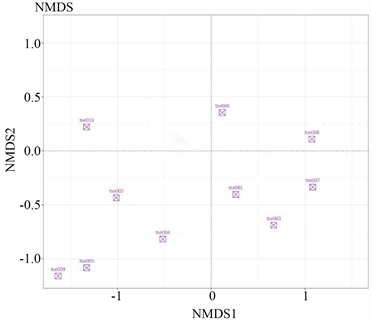 (b)注:图(a)为Unweighted条件下的非度量多维尺度分析的二维样本图;图(b)为Weighted条件下的非度量多维尺度分析的二维样本图。每个点代表一个样本,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小。
(b)注:图(a)为Unweighted条件下的非度量多维尺度分析的二维样本图;图(b)为Weighted条件下的非度量多维尺度分析的二维样本图。每个点代表一个样本,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小。
Figure 5. The differentiation of samples based on NMDS analysis
图5. 基于NMDS分析样品间的分化
4. 讨论
4.1. 花鼠肠道菌群的结构
在门分类水平,优势菌为厚壁菌门(Firmicutes),其次为拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)。精确到以属为分类单元时,优势属为乳杆菌属(Lactobacillus),其次为颤螺旋菌属(Oscillospira)和普氏菌属(Prevotella)。这个结果与Ren et al. (2017)在对北美红松鼠(Tamiasciurus hudsonicus)的肠道菌群研究一直,优势菌门同样为厚壁菌门、拟杆菌门和变形杆门 [14]。也与Maurice et al. (2015)对野生木鼠(Apodemus sylvaticus)的肠道菌群研究结果一致,优势菌门为厚壁菌门、拟杆菌门,乳酸属是野生木鼠肠道菌群中最为丰富的菌属 [15]。乳杆菌属目前含有180多种物种,该属内的物种可以有效地预防肠炎和肠道坏死;颤螺菌属物种常常出现于食草动物的肠道;普氏菌属的物种使肠道中浓稠的黏液降解,从而在发炎或生病时导致肠胃疼痛,使机体的免疫功能紊乱。因此,从分类学组成上来看,夏季花鼠肠道中既有对于花鼠自身有益的菌群,也有会导致内源性肠道感染的菌群存在。
4.2. 花鼠肠道菌群的多样性
主成分分析和NMDS分析的结果,都指向了整体夏季花鼠肠道菌群结构较为相似,说明夏季对于花鼠来说是一个比较平稳的时期。气候温暖,水分充足,生境中可以选择的摄食对象也较为丰富。但是,仍存在很多问题如天敌或生存环境的破坏使得花鼠的摄食对象相应减少,根据多样性指数统计这样更加直观的数据看来,存在这样的个别例子。
在夏季,虽然不同花鼠的肠道菌群开始各自发生变化,有的多样性相对高一些,有的相对低一些,但是从丰富度的整体水平看来,大体结果还是一致的。
5. 结论
夏季对于花鼠来说是一个较为平稳的阶段,气候温暖,水分充足,生境中可供选择的取食对象也较为丰富。夏季花鼠肠道菌群组内相似度较高。在门分类水平上,厚壁菌门(Firmicutes)为夏季花鼠肠道的优势菌;在属分类水平上,乳杆菌属(Lactobacillus)是优势属。
基金项目
中央高校基本科研业务费专项资金(2572021AW02)。
NOTES
*通讯作者。
1TM7是一种菌门的名称。
24C0d-2是蓝藻菌门中一种菌纲的名称。
3TM7-3是TM7菌门中的一种菌纲的名称。