1. 引言
小肠细菌过度生长(Small intestinal bacterial overgrowth,以下简称SIBO)与消化、内分泌、心血管等多种系统疾病相关 [1] ,目前已知相关的消化系统疾病有肠易激综合征、炎症性肠病、慢性肝病、幽门螺旋杆菌感染相关性胃炎等 [2] 。其发病率尚不明确,但SIBO在女人和老人中患病率较高,且SIBO在发展中国家中儿童的患病率有越来越高的趋势 [3] [4] 。
目前SIBO的治疗方案包括抗生素、益生菌和饮食调整,这些治疗方法均有不足之处。抗生素是目前SIBO的主要治疗方法。抗生素对肠道微生物的治疗没有特效性,其无差别地杀死肠道微生物,破坏肠道微生态平衡,不仅会引起耐药性和重复感染,还可能引起严重的急性肠道疾病 [5] [6] 。
益生菌也被认为是潜在的SIBO治疗药物。但是单用益生菌治疗SIBO效果较慢。王帅等 [7] 建议可以考虑联合抗生素治疗SIBO。Garcia-Collinot G.等研究表明 [8] 布拉氏酵母菌联合甲硝唑治疗系统性硬化症患者小肠细菌过度生长比单用甲硝唑更有效。然而,益生菌和抗生素的选择和疗程存在争议。除了使用益生菌和抗生素,改善饮食结构,减少发酵、高糖、低纤维食物的摄入也可以预防和辅助治疗小肠细菌过度生长 [3] [9] 。然而,这种方法的有效性和长期饮食调整对肠道菌群的影响尚不清楚。
因此,有必要探索出治疗SIBO的新方法。我们应该从肠道菌群开始寻找解决方案。肠道细菌之间存在着相互的共生关系。肠道细菌分解碳水化合物产生几种副产物,这些副产品被胃肠道吸收,最终通过呼吸呼出。这些副产品包括二氧化碳(CO2)、氢(H2)和甲烷(CH4) [10] 。作为肠道中的主要气体,甲烷和氢气有着千丝万缕的联系。甲烷气体的产生离不开氢气,甲烷菌利用其他微生物酵解产生的氢气和氨气以4:1的比例产生甲烷气,产甲烷菌消耗氢气,可有效减少肠道内氢气的积累,维持后肠的厌氧环境,促进肠道内菌群对于食糜的酵解,改善肠积气的同时可以促进肠道内营养物质的吸收 [11] [12] 。同时,产甲烷菌与硫还原菌争夺氢气,以减少硫化氢等有害气体的产生,而硫化氢对结肠癌有特殊的保护作用 [11] [13] 。
乳果糖甲烷呼吸试验能较好地反映氢气与甲烷的关系。与小肠近端吸出物培养、气敏胶囊技术等其他SIBO检测方法相比,乳糖甲烷呼气试验具有无创、安全、简单、重复性好等优点,在临床中得到了广泛应用。小肠近端吸出物培养是诊断SIBO的金标准,但由于其侵袭性和较高的程序要求,在临床中不太普遍。气体感应胶囊技术是Kalantar [14] 等人开发出的一项技术,其诊断SIBO的价值需要更多临床试验来评估。从氢呼气试验。到甲烷氢呼气试验是SIBO诊断方法的不断完善的过程。最初人们没有意识到甲烷的作用,仅以氢呼气试验用于SIBO的临床诊断,发现肠道中的某些细菌可以分解氢气从而导致氢呼气试验出现假阴性的结果,后又将甲烷气和氢气呼气试验联合来降低SIBO的漏诊率 [15] 。
因此,我们回顾了136例乳果糖甲烷氢呼气试验的结果,分析了甲烷、氢与SIBO的关系,探索了SIBO的治疗新方法。
2. 资料与方法
本病例对照研究在湖北省中医院脾胃病科进行。统计了从2018年11月至2021年1月完成乳果糖氢和甲烷呼气测试的所有18岁以上患者的数据。提取了以ppm、年龄和性别为单位的H2和CH4测量值。排除了有饮酒或吸烟史、糖尿病史或可能影响胃肠动力的神经系统疾病、近期使用抗生素(<4周)和既往胃肠道手术史的患者。
2.1. 检查方法
使用乳果糖作为诊断SIBO的底物。患者在本试验前1个月不应使用乳果糖、抗生素或其他可能影响胃肠动力的药物。测试前一天,禁食碳酸饮料、豆类、纤维谷物、糖和高纤维食物。测试前禁食12小时,并要求在测试前2小时刷牙。在测试期间,为了保持二氧化碳的产生恒定,要求静坐或静卧。
在摄入10 g乳果糖(溶解在200 mL自来水中)之前采集了一个基线呼吸样本。使用样品袋收集呼气末呼吸样本,并使用气相色谱分析仪(Quintron Breathtracker Digital Microlyzer SC, Quintron)分析H2和CH4的浓度。随后,每30 分钟收集一次呼吸样本,总共150 分钟。氢气和甲烷的含量均以ppm表示。在校准呼吸分析仪后绘制标准折线,该分析仪检测禁食对象呼吸中的氢气和甲烷水平。测量并记录不同时间点的氢气和甲烷水平,绘制氢气水平随时间变化的曲线和甲烷水平随时间变化的曲线。
2.2. 诊断标准
根据北美共识 [15] ,90分钟内氢气的基线上升≥20 ppm或任何时间内甲烷气的基线上升≥10 ppm诊断为SIBO阳性。
2.3. 统计学处理
数据资料用SPSS23.0统计软件分析:计量资料用
描述分析,计数资料用χ2检验,分析采用t检验。
3. 结果
3.1. 患者的人口统计
总结136例患者的人口学和临床参数,其中男性53例,女性83例。SIBO阳性组男性31例,女性37例,平均年龄52.6 ± 12.7岁。SIBO阴性组男22例,女46例,平均年龄54 ± 11.4岁。在本研究中,性别和年龄的差异无统计学意义(P > 0.05)。
3.2. 单例SIBO阴性和阳性患者甲烷和氢气产生的关系
随机选取1例小肠细菌过度生长阳性和阴性患者PPM曲线(图1、图2),SIBO阴性患者甲烷基线水平趋势高于氢气基线,甲烷PPM值在3~5之间,氢气PPM值在0~2之间。相反,SIBO阳性患者的甲烷基线水平趋势低于氢气基线,甲烷PPM值在0~1之间,氢气PPM值在15~35之间。
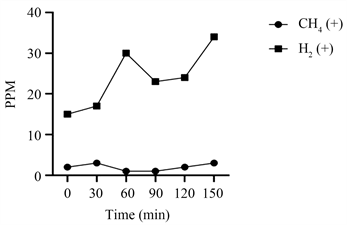
Figure 1. SIBO positive methane, hydrogen polylines
图1. 单例SIBO阳性PPM曲线图
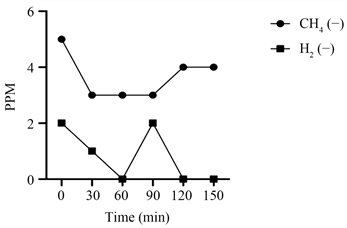
Figure 2. SIBO negative methane, hydrogen polylines
图2. 单例SIBO阴性PPM曲线图
3.3. 总体SIBO阴性和阳性患者中甲烷和氢气产生的关系
68例小肠细菌过度生长阳性患者(图3)在0、30、60、90、120、150分钟时的氢气平均PPM和甲烷气平均PPM折线没有相交,且氢气折线明显高于甲烷气折线。甲烷气体的含量随时间增加而增加,甲烷的PPM值在0~5之间,氢气的PPM值在17~35之间。
68例小肠细菌过度生长阴性患者(图4)在0、30、60、90、120、150分钟时,氢气平均PPM与甲烷平均PPM折线图相交,甲烷PPM折线高于氢气PPM折线。甲烷的PPM值在2~3之间,氢气的PPM值在3~6之间。
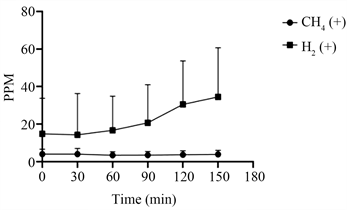
Figure 3. 68 SIBO positive methane and hydrogen PPM average
图3. 68例SIBO阳性PPM曲线图
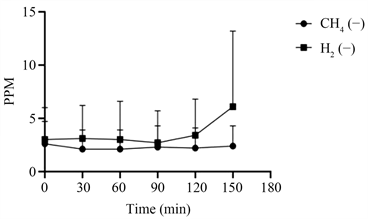
Figure 4. 68 SIBO negative methane and hydrogen PPM average
图4. 68例SIBO阴性PPM曲线图
3.4. SIBO患者中氢气和甲烷的产气情况
氢气PPM减去甲烷气PPM之间的差值反映了SIBO患者中氢气和甲烷生产的活跃状态。如表1所示:68例阴性患者H2-CH4的差值多为负值,提示所产氢气不及甲烷气活跃,68例阳性患者H2-CH4的差值多为正值,提示所产氢气较甲烷气活跃。

Table 1. Differences and mean values of differences between hydrogen and methane in SIBO patients
表1. SIBO患者中氢与甲烷的差异及其平均值
4. 讨论
如图1和图3所示,SIBO阳性患者肠道中氢气的含量远高于甲烷气体的含量,甲烷的PPM值在0~5之间。表1显示,97.06%的SIBO阳性患者产氢气比产甲烷气更活跃。提示SIBO阳性患者肠道菌群以产生氢气为主,相反,从图2和图4可以看出,SIBO阴性患者肠道中甲烷气体和氢气的产量相比,甲烷气的含量高于氢气,甲烷的PPM值在2~5之间。因此推断SIBO阳性患者缺乏产甲烷菌。
产甲烷菌的缺失严重影响肠道功能和健康。产甲烷菌与细菌之间存在互惠共生的关系,产甲烷菌可以阻止H2、甲酸盐和乙酸盐等的积累,防治其抑制新陈代谢和诱导细胞毒性酸化 [16] 。葛婷等 [11] [13] 发现IBS患者肠道中产甲烷菌数量比正常人群少,是IBS患者肠胀气的原因,而产甲烷菌通过利用氢气促进后肠发酵效率,减少肠积气 [17] 。史密斯甲烷短杆菌是能量收集的主要参与者,Camara等 [18] 发现史密斯甲烷短杆菌在严重急性营养不良儿童的肠道中严重减少,其认为史密斯甲烷短杆菌的缺失是肠道菌群失调的因素之一,添加史密斯甲烷短杆菌作为益生菌可能是恢复肠道共生的治疗方法的重要补充。
因此,我们可以通过培养适合产甲烷菌的肠道环境,增加小肠肠道中产甲烷菌的数量,从而降低小肠细菌过度生长的阳性率。
首先,中性或弱碱环境,能促进产甲烷菌的生长 [19] 。产甲烷菌体外培养较困难,属古菌界,肠道中优势产甲烷菌主要为史氏甲烷短杆菌。质子泵抑制剂抑制胃酸分泌,创造胃内中性或弱碱环境有利于产甲烷菌的生长。另外厌氧环境也有助于培养产甲烷菌。产甲烷菌属古菌界,是一种厌氧菌,部分益生菌如枯草杆菌、地衣芽孢杆菌等是专性需氧菌,有强大的夺氧能力,在生长过程中消耗大量的氧气,为厌氧菌的生长繁殖创造有利条件 [20] 。
因此质子泵抑制剂联合益生菌可以有效治疗SIBO。王洪艳的临床研究发现 [21] ,埃索美拉唑联合枯草杆菌二联活菌用于反流性食管的治疗,降低了疾病的复发率,并认为与降低了小肠细菌过度生长的阳性率有关。另有邵详稳 [22] 等发现用整肠生胶囊联合质子泵抑制剂能够有效改善慢性肝病患者肠道微生态环境,纠正菌群失调现象,其认为质子泵抑制剂通过改善胃肠道免疫、PH值、分解胃酸等可直接改善肠道中益生菌数量,从而恢复胃肠道微生态系统平衡。孙清华等 [23] 通过对埃索美拉唑联合益生菌(枯草芽孢杆菌和粪肠球菌)治疗反流性食管炎患者的研究中发现用药8周后治疗组的小肠细菌过度生长阴性率明显高于对照组,并且认为这是通过益生菌与有害细菌的竞争,产生抑制有害菌生长的代谢物来实现的。
对于缺乏产甲烷菌的SIBO阳性患者,质子泵抑制剂联合益生菌可为产甲烷菌的生长繁殖提供良好的环境,有效调节肠道菌群失衡,增加肠道细菌过度生长阴性率,从而达到治疗SIBO的效果。本研究创造性地为SIBO的临床诊断和治疗提供了新的思路。