1. 引言
烟叶(学名:leaf tobacco)是草本植物 [1] ,最早种植于南美洲 [2] ,现中国各省区广为种植。其作用有:1) 可作为烟叶工业使用的原料 [3] ;2) 全株也可作为农药除虫剂 [4] ;3) 也可作发汗、催吐剂、麻痹和镇静等医药作用 [5] [6] [7] ,这为开发烟叶提供了合理的理论依据。
目前通过查阅赵洪 [8] 、丁兴红 [9] 、化洪苓 [10] 等大量的文献发现,黄酮的功效应用于多方面,具有抗氧化能力及自由基消除能力,其抗氧化能力能阻止细胞衰弱以及癌细胞的产生。具有良好的抗辐射效果且预防效果优于修复效果 [11] [12] [13] 。很多天然植物均含有黄酮类物质且其含量较为丰富,如黄酮物质在烟叶中的含量就很丰富,但对烟叶黄酮的提取研究很少见。因此,本文通过一定的试验方法得出从烟叶中提取黄酮含量最高的试验条件。
现有的提取工艺有:一次提取、直接提取、辅助提取、热回流试验等等多种试验方法 [14] 。本次试验主要以凉山州德昌县的烟叶为试验材料,采取乙醇溶液热回流提取试验法提取黄酮,此试验方法是采用各种物质在有机溶剂中的不同溶解度,目前普遍采用从植物中提取活性组分,例如CH3CH2OH、CH3OH等。其具备纯度高、操作简便、成本低廉等优点,同时本试验还用纤维素酶作为辅助,可提高黄酮的吸光值。利用紫外可见分光光度计 [15] 测定其吸光值,此方法操作简便,结果准确率高,为纤维素酶法辅助提取烟叶中黄酮的研究提供一定的理论参考依据。
2. 制备与测试
2.1. 试验材料
烟叶、纤维素酶(EA, 50 u/mg)、无水乙醇(AR)、硝酸铝·九水(AR)。
2.2. 试验过程和试验方法
干燥:将约2 kg原料物烟叶的烟梗与烟叶分离,弃去烟梗,再将所剩烟叶放于真空干燥箱中50℃条件下干燥至恒重 [16] 。
粉碎过筛:将干燥后的烟叶立马放入陶瓷研钵中充分研磨,过筛40目,放于密封袋中备用。
酶解:称量4 g烟叶粉于烧杯中,加入40 mL纯化水,水浴加热到45℃,然后加入一定量的纤维素酶,45℃下水浴加热2 h,升温至85℃灭活15 min。
回流:向装有已酶解产物的烧杯中加入一定量的75%乙醇溶液于冷凝回流装置中加热回流3 h。
抽滤:将回流得到的萃取液放于抽滤装置中抽滤,收集其滤液。
蒸发浓缩:将收集所得的滤液置于洁净干燥的坩埚中蒸发浓缩至接近糊状。
溶液配制:将浓缩后的产物放入烧杯中,加入少量的75% CH3CH2OH溶液溶解再转移于50 mL的容量瓶中定容,多次振动后备用。称取25 g硝酸铝粉末,用蒸馏水充分溶解并在250 mL容量瓶中定容备用。
吸光值的检测方法:取1 mL样品溶液,加入2 mL的10% Al(NO3)3溶液,再加一定量的75%乙醇溶液定容至25 mL,接下来,在紫外可见分光光度计仪器中,以75%乙醇溶液为参比溶液,在波长为510 nm处测定产物的吸光值,得出吸光值的平均值。
本试验采用TU-1901双光束紫外可见分光光度计进行烟叶中黄酮的吸光值测试 [17] [18] 。黄酮提取工艺流程见图1。
3. 试验结果与分析
3.1. 单因素测定结果与分析
通过查阅唐功 [19] 、朱松 [20] 、陈建福 [21] 等关于纤维素酶对黄酮提取工艺的单因素试验的相关文献得出以下试验条件。
3.1.1. 纤维素酶用量对黄酮提取工艺的影响
精确称取5份4 g烟叶粉放入烧杯中,均加入40 mL蒸馏水,水浴加热至45℃,再分别加入1%、2%、3%、4%、5%的纤维素酶,其他条件不变,结果如图2所示。
由图2得,当底物一定,酶用量在0%~3%时,其黄酮吸光值与酶用量成正比;当酶用量增加到3%时,黄酮的吸光值为最大,其值为0.292;超过3%后,其黄酮的吸光值与酶用量成负比。这也许是因为当酶用量小于最适值时,酶解反应进行得不完全,黄酮类物质释放出的量较少,提取率较低,则吸光值较低,当酶用量达到最适值时,酶解反应则较完全,但当酶用量过多时,酶与烟叶粉末的作用已达到过饱和,酶解反应受到抑制,降低了黄酮的吸光度。此试验结果与刘全德等的关于纤维素酶辅助提取野马追中黄酮的研究 [22] 、陈建福等的关于纤维素酶辅助提取柚叶中黄酮的研究 [21] 、赵洪等的关于纤维素酶提取竹叶黄酮研究 [23] 等研究结果相似。因此,最佳的酶用量是3%。
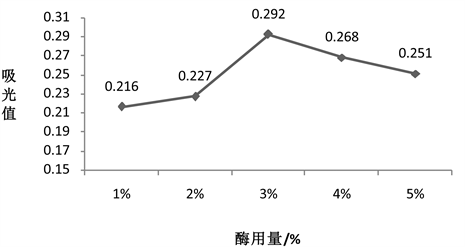
Figure 2. Effect of cellulase dosage on absorption value of flavonoids
图2. 纤维素酶用量对黄酮吸光值的影响
3.1.2. 酶解温度对黄酮提取工艺的影响
精确称取5份4 g烟叶粉放入烧杯中,均加入40 mL蒸馏水,水浴加热分别至40℃、45℃、50℃、55℃、60℃,再加入3%的纤维素酶,酶解2 h,其他条件不变,结果如图3所示。
由图3得,当底物以及酶用量一定时,随酶解温度的增加,黄酮的吸光值总体上出现先增后减的趋向;当温度在55℃时,黄酮的吸光值达到最大,其值为0.165。出现这种现象主要有两种原因:第一,在增加到最适温度前,水浴温度增加,酶活性增强,反应速度加快;第二,随着温度持续增加,纤维素酶的酶活性开始变小,甚至失活,同时由于黄酮不耐高温,温度过高会破坏已提取出来的黄酮的化学结构,从而导致吸光值降低;低于55℃时以第一种原因为主,高于55℃时以第二种原因为主。因此,最佳的酶解温度是55℃。
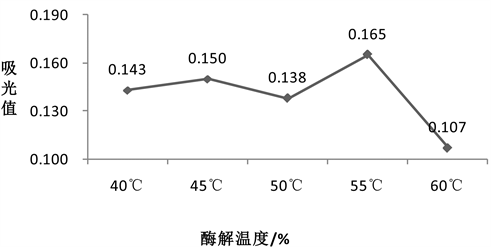
Figure 3. Effect of enzymatic hydrolysis temperature on absorption value of flavonoids
图3. 酶解温度对黄酮吸光值的影响
3.1.3. 酶解时间对黄酮提取工艺的影响
精确称取5份4 g烟叶粉放入烧杯中,均放入40 mL蒸馏水,水浴加热至55℃,再加入3%的纤维素酶,分别酶解0.5 h、1 h、1.5 h、2 h、2.5 h,其他条件不变,结果如图4所示。
由图4得,当底物、酶用量以及酶解温度一定时,吸光值随着酶解时间的增加呈现先增再减的趋向,当酶解时间为2 h时,黄酮的吸光值达到最大,其值为0.184。其原因是由于酶解时间较短时,酶与烟叶作用还未完全,酶活力不能得到体现,黄酮吸光值较低;当酶解时间逐渐增加时,黄酮吸光值增加,但达到峰值后,酶与烟叶接触面积不会继续增大,黄酮吸光值无法再提高,甚至出现了下降的现象。因此,最佳的酶解时间是2 h。

Figure 4. Effect of enzymatic hydrolysis time on absorption value of flavonoids
图4. 酶解时间对黄酮吸光值的影响
3.1.4. 料液比对黄酮提取工艺的影响
精确称取5份4 g烟叶粉放入烧杯中,均放入40 mL蒸馏水,水浴加热至55℃,加入3%的纤维素酶,酶解2.5 h,温度升高到85℃灭酶15 min,以料液比分别为1:10、1:14、1:18、1:22、1:26加入75%乙醇溶液于加热回流3 h。其他条件不变,结果如图5所示。
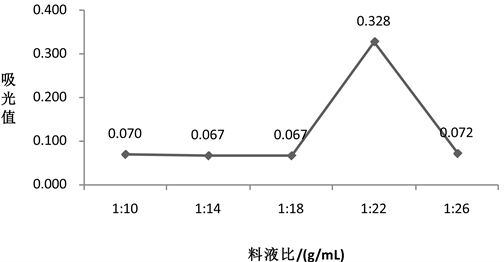
Figure 5. Effect of solid-liquid ratio on absorption value of flavonoids
图5. 料液比对黄酮吸光值的影响
由图5得,当底物、酶用量、酶解温度以及酶解时间一定时,黄酮的吸光值随着料液比浓度的增加呈现了先增后减的趋向;当料液比浓度增加到1:22时,烟叶中黄酮的吸光值为最大值,其值为0.328。出现这种现象的原因可能是当料液比较小时,即乙醇溶液的量较低,不利于黄酮类物质溶解,进而导致黄酮的吸光值低。而当料液比很高时,则其他杂质物质也会被提取出来,从而导致黄酮吸光值下降。因此,最佳的料液比是1:22。
3.2. 正交试验测定结果与分析
通过查阅薛晶晶 [24] 、蒋卫国 [25] 、刘春波 [26] 、王云云 [27] 等关于纤维素酶对黄酮提取工艺的正交试验的相关文献得出以下试验条件。
3.2.1. 纤维素酶酶解及有机溶剂提取条件的正交试验

Table 1. Factors and levels of orthogonal test
表1. 正交试验因素和水平

Table 2. Optimization of extraction of flavonoids from tobacco leaves by L9(34) orthogonal test
表2. 烟叶黄酮提取L9(34)正交试验优化结果
通过对以上四因素进行单因素试验,最终得出了纤维素酶提辅助提取烟叶黄酮的单因素试验的最佳试验条件,因此,以料液比、酶用量、酶解温度及酶解时间等4个测试因素进行L9(34)正交试验,以烟叶总黄酮的吸光值为评价指标,改善烟叶总黄酮提取条件,以确定其最佳提取工艺。表1和表2分别表示因素水平表和正交试验结果。
由表2的正交试验结果可知,对纤维素酶辅助提取烟叶中黄酮的影响因素为:A > C > B > D。除了酶解温度对烟叶黄酮的吸光值影响较小,其他三因素影响显著。由此得出,纤维素酶辅助提取烟叶黄酮的最佳工艺为A3B3C2D1,即料液比1:26,纤维素酶用量4%,酶解温度50℃,酶解时间2.5 h。
3.2.2. 验证试验
按照正交试验条件下得出的最佳工艺(即烟叶粉末中加入4%纤维素酶,在50℃条件下,酶解2.5 h,再加入料液比1:26的75%乙醇,回流3 h等)进行试验,测定烟叶黄酮的吸光度,并计算其RSD值,结果见表3。由表3可知,烟叶黄酮吸光值RSD值小于3%,说明通过正交试验得到的提取工艺条件合理可行。
4. 讨论
纤维素酶能破坏植物的细胞壁及其果胶,促进植物体内的物质排出 [28] 。有机萃取是一种利用各种物质溶解度的方法,它具有操作简单,纯度高,成本低廉等的特点。针对黄酮类物质常用醇类溶剂(如CH3CH2OH和CH3OH)作为提取剂。将纤维素酶与75% CH3CH2OH有机溶液结合,不仅对植物细胞壁起到很好的破坏作用,而且促进植物内物质的提取。
本单因素试验以及正交试验从烟叶中提取得到的黄酮吸光值均较低,其原因可能是在试验过程中烟叶粉末浪费较多以及浓缩后的产物没有充分溶解于75%的乙醇溶液中,从而造成最终测得的黄酮的吸光值偏低;本单因素试验组数较少,存在偶然性,不能很精确的找出最适试验条件。因此,在以后的烟叶提取黄酮最佳工艺研究中应进一步完善提取黄酮的试验条件,且进一步改善试验操作方法,最终选出最佳试验方案。
本正交试验,在烟叶提取黄酮的试验中,很好的解决了单因素试验过程中的浓缩后的产物没有充分溶解于75%乙醇溶液中的问题,即当萃取液蒸发浓缩接近至糊状时,边搅拌边用胶头滴管滴入少量的75%乙醇溶液,通过这样操作能很好的将残留在玻璃棒上面的萃取液的质量降到最低。
本实验虽与薛晶晶、蒋卫国、刘春波、王云云等关于纤维素酶对黄酮提取工艺的正交试验的相关实验的实验条件相同,但是并不是重复性实验,因为以上作者虽开展了提取黄酮的实验,并取得了很好的研究成果,但未提取烟叶中的黄酮,因此该实验并不是重复性实验。
本实验由于是在本科实验室里进行的,实验仪器和药品有限,因此就本科阶段而言,该提取方法是最优的一种方法。
5. 结论
通过纤维素酶辅助提取工艺,得出了烟叶中黄酮提取的最佳条件为:料液比1:26,纤维素酶用量4%, 酶解温度50℃,酶解时间2.5 h。
本试验的研究有望走出实验室规模阶段,走进工业化生产阶段,通过对烟叶中黄酮提取条件的研究,不仅找出了提取黄酮最佳提取工艺研究,而且从实验室阶段出发将成本控制在一定范围内,从而减少工业生产成本。
基金项目
四川省质量工程项目(川教函[2019] 31号);西昌学院两高课题(LGLZ201812);凉山州人力资源与社会保证局学术带头人重点项目(ZXS201802)。
NOTES
*通讯作者。