1. 引言
肺动脉压(PAP)是指血液通过肺循环在肺动脉血管上产生的侧压力,是临床血流动力学的重要指标 [1] 。与血压不同,血压是全身循环压力的指标,而PAP是肺循环压力的指标。它包括肺动脉收缩压和舒张压,分别反映右心室收缩功能和肺动脉血管阻力 [2] 。平均肺动脉压是指在完全收缩和舒张期间的平均肺动脉压力,通常用于评估肺动脉系统所经历的平均压力。作为右心室负荷后的指标,平均肺动脉压表示右心室在泵血时必须克服的阻力。由于平均肺动脉压增加,右心室负荷增加,导致右心室肥厚,最终导致右心衰 [3] 。根据美国国立卫生研究院的数据,诊断为特发性肺动脉高压(PH)后的平均生存时间为2.8年 [4] 。
随着肺动脉高压病例的逐渐增多,监测高危人群的肺动脉压力很重要,但这并不容易。肺动脉高压患者通常表现出呼吸困难、疲劳和胸痛的早期症状,这是许多其他疾病中常见的症状,如肺部感染和甲状腺功能减退 [5] 。此外,PAP的金标准测量方法——右心室导管插入术(RHC)是一种有创的且复杂的手术过程 [6] 。在执行该手术的过程中,利用X射线的透视,通过静脉将导管插入右心室和大血管 [7] 。显然,这种方法会给患者带来疼痛,并且很难预先进行评估疾病进展或治疗反应。此外,RHC有可能增加非心脏手术患者的心脏病风险 [8] 。因此,逐渐发展了肺动脉压监测的无创替代方案。例如,超声心动图已用于诊断肺动脉高压 [9] 。然而,超声心动图测量的准确性仍存在担忧 [10] 。对于肺动脉高压的早期诊断和监测疾病进展,仍然迫切需要一种非侵入性和方便的方法来预测和测量。
我们注意到光电容积脉搏波描记(PPG)在监测多种生理参数,特别是心血管参数方面的潜力 [11] 。PPG是一种非侵入性的皮肤表面测量方法,通过向组织发射绿光(500~560 nm)或低强度红外光,并用光电接收器收集透射或反射光。当心脏周期性跳动时,PPG测量血液光吸收的周期性变化,并给出随时间变化的血容量曲线 [12] 。这种低成本和方便的技术提供了有关心血管系统功能的丰富生理信息 [13] 。特别是,深度学习方法的最新发展提高了在疾病诊断中使用PPG的分类和预测准确性。Ward等人使用基于连续小波变换和卷积神经网络的PPG信号测试了一种用于正常血压和高血压分类和评估的深度学习方法,准确率达到92.55% [14] 。Lin等人使用径向血压波形和PPG脉搏指数作为多层感知器(MLP)分析方法的特征,该方法可以区分轻度、中度和重度阿尔茨海默病,准确率约为82.86% [15] 。Radha等人基于PPG信号和转移学习模型实现了4级睡眠阶段的分类。模型结构由域层、时间层和决策层组成。其中,时间层由LSTM堆栈组成,决策层由两层感知器组成。该模型表现出良好的性能,精度为76.36% ± 7.57% [16] 。
众所周知,人体的心血管系统在肺动脉高压的不同阶段会产生变化并带来某些影响,而PPG信号包含着丰富的有关心血管循环过程中的生理信息,这些生理参数蕴含着一定的内在联系。本文提出了一种利用光电容积脉搏波信号结合预训练卷积神经网络进行肺动脉压分类的新方法。它只需要从单个指尖位置采集的PPG信号作为输入,并避免了侵入性有创的测量肺动脉压。该模型的输出是不同阶段的肺动脉压,包括正常肺动脉压(NPP)、早期肺动脉高压(EPH)和肺动脉高压(PH)。PAP的识别和分类通过以下步骤实现(图1):1) PPG信号的筛选、提取和预处理;2) PAP信号提取对应阶段水平的标签;3) 将经过时频转换后的PPG信号输入卷积神经网络模型进行训练;4) 验证模型对不同阶段肺动脉高压的分类。该方法使用包含金标准RHC测量值的数据库进行评估,测试准确率达到97.78%。该方法使用PPG信号实现肺动脉高压的分类和诊断,为确定PAP风险提供了一种非侵入性的替代方法。如果与可穿戴设备进一步结合,将实现方便、频繁和长期的PAP监测。因此,患者的疼痛和风险将显著降低。
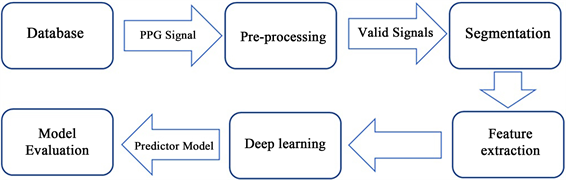
Figure 1. System workflow of the research methodology
图1. 本研究方法的工作流程图
2. 模型与方法
卷积神经网络
卷积神经网络(CNN)是一种前馈神经网络,通常由一个或多个卷积层(Convolutional layer)、池化层(Pooling layer)以及全连接层(Fully-Connected layer)等组成。与其他深度学习模型相比,卷积神经网络在图像处理方面有着较好的表现。其中,卷积层由若干卷积单元组成,其作用是提取输入的不同特征,更多层的网络能从低级特征中迭代提取更复杂的特征。通常在卷积层之后会得到维度很大的特征,池化层主要对卷积层学习到的特征图进行亚采样处理,有最大池化和平均池化两种,将特征切成几个区域,取其最大值或平均值,得到新的、维度较小的特征。而全连接层即把所有局部特征结合变成全局特征,用来计算每一类的概率。
自卷积神经网络问世以来,出现过许多对其经典结构进行优化的CNN网络。GoogLeNet就是其中一种,是Szegedy在2015年提出的预训练卷积神经网络结构 [17] 。GoogLeNet与AlexNet这类仅依靠加深网络结构进而改进网络性能的思路不同,它不仅在加深网络的同时,也在网络结构上进行创新,引入了Inception结构替代了传统卷积和激活函数的组合。这种网络结构的创新,更加有效地改善模型的分类性能。本文章基于GoogLeNet进行了部分改进,如添加Dropout层,对部分全连接层进行替换,以便更好匹配和训练本实验的数据,网络参数详见模型训练部分。
3. 数据集与实验流程
3.1. 数据集
本研究从PhysioNet组织 [18] 提供的多参数智能监测(MIMIC) II在线数据库中收集了250条记录的子集。MIMIC-II数据库是一个免费提供的去识别数据库,包含在重症监护室(ICU)治疗的成年患者的生理信号和多个参数记录。每项记录包括动脉血压、心电图、光电容积脉搏波、肺动脉压力等。通常,这些信号以8位或10位精度的125 Hz采样。采用侵入性RHC法记录PAP信号,指尖记录PPG信号。
用于模型训练的PAP类别标签是从PAP信号中提取出来的。根据世界肺动脉高压学术研讨会,肺动脉压水平根据其数值分为正常肺动脉压、轻度、中度和重度肺动脉高压。由于中度和重度肺动脉高压都有明显的呼吸困难症状,可归为一类。因此,本研究中PAP类别为正常肺动脉压、肺动脉高压早期和肺动脉高压。最终,共收集了216条记录,其中90条为正常肺动脉压,60条为肺动脉高压早期,66条为肺动脉高压。在选定的数据子集中,每个记录都包含同时从患者获得的PPG和PAP信号。图2显示了这两种信号的波形和用途。
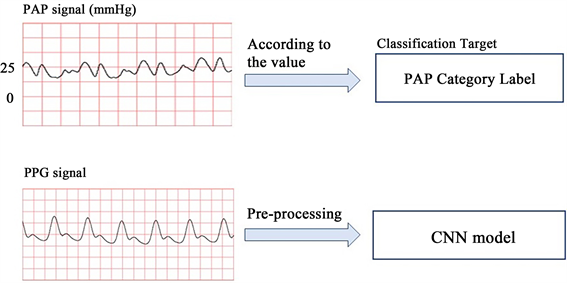
Figure 2. Waveform and purpose of the two signals
图2. 两种信号的波形和用途
3.2. 信号预处理
原始PPG数据在输入预训练卷积神经网络模型之前进行了预处理。原始PPG信号波形通常包含基线漂移、不同程度的失真和受运动影响的不规则段以及异常段。因此,为了最大化原始PPG信号中的有用信息,执行了以下几个预处理步骤。
首先,筛选并排除不正确和有缺陷的PPG片段。图3显示了合适的和排除掉不合适PPG片段的示例。然后,我们使用MATLAB (版本2021b)使用0.5~12 Hz四阶巴特沃斯带通滤波器进行滤波。这用于滤除干扰和噪声,并去除PPG的低频基线漂移。最后,使用最小–最大归一化将PPG信号的幅度归一化为[0, 1]。处理后的PPG信号被切成30 s段。图4显示了预处理前后PPG信号的比较。
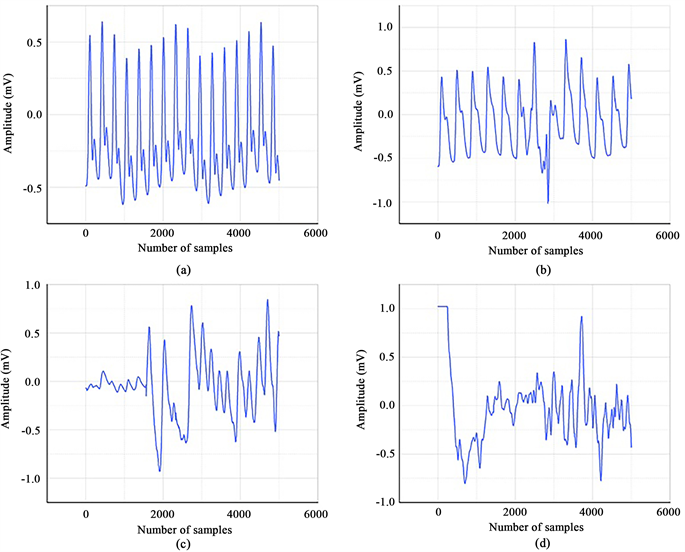
Figure 3. Example of (a) appropriate PPG segments. (b) (c) and (d) inappropriate PPG segments
图3. 合适的PPG段(a)和不合适的PPG段(b) (c) (d)
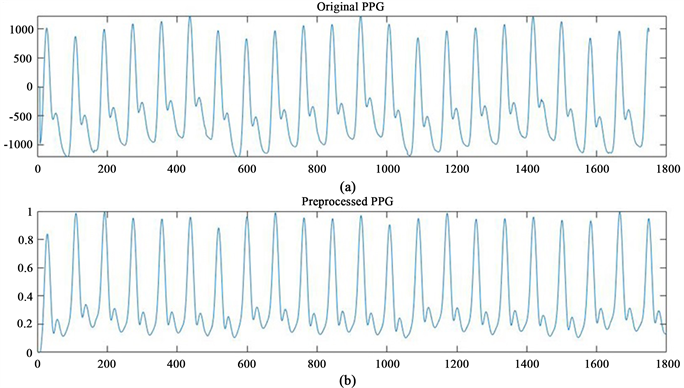
Figure 4. PPG signal before (a) and after (b) pre-processing
图4. 预处理前后的PPG信号
由于预训练卷积神经网络的输入为RGB图像,而预处理后的PPG信号为一维信号。因此,需要利用时频转换将一维信号转换为二维图像,通过连续小波变换将PPG信号转换为RGB图像,连续小波变换可以获得信号更为清晰的时频表示,每个PPG信号段转换为时频表示后称为尺度图,如图5所示。其大小为224 × 224 × 3。然后,将这些尺度图作为神经网络的输入来进行训练。
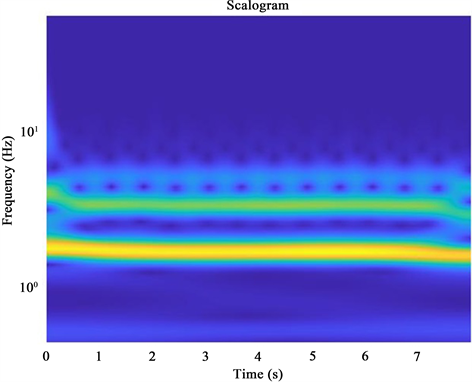
Figure 5. Example of Scalogram of PPG signal after time-frequency transformation
图5. PPG信号经时频变换后的尺度图
3.3. 模型训练
本研究的实验软硬件环境如下:CPU为AMD Ryzen5 4600H,GPU为Nvidia GTX,运行内存为16 G。系统为Windows10 64位。算法模型是基于Matlab的深度学习工具箱,并对GoogLeNet网络的部分参数进行修改,为了防止出现过拟合情况,添加dropout层。网络的部分设置如下:MiniBatchSize为15,MaxEpochs为20,ValidationFrequency为10。本实验数据集的75%为训练集,25%为测试集,均为随机抽选。
3.4. 评价指标
为了评估模型对三种不同阶段肺动脉压的分类效果,使用以下几项被称为金标准的模型评价指标:正确率(Accuracy, Acc)、敏感性(Sensitivity, Sen)、特异性(Specificity, Spe)、精确度(Pression, Pre)和F1分数。F1分数越接近1代表模型的分类效果越好。这些评价指标使用以下公式来进行计算,其中,TP (True Positive)是指正确识别阳性样本的个数;TN (True Negative)是指正确识别阴性样本的个数;FP (False Positive)是指错误识别阴性样本的个数,FN (False Negative)是指错误识别阳性样本的个数。TP、TN、FP、FN之和为总样本数。与常见的二分类问题不同,本实验为三分类,其混淆矩阵如图6所示。
(1)
(2)
(3)
(4)
(5)
Figure 6. The confusion matrix of indicators for (a) Multiclassification; (b) NPP; (c) EPH; (d) PH
图6. (a) 多分类问题;(b) 三分类中NPP;(c) 三分类中EPH;(d) 三分类中PH的混淆矩阵
4. 实验结果
为了体现模型的分类能力,进行多次肺动脉压分类实验,并对结果进行分析。混淆矩阵和数据见表1和图7。
结果表明,该模型具有较好的分类性能,三种状态下肺动脉压分类的平均准确率分别为100%、97.78%和97.78%。早期预测肺动脉高压的敏感性和特异性分别为95.71%和98.47%。预测肺动脉高压的敏感性和特异性分别为96.33%和98.32%,F1评分分别为0.9567和0.9638。F1分数越高,说明该分类模型的性能越好。从混淆矩阵可以看出,该模型能够清晰地区分正常肺动脉压和肺动脉高压,在对早期肺动脉高压和肺动脉高压的分类上出现了部分错误。这可能是因为对于一些人来说,早期肺动脉高压的症状与肺动脉高压相似,这种情况应该是模型进一步改进的重点。
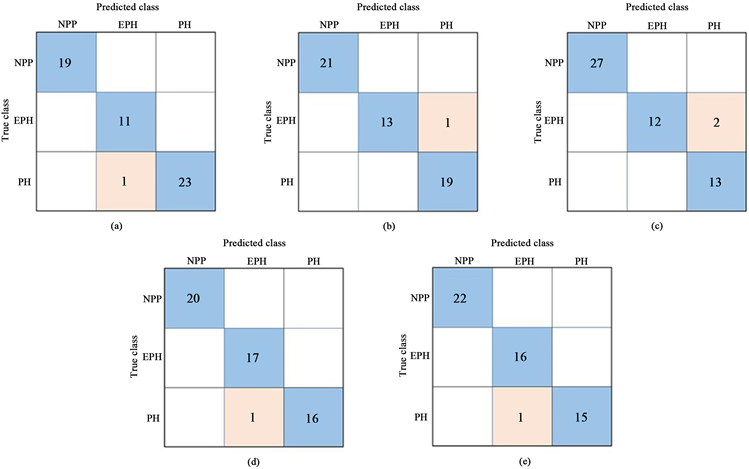
Figure 7. Confusion matrix of 5 independent training
图7. 5次独立训练的混淆矩阵

Table 1. Results for each classification category from multiple experiments
表1. 来自多个实验的每个分类类别的结果
本研究结果表明,PPG信号与肺动脉压密切相关,肺循环压力受肺血流、肺血管容积、肺血管张力控制。病理上,肺动脉压升高与心血管疾病 [19] 相关。如上所述,PPG可以实时准确地反映心血管循环系统的状态,为两者之间的关系提供了可靠的生理背景依据。同样,模型的结果也验证了这种关系。
本文提出了一种基于光电容积脉搏波信号和预训练卷积神经网络的肺动脉压自动分类方法。该方法为无创、实时评估肺动脉压提供了有效工具。它尤其适用于持续监测肺动脉压,而不会给患者带来疼痛和风险。此外,这种方法可以很容易地应用于临床,这是下一步的工作。一旦在更大的数据集中进行演示,就可以更准确地训练模型。该模型还将与可穿戴设备相结合,实现无创、连续、低成本、使用方便的肺动脉高压监测系统,具有成为家庭监测设备的巨大潜力。
5. 结论
综上所述,本文提出了一种基于光电容积脉搏波和预训练卷积神经网络的肺动脉压分类预测新方法。基于MIMICII的数据,仅使用脉搏波信号,使用GoogLeNet网络模型对肺动脉压进行分类,显示出较高的准确率。通过分析脉搏波信号的生理意义及其特征,建立了脉搏波信号与肺动脉压之间的内在联系。这种精度和灵敏度都是令人满意的。该方法在无创、方便诊断肺动脉高压事件方面具有广阔的应用前景。此外,可以开发更复杂的技术,从脉搏波信号中提取特征并优化深度学习模型,以提高肺动脉高压预测的性能,甚至可以与其他参数结合,实现对更复杂疾病的诊断。
基金项目
国家自然科学基金61805143、81700548。
NOTES
*第一作者。
#通讯作者。