1. 引言
追风伞为报春花科珍珠菜属植物狭叶落地梅(Lysimachia paridifornis var. stenoplla)和落地梅(Lysimachia paridiformis Franch.)的干燥全草,始载于《贵州民间方药集》,苗药名为“科土欧”(贵州黔东南州) [1] ,具有祛风通络、活血止痛之效,用于治疗风湿痹痛、四肢拘挛、半身不遂、小儿惊风、跌仆、骨折 [2] [3] 。中药汤剂历史悠久,一直是中医临床的常用形式,顺应时代发展,对汤剂的便携性需求迫切,现代人对中药的“净、便、小、惠、精、稳”更为追捧,配方颗粒顺势而生,满足需求的同时带来了质量和监管的考验,为解决这个关键的问题,中药饮片标准汤剂的研究拉开了序幕,标准汤剂是配方颗粒的物质基准,其重点在“基准”,而不是“物质” [4] 。
目前,《贵州省中药配方颗粒标准》中追风伞配方颗粒质量标准并未规定具体的含量测定项,陈婷等 [5] 建立了追风伞指纹图谱谱并测定了绿原酸、芦丁、异鼠李素-3-O-β-D-葡萄糖苷、木犀草素及刺槐素的含量。本研究制备15批追风伞饮片标准汤剂,建立HPLC分析方法测定金丝桃苷的含量,建立金丝桃苷成分特征图谱分析方法,并制定标准汤剂的质量标准。
2. 仪器与试药
2.1. 仪器
陶瓷保健壶(湖州市港钿工艺制作厂);旋转蒸发仪(上海亚荣生化仪器厂,型号:xiande-2000A+XDY);电子天平(杭州友恒称重设备公司,型号:AE200),电子分析天平(瑞士梅特公司,型号:XS205);真空冷冻干燥机(大连双瑞科技有限公司,型号:H10309);电热鼓风干燥箱(天津市泰斯特仪器有限公司,型号:101-1AB);铡刀。Waterse695型高效液相色谱仪(四元高压泵、自动进样器、柱温箱、PDA2998检测器、Empower色谱工作站);KQ5200DE超声波清洗器(昆山市超声仪器有限公司);BSG-24型电热恒温水浴锅(上海一恒科学仪器有限公司);METTLER TOLEDO XSE105DU型十万分之一电子分析天平(梅特勒公司)。
2.2. 试药
甲醇(色谱级,天津市北辰方正试剂有限公司,批号:20210701);乙醇(分析纯,天津市北辰方正试剂有限公司,批号:20210202);磷酸(分析纯,天津市科密欧化学试剂有限公司,批号:20190415);水为娃哈哈纯净水;其他试剂为分析纯。金丝桃苷对照品(批号:11521-201809,购于中国药品检定研究院);山奈酚-3-O-芸香糖苷(批号:112007-201602,购于中国药品检定研究院);15批追风伞(狭叶落地梅)由国药集团同济堂(贵州)制药有限公司提供,经贵州中医药大学植物栽培教研室魏升华教授鉴定为报春花科植物狭叶落地梅的全草。经实验室挑选、剪切、烘干等操作制成规范的追风伞(狭叶落地梅)饮片,1~15批次分别用S1~S15表示,药材信息见表1。15批追风伞(狭叶落地梅)配方颗粒标准汤剂批号为:20210601、20210602、20210603、20210604、20210605、20210606、20210607、20210608、20210609、20210610、20210611、20210612、20210613、20210614、20210615,1~15批分别用T1~T15表示(由实验室制备提供)。

Table 1. List of origin information of Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla)
表1. 追风伞(狭叶落地梅)饮片产地信息一览表
3. 方法与结果
3.1. 追风伞标准汤剂的制备
根据《中药配方颗粒质量控制与标准制定技术要求》,为确保追风伞(狭叶落地梅)配方颗粒在临床应用中与其标准汤剂的一致性,要求对标准汤剂进行研究,设计出最佳的追风伞(狭叶落地梅)配方颗粒标准汤剂提制备工艺为:称取同一批次追风伞(狭叶落地梅)饮片各100.0 g,共15份,称取同一批次追风伞(狭叶落地梅)饮片各100.0 g,共15份,一煎按比例1:16加水,分别浸泡30 min,武火煮沸,文火煎煮40 min;二煎按1:14加水,武火煮沸,文火煎煮30 min。分别用300目筛网固液分离,合并两次煎液,真空减压浓缩,冷冻干燥得干膏粉即为追风伞标准汤剂。
3.2. 色谱条件
本研究采用该技术测定含量。采用UltimateXB-C18 (250 mm × 4.6 mm, 5 μm)色谱柱;以0.1%磷酸水溶液为流动相A,以含甲醇的乙腈为流动相B,洗脱梯度为0~35 min,40%→52%B;35~40 min,52%→58%B;40~41 min,58%→100%B;41~45 min,100%B;流速:1.0 mL∙min−1;柱温:35℃;检测波长:296 nm;进样量:50 μL。
3.3. 溶液制备
供试品溶液制备:精密称取追风伞(狭叶落地梅)配方颗粒标准汤0.1 g,置50 mL锥形瓶中,加入70%甲醇溶液25 mL,回流30 min后,趁热过滤,滤液水浴蒸干,残渣用70 %乙醇溶液定容至5 mL,过0.22 μm微孔滤膜,即得。
对照品溶液的制备:精密称取金丝桃苷对照品适量,用70%甲醇溶液制成浓度为0.119 mg/mL的金丝桃苷对照品溶液,备用。
3.4. 方法学验证
3.4.1. 线性范围考察
分别精密吸取0.119 mg/mL的金丝桃苷对照品母液将其稀释浓度为0.005、0.020、0.060、0.083、0.101 mg/mL及母液0.119 mg/mL的金丝桃苷对照品溶液,分别精密吸取10 μL注入高效液相色谱仪中,测得峰面积,以峰面积为纵坐标(y),浓度为横坐标(x)绘制标准曲线。结果表明,在0.005~0.119 mg/mL范围内,吸光度值y与对照品的质量浓度x线性关系良好。y = 2E + 0.7x−33478,R2 = 0.9993。
3.4.2. 仪器精密度试验
精密吸取10 μL浓度为0.020 mg/mL的金丝桃苷对照品溶液,注入高效液相色谱,连续进样6次,记录其峰面积,计算其峰面积的RSD值。检测其精密度RSD值为0.54%,表明仪器精密度良好。
3.4.3. 重复性试验
取同一批追风伞(狭叶落地梅)药标准汤0.1 g,共6份,按“3.4”项下供试品溶液制备,每份精密吸取10 μL进样检测,测定其金丝桃苷的面积,计算含量和RSD值。结果表明,其含量的RSD值为1.39%。
3.4.4. 稳定性试验
精密称追风伞(狭叶落地梅)标准汤0.1 g,共1份,按“3.4”项下供试品溶液制备,分别于0、2、6、8、10、12 h时连续进样6次,测定金丝桃苷峰面积。计算其RSD值为1.25%,表明该样品在12 h内较为稳定。
3.4.5. 加样回收率试验
精密称追风伞(狭叶落地梅)饮片标准汤0.05 g,共6份,分别精密加入0.056 mg的金丝桃苷对照品,按“3.4”项下供试品溶液制备,分别精密吸取10 μL注入高效液相色谱,测定含量并计算其回收率。结果表明,其回收率范围在98.85%~101.27%,回收率RSD值为2.04%,符合实验要求。见表2。
3.5. 样品测定及指标计算
标准汤剂转移率(%) = (标准汤剂冻干粉指标成分含量 × 标准汤剂冻干粉量) ÷ 制备标准汤剂所用饮片指标成分总量 × 100%
出膏率(%) = 干膏粉重(g)/饮片称重(g) × 100%
按“3.4”项下方法,制备15批追风伞标准汤剂供试品溶液,按“3.2”项下色谱条件进样测定,计算金丝桃苷含量和转移率。结果见表3。

Table 2. Hyperoside sample recovery test (n = 6)
表2. 金丝桃苷加样回收试验(n = 6)

Table 3. Transfer rate of Hyperoside in 15 batches of Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla) formula granules standard soup
表3. 15批批追风伞(狭叶落地梅)配方颗粒标准汤金丝桃苷转移率
3.6. 特征图谱的建立
3.6.1. 对照品溶液的制备
取金丝桃苷对照品和山奈酚-3-O-芸香糖苷适量,用50%乙醇溶液配置成浓度为0.0139 mg/mL和0.0125 mg/mL的对照品溶液,备用。
3.6.2. 供试品溶液的制备
精密称取追风伞(狭叶落地梅)配方颗粒标准汤剂0.1 g,置50 mL锥形瓶中,加入50%乙醇溶液20 mL,精密称重,超声45 min后,精密称重,用50%乙醇溶液补足失重,过滤,滤液水浴蒸干,残渣用50%乙醇溶液定容至10 mL,过0.22 μm微孔滤膜,即得。
3.6.3. 色谱条件
采用UltimateXB-C18 (250 mm × 4.6 mm, 5 μm)色谱柱;以0.1%磷酸水溶液为流动相A,以含甲醇为流动相B,洗脱梯度为0~7 min,10%→16%B;7~22 min,16%→25%B;22~42 min,25%→37%B;42~47 min,37%B;47~57 min,37%→42%B;57~65 min,42%→36%B;65~70 min,46%B流速:1.0 mL∙min−1;柱温:35℃;检测波长:300 nm;进样量:10 μL。
3.6.4. 方法学验证
1) 仪器精密度试验
精密称取追风伞(狭叶落地梅)配方颗粒标准汤0.1 g,置50 mL锥形瓶中,按“3.4”项下供试品溶液制备,按照“3.2”色谱条件项下连续进样6针,记录色谱图。以5号峰为参照峰计算各共有峰相对保留时间、相对峰面积及其RSD值。结果表明,各共有峰相对保留时间RSD值在0.01%~0.66%之间,相对峰面积RSD值在0.37%~2.68%之间,说明仪器精密度良好。
2) 方法重复性试验
精密称取追风伞(狭叶落地梅)配方颗粒标准汤0.1 g,置50 mL锥形瓶中,共6份,按“3.4”项下供试品溶液制备,按照“3.2”色谱条件项下进样检测,记录色谱图。以峰5为参照峰,计算各共有峰相对保留时间、相对峰面积及其RSD值。结果表明,6份供试品共有峰相对保留时间RSD值在0.01%~0.65%之间,相对峰面积RSD值在0.84%~2.90%之间,符合实验要求。
3) 样品稳定性试验
精密称取追风伞(狭叶落地梅)配方颗粒标准汤0.1 g,置50 mL锥形瓶中,共1份,按“3.4”项下供试品溶液制备,分别在0、2、4、6、8、10、12 h时按照“3.2”色谱条件项下进样检测,记录色谱图,以5号峰为参照峰计算各共有峰相对保留时间、相对峰面积及其RSD值。结果表明,各共有峰相对保留时间RSD值在0.05%~0.57%之间,相对峰面积RSD值在0.76%~2.86%之间,说明供试品在12 h内稳定。
3.6.5. 标准汤剂特征图谱分析
15 批不同批号麦冬饮片制成的标准汤剂,按“3.4”项下方法制备供试品溶液,按“3.2”项下色谱条件测定,获取15批标准汤剂特征图谱,见图1。以5号峰为参照峰,计算各特征峰与参照峰的相对保留时间,相对保留时间RSD% < 0.19%,表明仪器精密度良好。
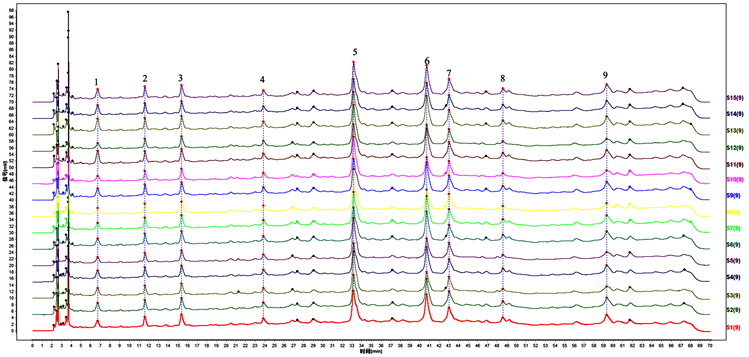
Figure 1. Characteristic map of formula granule standard soup of 15 batch Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla)
图1. 15批追风伞(狭叶落地梅)配方颗粒标准汤特征图谱
供试品溶液色谱峰应呈现9个特征峰,并与标准汤对照色谱中的9个特征峰相对应,其中8号峰(金丝桃苷)与11号峰(山奈酚-3-O-芸香糖苷)与相应对照品参照峰保留时间对应。见图2。
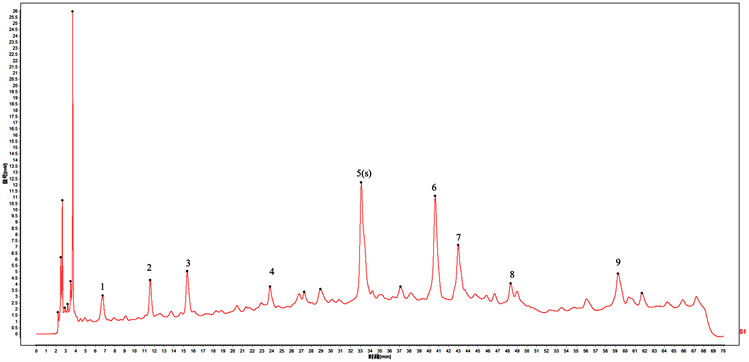
Figure 2. Standard decoction control map of Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla). Note: Peak 8. Hyperoside; Peak 9. kaempferol-3-O-rucoside
图2. 追风伞(狭叶落地梅)标准汤剂对照图谱。注:峰8,金丝桃苷;峰9,山奈酚-3-O-芸香糖苷
将追风伞(狭叶落地梅)配方颗粒标特征供试品溶液、金丝桃苷及山奈酚-3-O-芸香糖苷对照品溶液,按照“3.2”色谱条件项下进样检测,对比指认了金丝桃苷和山奈酚-3-O-芸香糖苷两种成分,见图3。
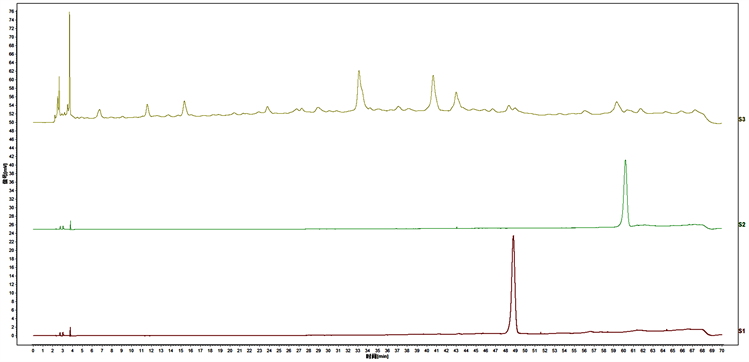
Figure 3. Peak identification results in the characteristic map of standard soup of formula particles of Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla). Note: S1 is hyperoside, S2 is kaempferol-3-O-rcoside, and S3 is the test product of Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla)
图3. 追风伞(狭叶落地梅)配方颗粒标准汤特征图谱共有峰指认结果。注:S1为金丝桃苷,S2为山奈酚-3-O-芸香糖苷,S3为追风伞(狭叶落地梅)配方颗粒标准汤供试品
4. 讨论
4.1. 提取条件的选择
参照《中药配方颗粒质量控制与标准制定技术要求》,对追风伞最优提取条件进行考察,选取甲醇、乙醇、30%、50%、70%乙醇为溶剂,随着乙醇浓度增加,对应峰面积逐渐增大,但50%和70%无明显差异,以50%乙醇为溶剂超分别声提取25、35、45、55、65 min,45 min时峰面积最大,采用超声回流两种提取方式对比之后,所得图谱差异较小,故最终选择50%乙醇超声提取45 min作为提取条件。
本研究在此基础上进行了色谱条件优化,在“3.2”条件下考察不同流动相(甲醇-0.1%磷酸水;甲醇–水;甲醇-0.1%醋酸水)对色谱图分离效果的影响。以甲醇-0.1%磷酸水为流动相时呈现各峰分离度较好,色谱峰也最多,此流动相在230、250、270、290、300、310、320、330、350 nm波长下进行图谱检测,其中310 nm波长峰多切分离度好,310 nm条件下,25℃图谱信息不全,30℃、35℃差异不大,选择30℃为最终温度,各进样量条件下图谱无差异,选择常规进样量10 μL。
4.2. 追风伞含量测定指标的选择
追风伞的化学成分主要为黄酮类、酚酸类、挥发油类 [5] ,目前有文献对追风伞的化学成分进行分析,暂无相关研究指出追风伞指标性成分,且《贵州省中药材、民族药材质量标准》中也未指出其指标性成分和含量测定规范,结合追风伞的药理作用和功效,其中金丝桃苷抗炎作用显著对骨关节炎、牙周炎、结肠炎、肺炎等多种炎症作用显著,金丝桃苷能够抑制白细胞介素-1β (IL-1β)诱导类风湿性关节炎(RA)成纤维样滑膜细胞(FLS)的增殖和迁移能力,这可能与其抑制了IL-1β诱导的部分p38蛋白激酶途径的活化有关,金丝桃苷可改善大鼠模型中的牙周炎症状,改善牙槽骨吸收,减轻了炎性浸润,增加了胶原纤维的有序排列,并增加了成骨分化,其机制可能是通过促进NF-KB信号通路激活r BMSC的增殖和成骨分化有关。金丝桃苷通过对Nrf2/ARE信号通路的调节作用实现对DSS诱导的结肠炎小鼠模型有保护作用 [6] [7] [8] [9] ,此成分适合作为追风伞的指标性成分和质量控制指标。
4.3. 追风伞标准汤剂的质量标准
在《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》中明确提出标准汤的制定至少需要出膏率、有效指标含量和含量转移率以及特征图谱这三个指标,其中出膏率、有效成分转移率为均值加减3倍SD (或均值的70%~130%)。
按上述计算方法结果见下表4,结合不同产地多批次追风伞(狭叶落地梅)实际测定结果,最终所得追风伞标准汤剂质量标准为出膏率7.06%~13.12%;追风伞标准汤金丝桃苷含量范围为0.041%~0.754%;金丝桃苷转移率23.194%~43.076%。

Table 4. Zhuifeng Umbrella (Lysimachia paridifornis var. stenoplla) formula granule standard soup quality standard established
表4. 追风伞(狭叶落地梅)配方颗粒标准汤质量标准建立
5. 结论
本研究以金丝桃苷为追风伞标准汤剂的含量测定成分,建立了HPLC分析方法。制备15批追风伞标准汤剂后计算得到出膏率、高异黄酮A的转移率和产量。进而根据
± 3SD法制定了追风伞标准汤剂质量标准为出膏率7.06%~13.12%;追风伞标准汤金丝桃苷含量范围为0.041%~0.754%;金丝桃苷转移率23.194%。
NOTES
*通讯作者。