摘要: 目的:对比分析胸背向过载下新西兰家兔、猕猴两种动物模型的肺脏损伤评分、病理表现差异,及其在超重肺损伤诊断研究中的应用价值。方法:依托数控动物离心机分别模拟过载峰值为13 g (家兔组)与15 g (猕猴组)的胸背向超重暴露环境,观察加载过后动物大体解剖情况并结合肺损伤评分及光镜下损伤表现,综合分析两种动物超重肺损伤程度及损伤表现的异同。结果:高级别胸背向超重加载后,两组动物均表现出一定程度的点片状出血、塌陷、水肿等现象,根据OIS定级与AIS评分结果,猕猴肺脏损伤程度更高,出血面积更大。光镜下结果显示,家兔组主要表现为高度肺不张、肺泡壁增厚水肿以及局部肺组织出血;猕猴组则表现出大面积的出血实质变,且大量肺泡壁断裂,几乎不见正常肺泡结构。结论:胸背向高过载暴露后,家兔、猕猴肺脏的损伤形式与病理表现相似,猕猴组损伤程度更高,伤情更重。本研究可为人体超重肺损伤研究提供良好的动物实验模型,为制定防护方案提供理论依据。
Abstract:
Objective: To compare and analyze the difference of lung injury score and pathological manifestations of New Zealand rabbits and macaques under chest back overload, and its application value in the diagnosis of hypergravity lung injury. Methods: Numerical control animal centrifuge was used to simulate the chest and back exposed environments with overload peak value of 13g (rabbit group) and 15g (macaque group). The gross anatomy of the animals after loading was observed, combined with lung injury score and injury performance under light microscope, and the similarities and differences of the degree of lung injury and injury performance of the two animals were comprehensively analyzed. Results: Both groups of animals showed a certain degree of spot-like bleeding, collapse, edema and other phenomena after high grade of chest and back superheavy loading. According to the OIS and AIS scores, the degree of lung damage in macaques was higher and the bleeding area was larger. The results of light microscopy showed that the rabbit group mainly presented with high atelectasis, thickened alveolar wall edema and local lung tissue bleeding. The macaque group showed extensive hemorrhagic parenchyma changes, and a large number of alveolar wall rupture, almost no normal alveolar structure. Conclusion: The lung injury forms and pathological manifestations of rabbits and macauqes were similar after exposure to chest and back high overload, and the injury degree and severity of rhesus monkeys were higher. This study can provide a good animal experimental model for the study of human overweight lung injury, and provide a theoretical basis for the development of protective programs.
1. 引言
航空航天任务过程中涉及复杂的动态载荷,尤其在飞行上升或返回阶段,高加速度过载将直接影响机体的心血管功能与肌肉活动等,与飞行人员的机能状态甚至生命安全密切相关 [1] [2] [3] 。肺脏是胸背向过载(±Gx)造成机体损伤的主要靶器官,其特殊的弹性体结构使内部血液、气体、组织分布极易受到过载的影响 [4] [5] [6] 。有学者提出,胸背向过载引起机体胸膜压力梯度的变化与肺泡形态及分布、静态肺容积、肺毛细血管阻力等诸多因素直接相关。M. Ax等人 [7] 采用定量单光子发射计算断层扫描对1G与3G胸背向过载下人体肺部通气进行了量化,发现3G过载期间,肺区域每体素平均通气量比率为1G期间的2倍,动脉饱和度平均降低了8%;M. Rohdin等人 [8] 的研究也发现,5G过载下肺扩散能力降低了46%,功能剩余容量减少了23%,心输出量减少了31%,这种变化极易诱发肺部血流与通气的不匹配变化进而导致肺损伤。如何有效评估超重暴露对人体肺脏组织的影响程度与机制仍是目前航空航天医学领域的一项重大挑战。
动物模型是现代生物医学研究中的极为重要的实验手段与方法,国内外学者借助转臂式离心机构建了多种超重肺损伤的动物模型。韩磊 [9] 及左从林 [10] 等人利用短臂动物离心机建立了家兔的肺损伤模型,发现±Gx暴露与肺组织基质金属蛋白酶表达水平密切相关并会引起肺脏细胞的超微结构损伤;李燕 [11] 等人也通过模拟+Gz暴露环境,构建了大鼠的肺损伤模型,并提出该环境会引起大鼠肺组织局部炎性细胞及炎性细胞因子增加,与肺部病变密切相关。此外,Benjamin [12] 等人采用两组不同长度转臂的方式研制出一种可同时施加两级超重力的离心机,成功构建了小鼠的多水平超重损伤模型。Hironobu [13] 等人也提出在太空中搭建短臂离心机用于小鼠超重生理反应的研究并验证了可行性。然而上述研究内容大多侧重于单一模型的生理、病理变化,鲜有不同种属动物间的肺损伤差异性的对比研究 [14] [15] [16] 。因此,探究各动物模型的超重肺损伤特点,并寻找一种简易可靠且病理变化迅速、典型的实验性超重肺损伤动物模型尤为重要。本研究利用数控动物离心机模拟高级别过载环境,构建了猕猴与新西兰家兔两种超重肺损伤模型,通过观察加载暴露后二者肺脏病理变化及半定量评估,综合分析两组模型的肺脏损伤特点及发生机制,为超重暴露下人体肺脏防护提供理论依据。
2. 材料与方法
2.1. 实验动物
成年雄性新西兰家兔7只,体重2.5~3 kg,体长约30 cm,由北京芳元缘养殖场提供;18只健康雄性猕猴,年龄4~8岁,体重约7~11 kg,体长约90 cm,由北京中科灵瑞生物技术有限公司提供。所选动物均无人畜共患病,不携带B病毒和结合杆菌等致病因子。常规饲养期间,保持室内温度、湿度、通风条件良好,组内喂养条件相同。
2.2. 实验设备
本研究借助中国航天员科研训练中心自研的数控动物离心机平台,该设备采用转臂式结构,半径约1.8 m,末端连接动物固定座椅,最大输出过载约20 G,控制精度±0.05 G。正式实验前,按照试验过载负荷要求和试验程序进行预实验,确保输出过载与试验设计过载环境保持良好的一致性。
2.3. 实验方法
结合前期预实验结果发现,峰值为13 g的过载曲线对猕猴行为学及体检结果影响并不明显,为观察病理将过载曲线峰值提升至15 g;而家兔在13 g过载曲线作用下行为学状态与猕猴相当,因此定峰值为13 g做病理学观察载荷,过载曲线如图1所示。实验开始前,将动物固定至离心机末端的胸背向座椅中,初始状态均为面朝离心机旋转中心,确保良好及一致的束缚状态后,按照实验设计顺序开始
实验。
2.4. 肺脏损伤程度判定
选用肺器官损伤分级、简明损伤分级2种创伤评分学方法对动物肺脏进行半定量评估。1) 肺器官损伤分级(Organ Injury Scaling, OIS),将肺损伤程度分为I、II、III、IV、V、VI共6个级别 [17] [18] 。2) 简明损伤分级(Abbreviated Injury Scaling, AIS),肺损伤的AIS分值范围为0~6分 [19] 。
2.5. 肺脏损伤程度判定
解剖观察后留取离体左肺肺叶组织,分别经4%PA灌注固定、流水冲洗、10%中性甲醛固定及常规冲洗后,用梯度乙醇脱水并于二甲苯中进行透明(共2次),后进行石蜡包埋并用石蜡切片机进行连续切片,切片厚度为3 μm,将其贴于多聚赖氨酸处理过的载玻片上;后分别进行脱蜡、水化、苏木精–伊红染色、脱水、透明、封片等处理后,置于光学显微镜下进行观察。
2.6. 统计分析
使用SPSS 18.0 (SPSS, Chicago, IL, USA)统计软件进行数据分析,结果以均值 ± 标准差形式表示,组间比较采用独立样本T检验,当P < 0.05时,认为具有统计学意义。
本研究中涉及动物实验程序均经中国航天员科研训练中心伦理委员会批准。整个过程都严格按照该机构的指导方针执行。
3. 结果
3.1. 总体结果及大体解剖观察
实验结束后,家兔组与猕猴组均无死亡个例,建模成功率均为100%。超重暴露后,两组动物均表现出精神萎靡、呼吸短促、反应迟钝等行为学状态,身体灵敏性减弱。
解剖结果显示,两组动物胸骨、肋骨无骨折,无血气胸,胸膜、腹膜完整且胸腔无积液,但肺叶表面存在不同程度的点片状出血、水肿与塌陷现象。家兔肺损伤主要表现为弥散的出血点与出血斑,多集中在下叶,偶见水肿与轻微糜烂,个别左肺有肋间压痕的存在;猕猴肺损伤主要表现为肺叶中部广泛出血,边缘有条片状出血现象,出血区域附近常常伴有糜烂与轻微水肿,个别上叶顶面出现穿孔。
3.2. 肺脏损伤评分与定级
根据AIS与OIS评分规则对家兔与猕猴肺脏损伤程度进行分级与评分,结果如表1所示。家兔组OIS损伤定级集中在I~III组,其中I级居多,占43%;猕猴组OIS损伤定级以IV级与III级为主,分别占44%与33%。根据AIS评分规则,家兔与猕猴肺损伤的AIS评分分别为2.286 ± 0.951、3.778 ± 0.972,猕猴组评分更高,组间T检验结果显示存在显著性差异(P = 0.008)。

Table 1. Lung injury grading and scoring
表1. 肺损伤分级与评分
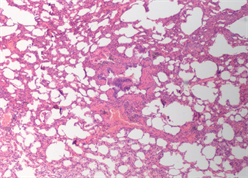 (a) 肺泡壁断裂或消失(10×)
(a) 肺泡壁断裂或消失(10×) 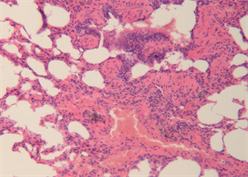 (b) 出血、溶血,几乎不见正常肺泡结构(20×)
(b) 出血、溶血,几乎不见正常肺泡结构(20×) 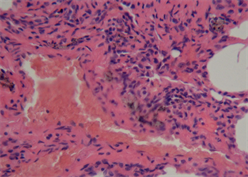 (c) 出血实质变,炎性细胞聚集(40×)
(c) 出血实质变,炎性细胞聚集(40×)
Figure 2. Typical pulmonary manifestations of macaques under light microscope
图2. 猕猴组肺脏典型镜下表现
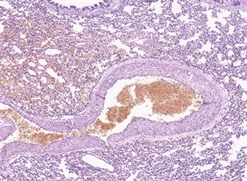 (a) 局部有出血、溶血(10×)
(a) 局部有出血、溶血(10×)  (b) 高度肺不张(20×)
(b) 高度肺不张(20×) 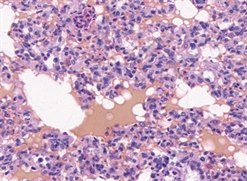 (c) 炎性细胞聚集,肺泡壁水肿增厚(40×)
(c) 炎性细胞聚集,肺泡壁水肿增厚(40×)
Figure 3. Typical pulmonary manifestations of rabbits under light microscope
图3. 家兔组肺脏典型镜下表现
3.3. 镜下典型表现
加载结束后,两组动物肺脏组织镜下表现为不同程度的肺组织及肺泡出血、肺泡壁增厚水肿、肺不张、肺实变及炎性细胞浸润等,如图2、图3所示。家兔组主要表现为肺泡壁及气管支气管周围间质明显增厚,大面积肺泡壁发生塌陷、折叠、肺泡腔消失等现象,偶有中低程度出血,主要包括肺组织间质、肺泡及支气管内的局部出血,有炎性细胞浸润。猕猴组表现为大面积广泛出血,肺组织及肺泡内充满了大量红细胞,视野中呈现成片的红色实变区,局部肺泡隔结构消失,肺泡变大且数量变少,肺泡及肺泡壁间质中有不同程度的炎性细胞浸润。
4. 讨论
航空航天医学研究的发展常常依赖于动物模型作为实验假说与临床验证的基础,通过模拟观察特定环境下动物机体各种生理现象与损伤的发生与进展,有助于更直观地认识疾病的发展规律并制定相应地防护措施 [20] [21] 。本研究借助中国航天员科研训练中心自主研制的动物离心机平台,该设备采用PC + 可编程运动控制器(PLC) + 自带编码器伺服电机的总体方案,实现了对角速度与角加速度的精确控制,可以有效模拟超重飞行状态对机体的影响。结果表明,该方法构建家兔与猕猴的超重肺损伤动物模型准确可靠,实验结果与预期基本一致。
本研究结果显示,胸背向高过载作用下猕猴肺损伤的OIS定级与AIS评分更高,大体观察发现出血面积更大,伤情更严重。结合光镜下病理表现,两组模型均可见不同程度的出血,家兔组主要表现为肺组织间质、肺泡及支气管内的局部出血,猕猴组则发生了大面积的出血实质变。肺脏为海绵状可压缩器官,以往研究发现,+Gx暴露会放大机体胸背向的流体静压差,造成胸侧肺泡膨胀扩张及背侧肺泡的压缩萎陷,加剧肺部血流与通气的区域不匹配性变化进而诱发肺不张、淤血等损伤 [6] [7] 。也有学者提出,+Gx作用会引起机体右心房压、腔静脉压及肺毛细血管压明显升高,增大肺循环阻力,加之胸腔及腹腔脏器的压迫,可造成肺毛细血管通透性升高甚至发生破裂,进而导致肺部出血 [22] 。本实验结果与上述推论基本相符,也为猕猴与家兔肺脏伤情的差异性提供了一种理论解释,即二者胸腔结构的差异性可能是引起肺脏伤情不同重要原因 [23] 。猕猴肺位于胸腔内纵膈的两侧,纵膈上至胸廓入口,下至横膈,分为前、中、后纵膈三部分,其中心脏斜位于中纵膈内 [24] ;而家兔胸腔内构造与其不同,其胸腔中央由纵膈连于顶壁、底壁及后壁之间将胸腔分为左右两部,互不相通,纵膈由膈胸膜和纵膈胸膜两层纵膈膜组成。肺被肋胸膜和肺胸膜膈开,心脏又被心包胸膜隔开。家兔的胸腔结构相较于猕猴更有效地减小了胸壁及心脏对肺脏的压迫,因此超重暴露后其肺脏损伤程度更低。
以往研究表明,不同的加速度矢量所引起的生理反应各不相同,但只要脑、心、肺等主要脏器的微循环状态良好且血、氧供给充足,就能一定程度上维持机体正常的机能状态。因此,除体液、神经调节外,脏器形态结构、微循环及血液流变特性是决定过载耐受性的关键因素 [25] 。本研究中我们观察到,虽然两组动物均采用坐姿的胸背向固定座椅,但由于骨骼结构的差异,家兔组存在更明显的生理背角,即同时受到胸背向过载和更大的头盆向过载分量的作用。在此复合作用下,家兔肺脏底部表现出更明显的淤血现象,与结果观测一致。此外,头盆向过载分量的大小直接决定了脑部血液、氧气的供给,与机体的生理反应及行为学状态密切相关,这可能也是导致两组动物过载耐受性不同的重要原因之一。
高过载下人类的肺脏损伤与动物损伤模型仍是存在巨大差别的,完全将动物模型的损伤病理与发生机制推测到人类是不可取的,二者间的差异性对比研究是必不可少的论证过程。此外,不同种属动物模型引起的病理生理特征也不可避免存在差异,也需要进一步研究并修正相关结论。
5. 结论
本研究中,我们测试观察了胸背向高过载暴露下猕猴与家兔的肺脏损伤及病理学表现。结果表明,猕猴与家兔超重肺脏损伤的发生特点与病理表现相似,表现为明显的出血、不张等现象,二者均适合作超重肺损伤动物模型。但猕猴肺脏表现出更严重的伤情,因此建模时需要重点考虑过载的级别,进一步提高建模成功率。
基金项目
载人航天领域预先研究项目(020101)与航天医学基础与应用国家重点实验室研究基金(SMFA20K07)。
参考文献