1. 引言
胰腺癌是一种致命的疾病,是具有侵袭性和致命性的恶性肿瘤之一 [1] ,在过去的几十年中,胰腺癌在全球人类健康中造成了巨大的负担,2020年全球新诊断胰腺癌患者估计为49万人,胰腺癌在所有恶性肿瘤中排名第12位 [2] 。在美国,胰腺癌是所有癌症中的第四大死亡原因 [3] ,预计到2030年将成为第二大死亡原因 [4] ,总发病率预计到2040年将增加约30% [5] 。因此目前的当务之急是寻找一个新的绿色治疗策略来提高胰腺癌诊断和治疗。丁香桃娘科植物干燥的花蕾,一种具有温里药性的中草药,在中国使用已经有着悠久的历史,具有温中降逆,散寒止痛,温肾助阳的功效,可治疗脾胃虚寒,呃逆吐泻,心腹冷痛,肾虚阳痿等症 [6] 。研究发现丁香提取物具有抑制癌细胞增殖的作用,并且具有明确抗肿瘤效果 [7] 。热疗是一种历史悠久的绿色安全无副作用的治疗肿瘤的方法,在1866年德国的Busch使用丹毒导致骨肉瘤病人发热的方法,成功治愈了患者 [8] ,在之后的一百年间,医生和学者们一直试图使用这种方法使患者发热来治疗癌症。课题组前期研究表明,39℃高温培养可以抑制癌细胞的生长和增殖 [9] ,本研究探索不同浓度的丁香酒精粗提取物对胰腺癌细胞的增殖迁移和凋亡的影响,并联合39℃条件是否会增强其影响的效果。
2. 材料
2.1. 实验细胞
人胰腺癌细胞PANC-1购于美国ATCC。
2.2. 药品与试剂耗材
丁香的干燥花蕾(购买自贵州中医药大学第二附属医院,货号191113)杜氏改良伊戈尔培养基DMEM (美国Gibco股份有限公司,货号8122687)胎牛血清(中科迈晨北京科技有限公司,货号) CCK-8试剂盒Transwell小室Matrigel基质胶结晶紫粉末(北京索莱宝科技有限公司) Hoechst33258 (北京索莱宝科技有限公司),凋亡试剂盒(BD公司)。
2.3. 主要仪器
CO2恒温恒湿培养箱(美国Thermo Fisher)超净工作台(苏州净化)流式细胞仪BD FACSVE PCR扩增仪(BD Medical Technology公司)多功能酶标仪(北京百乐科技有限公司) −20℃冰箱(海尔集团) −80℃冰箱(海尔集团)。
3. 实验方法
3.1. 细胞培养
人胰腺癌细胞系PANC-1生长在含有10% FBS胎牛血清和1%双抗的高糖DMEM培养液,并在二氧化碳浓度为5%的37℃和39℃的两套水套式培养箱中生长。为了确保温度准确,在培养箱中放置温度计时刻检测,显微镜观察细胞状态,待其生长至70%~80%密度,可进行后续实验,因细胞长满会影响后续实验结果。
3.2. 丁香乙醇提取物的制备
干燥的丁香花蕾购买自贵州中医药大学第二附属医院,为了制备酒精提取物,用精准电子天平称取干燥的丁香花蕾按照1 g加入5 ml的95%酒精比例配制,在室温下提取两周,然后将酒精转移到新的15 ml离心管中,并将视其为100%的提取物。避光保存在−20℃冰箱,以备后续实验使用。
3.3. CCK8实验检测细胞的增殖活性
倒置显微镜观察PANC-1细胞生长至70%~80%密度时,用含有5% FBS培养基进行细胞重悬,进行细胞计数,培养基进行稀释调整细胞密度为2 × 103接种于96孔板中,过夜贴壁后,加入不同浓度的丁香酒精粗提取物,放入37℃和39℃培养箱继续培养72 h后,加入配好的CCK8溶液,每孔100 μl孵育2 h使用酶标仪测定各个孔细胞在450 nm吸光度的OD值,计算细胞的增殖活性。
3.4. 平板克隆实验检测细胞的克隆能力
观察PANC-1细胞长至70%~80%左右,根据实验所需细胞数计算,将细胞以1 × 103每孔进行种植,克隆实验所用培养基均为含5%FBS培养基,放入37℃和39℃培养箱之前,一定要十字混匀。待其过夜贴壁后,加入不同浓度丁香酒精粗提取物进行加药处理,处理72 h后。弃去含药培养基,更换正常含5%血清培养基,每隔三四天或培养液变黄更换培养液,观察出现肉眼可见的克隆出现。使用4%多聚甲醛固定细胞30分钟,弃去多聚甲醛溶液,等其风干。使用0.1%的结晶紫溶液染色30 min后,去离子水清洗几遍,等其风干,用手机进行拍照记录,实验重复三次进行数据统计。
3.5. 划痕实验检测细胞的迁移能力
观察胰腺癌细胞系生长状态,当生长密度长至70%~80%时,可用来进行细胞划痕实验,细胞重悬,进行细胞计数,用培养基进行稀释调整细胞密度为1 × 105/孔接种于6孔板中,十字混匀,置于37℃和39℃培养箱中。待其细胞过夜贴壁后,用酒精和紫外消毒灭菌尺子和10 μl枪头30 min后,垂直于孔板划三条线,划时注意轻柔快速,划后用PBS清洗两遍将划掉的漂浮细胞洗涤干净,同时加入不同浓度丁香醇提取物,用含5% FBS DMEM培养基稀释成对应的浓度,对照组用95%乙醇溶剂。取0 h和72 h显微镜下进行拍照,保存数据,以便后续的数据分析,计算丁香醇提取物对胰腺癌细胞系迁移率。
3.6. 显微镜下观察细胞形态的改变
观察胰腺癌细胞系生长至70%~80%密度时,消化,用含有5% FBS培养基进行细胞重悬计数,将细胞密度2 × 105/ml−3 × 105/ml接种于6孔板中,待细胞贴壁后,按照等体积比例加入不同浓度的丁香酒精粗提取物处理72 h后,在倒置显微镜下观看胰腺癌细胞系的形态变化情况,并拍照记录。
3.7. Hoeschst33258实验检测细胞凋亡
观察细胞长至70%~80%左右,消化,重悬计数。用镊子取出12孔的爬片,在酒精灯上过一遍火,进行灭菌,在放入爬片之前提前在孔板中滴加一滴培养基,目的是使爬片与培养皿之间靠培养基的张力粘合到一起,然后放玻片,防止加细胞悬液时玻片漂起,造成双层细胞贴片。整个过程需无菌操作。将细胞以10,000/每孔进行种植于12孔板,十字混匀后,放于37℃和39℃的水套式培养箱中。过夜贴壁后,加入不同浓度的丁香酒精提取物,溶剂作为对照。培养72 h后,用PBS清洗,依次加入500 μl细胞染色缓冲液,5 μl Hoechst33258染色液。混匀后,4℃避光孵育20~30 min,用PBS清洗一边染色液,将爬片从培养的孔板中扣出。取载玻片,滴加一滴荧光抗淬灭剂,将已经扣出的爬片放到载玻片上,尽量不出现气泡。荧光显微镜观察拍照,导出数据,统计分析,实验重复三次。
3.8. AnnexinV/FITC染色实验检测细胞凋亡
观察细胞生长至70%~80%左右时,消化重悬计数,以1 × 105/孔密度种植于六孔板中,十字混匀后,放于37℃和39℃水套式培养箱中。贴壁后,加入不同浓度的丁香酒精提取物和95%酒精对照处理72 h后。PBS洗涤两遍,不含EDTA的胰蛋白酶消化,消化时间不宜过长,以免导致细胞过度消化损伤细胞,出现假阳性结果。消化过后,用原有的培养液终止消化,1000 rpm 5 min离心。弃去上清,用预冷的PBS洗涤两遍,1000 rpm 5 min离心。弃去上清,加入1 × bindingbuffer缓冲液调整细胞密度为1 × 106/ml的细胞悬液。加入5 μl AnnixinV-FITC轻轻混匀后,室温避光放置15 min。加入5 μl PI轻轻混匀后,室温避光放置15 min。上机检测,导出数据,实验重复三次。
3.9. 统计学分析
数据均通过平均数±标准差来表示,实验重复三次,数据分析方法两组均数比较运用T检验分析,多组之间比较采用多样本均数的单因素方差分析。*代表P < 0.05、**代表P < 0.01、***代表P < 0.001,当P < 0.05具有统计学差异,当P > 0.05时,表示差异无统计学意义。
4. 结果
4.1. 丁香酒精粗提取物(alcohol extract of Clove AEC)在39℃条件下对胰腺癌细胞增殖的影响
CCK8的实验方法检测细胞的增殖活性,AEC从0.05% (V/V)上升到0.3% (V/V)的浓度处理PANC-1、PANC-28、SW1990和PANC02胰腺癌细胞72小时后,我们发现当细胞在37℃培养时,CCK8测定的致死量50 (LD50)约为0.2%~0.3% (V/V),但当细胞在39℃培养时,约为0.1%~0.2% (V/V),然而对于PANC02细胞来说,在37℃培养时,药物浓度为0.05%时就已经达到了LD50 (见图1)。差异有统计学意义(P < 0.05),提示AEC具有抑制细胞的增殖活性。
 注:加入不同浓度的丁香酒精提取物(AEC)处理PANC-1细胞72 h后,CCK8法检测胰腺癌细胞的增殖的影响(*** P < 0.01)
注:加入不同浓度的丁香酒精提取物(AEC)处理PANC-1细胞72 h后,CCK8法检测胰腺癌细胞的增殖的影响(*** P < 0.01)
Figure 1. CCK8 assay to detect the proliferative activity of ethanolic extract of clove (AEC) to inhibit pancreatic cancer cell lines
图1. CCK8法检测丁香酒精提取物(AEC)抑制胰腺癌细胞系的增殖活性
4.2. 丁香酒精粗提取物(AEC)在39℃条件下对胰腺癌细胞系克隆形成的影响
为了确定AEC和39℃对细胞生长的长期影响,我们将AEC从0.05%~0.2% (V/V)处理PANC-1细胞三
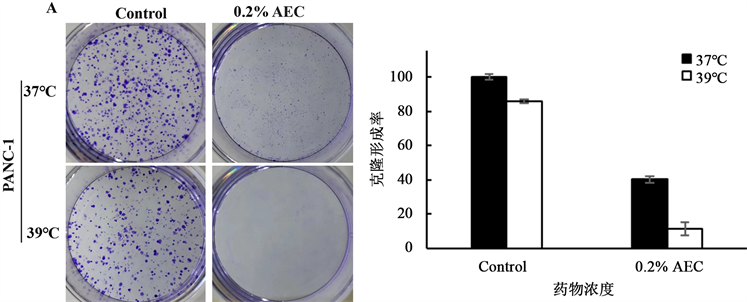
Figure 2. AEC inhibits clone formation of pancreatic cancer cells at 37˚C and 39˚C
图2. 在37℃和39℃条件下,AEC抑制胰腺癌细胞的克隆形成
 注:37℃和39℃条件下,对照组与0.2% AEC对胰腺癌细胞作用72 h后迁移能力的影响(***P < 0.01。)
注:37℃和39℃条件下,对照组与0.2% AEC对胰腺癌细胞作用72 h后迁移能力的影响(***P < 0.01。)
Figure 3. Effect of control versus 0.2% AEC on migration of pancreatic cancer cells at 37˚C and 39˚C
图3. 37℃和39℃条件下,对照组与0.2% AEC对胰腺癌细胞的迁移的影响

 注:图A PANC-1细胞加药72h后显微镜下形态观察(×200)图B PANC-1加药72 h后荧光显微镜观察细胞核碎裂情况(×40)图C-D流式细胞术检测丁香酒精粗提取物(AEC)对PANC-1细胞凋亡的影响
注:图A PANC-1细胞加药72h后显微镜下形态观察(×200)图B PANC-1加药72 h后荧光显微镜观察细胞核碎裂情况(×40)图C-D流式细胞术检测丁香酒精粗提取物(AEC)对PANC-1细胞凋亡的影响
Figure 4. Effect of crude extract of clove alcohol on apoptosis of PANC-1 cells at 39˚C
图4. 丁香酒精粗提取物(AEC)在39℃条件下对PANC-1细胞凋亡的影响
天,去除AEC继续培养5天,实验结果显示,PANC-1细胞39℃溶剂组的集落形成比37℃的要大一些(图2A),但是在0.05%~0.2% (V/V) AEC处理后,发现39℃高温可以增强丁香抑制细胞的生长,显微镜下观察有更多的死亡细胞。提示AEC有着杀伤细胞的作用,并在39℃高温的条件下杀伤效果更加明显(见图2)。
4.3. 丁香酒精粗提取物(AEC)在39℃条件下对胰腺癌细胞系迁移能力的影响
由于肿瘤的迁移和侵袭是大多数癌症患者死亡的主要原因,我们采用了划痕实验检测肿瘤的迁移能力,划痕实验结果显示0.2% AEC具有显著抑制胰腺癌细胞的迁移能力,在39℃条件下,我们发现与37℃对照组相比,39℃具有促进细胞的迁移的效果,PANC-1细胞在37℃和39℃,0.2% AEC条件下抑制细胞的迁移(见图3 P < 0.05),提示AEC有抑制细胞迁移的能力,而与39℃联合使用后并没有增强抑制细胞的迁移的能力。
4.4. 丁香酒精提取物(AEC)导致细胞形态的改变并诱导胰腺癌细胞凋亡
检测AEC是否会诱导细胞凋亡和导致细胞形态的变化,我们使用0.2% AEC处理PANC-1细胞72 h后,如图4所示,与对照组相比,AEC可以导致细胞贴壁数量减少,并引起细胞形态学发生变化,从上皮状菱形细胞变成细长或变小变圆。使用Hoechst33258进一步检测,发现细胞核发生碎裂现象,如图4所示,AEC或联合39℃处理72 h后,细胞核出现亮蓝色、凋亡小体和核碎裂等现象。AEC处理PANC-1细胞72 h后,流式细胞术结果显示,与对照组相比,加入0.2% AEC组凋亡率增加,联合39℃凋亡更加明显,提示39℃可以增强AEC诱导细胞凋亡(见图4)。差异有统计学意义(***P < 0.01)。
5. 讨论
丁香是一种传统中草药,味辛,性温,属脾、胃、肺、肾四经,既是药材,又是珍贵的香料,在中国有着悠久的使用历史,具有温中降逆,散寒止痛,温肾助阳的功效,有研究发现丁香具有抗炎 [10] 、抗病毒 [11] 、抗菌 [12] 、杀虫、抗氧化 [13] 、镇痛 [14] 和抗肿瘤 [15] 等作用,并且在多种肿瘤中均有不错的疗效,热疗也是一种历史悠久的绿色安全无副作用的治疗肿瘤的方法,但在胰腺癌中并未发现丁香及联合热疗的相关报道,本实验探索AEC是否能抑制胰腺癌细胞的生长增殖、迁移侵袭及促进胰腺癌的凋亡,并进一步联合热疗对胰腺癌生物学行为的影响,以期对临床上中草药联合化疗药和辅助热疗治疗胰腺癌提供实验依据。
我们首先通过CCK8法,将细胞培养在37℃和39℃条件下,结果发现丁香酒精提取物对多种胰腺癌细胞具有抑制其增殖的作用并呈浓度依赖性,与39℃热疗联合效果更佳明显。与课题组前期研究结果一致 [9] 。细胞克隆形成实验,我们发现在37℃和39℃条件下,用极低浓度的丁香处理细胞3天,继续在没有丁香提取物的情况下再培养5天时,结果发现在39℃培养的活细胞比在37℃培养的活细胞要少得多,这也表明较高的环境温度有利于丁香的杀伤效应。在最初的三天治疗中,当丁香浓度加至0.2%时,也观察到了39℃时更多细胞死亡的现象,说明39℃会增加AEC对胰腺癌的杀伤作用。
肿瘤之所以有着较高的死亡率,其主要原因与其生物学行为密切相关,而局部侵袭和远部转移是恶性肿瘤的主要特征,Mashan L. Abdullah等证实丁香提取物呈剂量依赖性可以抑制MDA-MB-231和SK-BR-3细胞的迁移和侵袭 [10] ,Arnab Sarkar等也证明了丁香通过靶向TGF-β信号传导来抑制胃癌的转移 [16] ,因此我们通过不同浓度的丁香酒精提取物作用胰腺癌细胞,研究结果发现,丁香酒精提取物是否在39℃条件下均可以抑制胰腺癌细胞的迁移和侵袭,在与37℃溶剂对照组中发现,39℃迁移能力要快一些,这也验证了之前的推断,39℃条件下细胞代谢更快。但丁香酒精提取物与39℃联合使用,体现出了更强的抑制胰腺癌细胞侵袭的能力。
细胞凋亡是调控细胞死亡的一种进化保守形式,通常涉及半胱氨酸天冬氨酸蛋白酶家族的半胱天冬氨酸蛋白酶,在正常细胞生长和衰老过程中发生在多细胞生物中,作为胰腺癌中研究最多的调控细胞死亡的形式,凋亡既涉及细胞死亡受体(外源性途径),也涉及线粒体(内源性途径) [17] 。而凋亡的形态学特征包括细胞收缩、染色质凝结和细胞破碎,产生所谓的凋亡小体。研究发现,AEC可以促进胰腺癌细胞凋亡,对其形态观察发现,AEC处理72 h后发现细胞形态从菱形上皮形态转变为细长成纤维的形态,漂浮细胞碎片增加,细胞相对对照组而言细胞数量明显减少,我们也通过Hoechst33258染色实验来证实AEC可以促进胰腺癌细胞的凋亡,发现AEC处理后,细胞核的荧光强度增强,也出现了细胞核的碎裂和凋亡小体等凋亡特征。因此我们进一步使用流式检测凋亡,发现与Hoechst33258的实验结果一致,早期凋亡细胞增加,根据以上实验结果证实AEC可以诱导胰腺癌细胞的凋亡。
综上,本研究中丁香酒精粗提取物通过抑制胰腺癌生长和增殖,抑制细胞的迁移,促进细胞的凋亡等机制表现出抗肿瘤作用,而在联合39℃热疗条件下表现出的抗肿瘤效果更加明显,因此丁香和热疗作为一种新的绿色几乎无毒副作用的抗肿瘤药物和治疗方式,其具体的机制尚不清楚还需要进一步的探索和研究。
参考文献