1. 引言
化学常常伴随着一些迷人的感观现象,如冒气泡、结晶体、变颜色等。分析化学中滴定的实验,由于引进终点指示剂,在终点时颜色的突变引起了同学们极大的兴趣,同时也使得很多初学的同学感到极大的迷茫,因为他们拿捏不准滴定终点时颜色的突变。为了解决这类问题,有些高校甚至研发出了判断酸碱滴定终点的APP [1] 。
有很多教师,想从各种角度来解释滴定的误差。邵利民研究了基于电荷平衡式的终点误差通用计算策略 [2] ;乔成立等研究了通过求解滴定方程来计算终点误差的方法 [3] ,苏铁军根据质子平衡原理,推导终点误差体积比定义式,构建了计算酸碱滴定终点误差的通用公式 [4] 。但是所有的误差计算要建立在准确判断滴定终点的基础上,否则误差计算就没有意义。
化学分析中滴定法是常用的一种分析方法,是大学分析化学基础实验中的基本实验操作。其中包括酸碱中和滴定、络合滴定、氧化还原滴定、沉淀滴定。在这些滴定的实验中通常需要借助指示剂指示终点。但是利用指示剂判断终点存在很大的主观性,在实际的课堂上很多同学很难把握好滴定终点。本实验针对酸碱滴定,同时使用了pH计及酚酞指示终点。让学生从理论和感观上来认识滴定终点,比对指示剂和pH计指示终点。同时可以绘制出滴定曲线,学会自己找到最佳的终点颜色和终点pH值。
2. 实验内容
本论文中开展了以下实验,用0.10 mol/L、0.01 mol/L、0.001 mol/L的NaOH分别滴定0.1000 mol/L、0.0100 mol/L、0.0010 mol/L的KHP;以及0.1 mol/L、0.01 mol/L、0.001 mol/L的NaOH分别滴定0.1 mol/L、0.01 mol/L、0.001 mol/L的HCl。实验中同时采用pH计以及酚酞指示终点。
2.1. 实验器材与实验试剂
【实验器材】:电子分析天平(mettler ME204E),pH计(mettler FE-20),滴定管(bomex,通用性),容量瓶(250 mL, bomex),移液管(25 mL, bomex),烧杯(250 mL,蜀牛),滴定台,移液枪(5 mL, eppendorf)。
【实验试剂】:氢氧化钠(NaOH,天津金汇),邻苯二甲酸氢钾(KHP,乐研试剂),盐酸(HCl,衡阳楚杰),酚酞指示剂。
2.2. 实验过程
【NaOH溶液配制】:准确称取1.00 g NaOH固体,配成0.10 mol/L的NaOH溶液250 mL。移取0.10 mol/L的NaOH溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的NaOH溶液。再移取0.01 mol/L的NaOH溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的NaOH溶液。
【KHP溶液配制】:准确称取5.10 g KHP固体,配成0.10 mol/L的KHP溶液250 mL。移取0.10 mol/L的KHP溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的KHP溶液。再移取0.01 mol/L的KHP溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的KHP溶液。
【HCl溶液配制】:用移液枪准确移取2.08 mL浓盐酸溶液,稀释成0.10 mol/L的HCl溶液250 mL。移取0.10 mol/L的HCl溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.01 mol/L的KHP溶液。再移取0.01 mol/L的HCl溶液25 mL,转移至250 mL容量瓶中,定容至刻度线,得到0.001 mol/L的HCl溶液。
【滴定实验】:取一定浓度的NaOH溶液与50.00 mL的滴定管中,用移液管移取相同浓度的KHP溶液或是HCl溶液与100 mL的烧杯中,在烧杯中滴加2~3滴酚酞指示剂,同时插入pH计电极指示终点。观察烧杯颜色,并记录滴定的体积和pH值。
2.3. 实验结果与讨论
2.3.1. 0.1 mol/L NaOH滴定0.1000 mol/L KHP
高浓度的强碱滴弱酸的实验中,我们从滴定曲线来看,滴定终点在pH值为8.80左右;而同时采用的酚酞作指示剂的现象是pH = 8.40时溶液并没有变色(图1(b)),而多加一滴(约0.05 ml),溶液的pH值变为9.27,瞬间变为红色(图1(c))。在这个实验当中时,从pH判断终点来看,稍过量一点,溶液的颜色可以稍浅一点。此时NaOH溶液的浓度比较大,加入一滴NaOH溶液pH的变化比较明显,因此溶液颜色的改变是很明显。因此,在高浓度的强碱滴弱酸实验中,溶液出现浅红色即为终点。
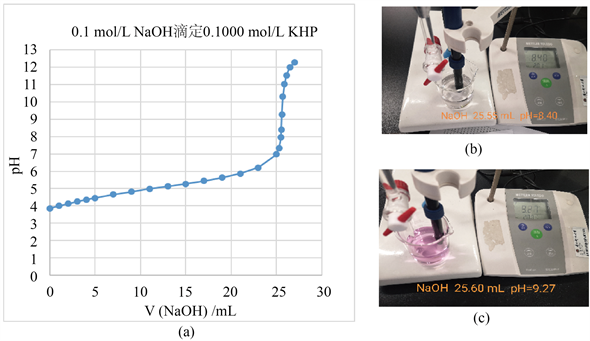
Figure 1. (a) Titration curve for 25.00 mL 0.1000 mol/L KHP versus 0.1 mol/L NaOH; (b) (c) Color change of end point in 25.00 mL 0.1000 mol/L KHP versus 0.1 mol/L NaOH
图1. (a) 0.1 mol/L NaOH滴定25.00 mL 0.1000 mol/L KHP的滴定曲线;(b) (c) 0.1 mol/L NaOH滴定25.00 mL 0.1000 mol/L KHP终点颜色变化
2.3.2. 0.01 mol/L NaOH滴定0.0100 mol/L KHP
低浓度的强碱滴弱酸的实验中,我们从滴定曲线来看(图2(a)),滴定终点在pH 值为8.80左右;而同时采用的酚酞作指示剂的现象是pH = 8.63时溶液并没有变色(图2(b)),溶液的pH值变为8.87,瞬间变为红色(图2(c))。在这个实验当中时,两种指示终点的方法一致,并没有引入太大的误差。该实验得到的结论与第一次实验相同,因此,在溶液刚出现浅红色即为滴定终点。
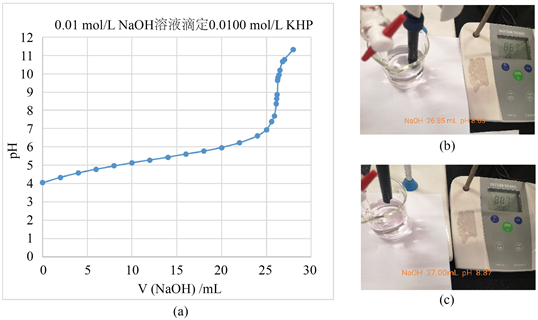
Figure 2. (a) Titration curve for 25.00 mL 0.0100 mol/L KHP versus 0.01 mol/L NaOH; (b) (c) Color change of end point in 25 mL 0.0100 mol/L KHP versus 0.01 mol/L NaOH
图2. (a) 0.01 mol/L NaOH滴定25.00 mL 0.0100 mol/L KHP的滴定曲线;(b) (c) 0.01 mol/L NaOH滴定25.00 mL 0.0100 mol/L KHP终点颜色变化
2.3.3. 0.001 mol/L NaOH滴定0.0010 mol/L KHP
本实验由于浓度太低,在滴定曲线上的滴定突跃不如高浓度滴定的明显(图3(a))。通过pH计来判断终点,有点困难。溶液pH为8.44时,开始出现微红色(图3(b));继续滴加1.00 mL NaOH溶液的颜色稍微一点(图3(c));再继续滴加0.50 mL溶液的颜色又稍深一点(图3(d))。所以低浓度的溶液滴定时,酚酞指示终点可会更好一些,终点的现象则是刚出现红色。通过滴加半滴或是一滴来增加溶液的颜色判断终点,可能会带来较大的误差。
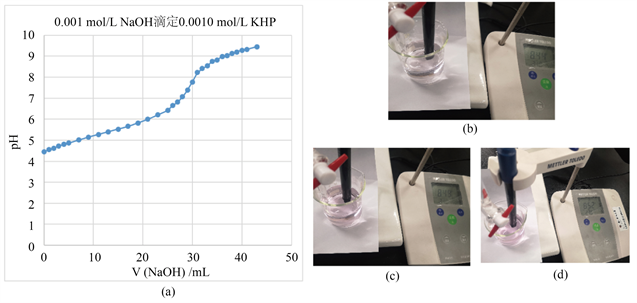
Figure 3. (a) Titration curve for 25.00 mL 0.0010 mol/L KHP versus 0.001 mol/L NaOH; (b)~(d) Color change of end point in 25 mL 0.0010 mol/L KHP versus 0.001 mol/L NaOH
图3. (a) 0.001 mol/L NaOH滴定25.00 mL 0.0010 mol/L KHP的滴定曲线;(b)~(d) 0.001 mol/L NaOH滴定25.00 mL 0.0010 mol/L KHP终点颜色变化
2.3.4. 0.1 mol/L NaOH滴定0.1 mol/L HCl
用0.1 mol/L NaOH滴定0.1 mol/L HCl时(图4(a)),用pH和酚酞两种方法指示终点。由于滴定终点时pH = 7.00,而酚酞的理论变色范围为8.20~10.0,这样带进来的误差就会比较大。滴定至pH = 7.00时,溶液颜色无变化;靠1滴(0.04 mL)时,溶液的pH = 9.17,溶液的颜色瞬间变为紫红色。由于溶液的浓度较大,引入的误差会较大。因此在这样一个实验当中,建议直接用pH计判定终点更加合理。当用0.01 mol/L NaOH滴定 0.01 mol/L HCl时(图4(b)),滴定的现象与上述相同。
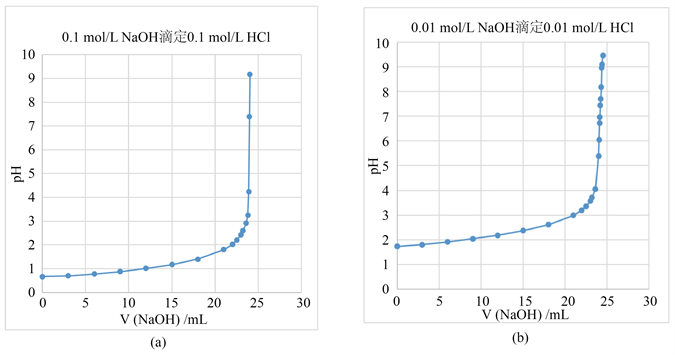
Figure 4. (a) Titration curve for 25.00 mL 0.1 mol/L HCl versus 0.1 mol/L NaOH; (b) Titration curve for 25.00 mL 0.01 mol/L HCl versus 0.01 mol/L NaOH
图4. (a) 0.1 mol/L NaOH滴定25.00 mL 0.1 mol/L HCl的滴定曲线;(b) 0.01 mol/L NaOH滴定25.00 mL 0.01 mol/L HCl的滴定曲线

Figure 5. (a) Titration curve for 25.00 mL 0.001 mol/L HCl versus 0.001 mol/L NaOH; (b)~(d) Color change of end point in 25 mL 0.001mol/L HCl versus 0.001 mol/L NaOH
图5. (a) 0.001 mol/L NaOH滴定25.00 mL 0.001 mol/L HCl的滴定曲线;(b)~(d) 0.001 mol/L NaOH滴定25.00 mL 0.001 mol/L HCl的终点颜色变化
2.3.5. 0.001 mol/L NaOH滴定0.001 mol/L HCl
0.001 mol/L NaOH滴定0.001 mol/L HCl过程中(图5(a)),建议用pH指示终点,结果会更加准确。在这次的滴定中,pH = 8.24时(图5(b)),溶液出现微红且30 s不褪色;继续滴加1.00 mL NaOH,溶液pH = 8.40时,溶液出现浅红(图5(c));再继续滴加1.00 mL NaOH,溶液pH = 8.67时(图5(d)),溶液浅红加深一点。从滴定曲线我们可以看出,滴定终点就是pH = 7.00左右。所以强碱滴强酸pH计指示终点更加适合。指示剂指示终点,出现红色即可。
3. 结论
强碱滴弱酸时,采用酚酞或是pH计指示终点都可以。值的注意的是,不管是高浓度的还是低浓度的,酚酞作指示剂的时候,刚出现微红且30 s不褪色时即为指示终点。通过滴加半滴或是一滴来增加溶液的颜色判断终点,这样会带来较大的误差。强碱滴定强酸时,为减少误差,最好采用pH计指示终点。浓度从0.1 mol/L到0.001 mol/L,滴定突跃都比较明显。本文中,低浓度的强碱滴定低浓度的强酸,用酚酞作指示剂时,误差相对高浓度的滴定较小。但是滴定终点时,也是刚出现微红即可,继续滴加滴定剂终点颜色变化不是很明显。