1. 引言
免疫检查点抑制剂(Immune checkpoint inhibitors, ICIs)在过去10年迅速兴起,已被证明是肿瘤治疗领域的重大突破。尽管ICIs已在多种人类癌症中成功应用,但只有部分的晚期癌症患者通过免疫检查点抑制剂治疗获得长久的生存 [1] [2] 。并非所有患者对免疫检查点抑制剂有应答,甚至部分患者会出现严重的免疫不良反应 [3] 。程序性死亡配体-1 (Programmed cell death 1 ligand 1)、肿瘤突变负荷(Tumor mutational burden)、肿瘤浸润免疫细胞(Tumor-infiltrating immune cells)、错配修复(Mismatch repair)和微卫星不稳定性(Microsatellite Instability)等生物标志物被许多研究证实与免疫治疗相关 [4] 。然而,目前尚无明确的癌症免疫治疗检测指南,并且随着新的临床和转化数据的出现,该领域正在迅速发展。因此,探索一种能够预测肿瘤免疫治疗预后的系统性生物标志物至关重要。
成纤维细胞生长因子受体(Fibroblast growth factor receptors, FGFRs)是一种典型的生长因子受体,主要包括FGFR1、FGFR2、FGFR3和FGFR4,具有胞内酪氨酸激酶结构域和胞外免疫球蛋白样结构域 [5] [6] [7] [8] 。成纤维细胞生长因子(FGFs)通过其受体(FGFRs)信号传导调节细胞存活、发育、分化、免疫和代谢 [9] [10] [11] [12] 。FGFR信号通路与其他几个重要的细胞内通路相关,如PI3K/Akt、Wnt、hedgehog和骨形态发生蛋白 [12] [13] 。FGFR突变在恶性肿瘤中常见,约占7% [12] 。然而,到目前为止,关于FGFRs家族在不同人类肿瘤中的系统性研究还很缺乏。
为了探索新的生物标志物来评估患者的免疫状态,并评估免疫治疗的敏感性,我们研究了来自TCGA数据库的泛癌组织样本中FGFRs的表达情况,并研究FGFRs表达与肿瘤微环境的关系。此外,我们从cBioPortal数据库下载了1662例接受免疫检查点抑制剂治疗的晚期癌症患者的测序结果 [14] 。最后,基于cBioPortal数据库的临床病理信息,我们开发了一个新的系统的列线图来预测接受免疫检查点抑制剂的癌症患者的预后。
2. 资料和方法
2.1. 数据下载和处理
本研究从TCGA数据库中下载泛癌数据,包括RNA-Seq转录组、临床数据、免疫亚型和基于mRNA (rnas)和DNA甲基化(DNAss)的干性评分。TCGA泛癌数据包括胃癌,非小细胞肺癌等33种肿瘤类型。其中15种肿瘤类型无或少于5个相关正常组织样本,因此对剩下的肿瘤类型进行了后续分析。共获得样本量11,057份。
从cBioPortal数据库下载了1662例接受ICIs治疗的晚期癌症患者的临床和疗效数据。通过二代测序(NGS)对患者的肿瘤进行了分析 [14] 。这项研究的临床信息包括年龄、性别、肿瘤类型(膀胱癌、乳腺癌、原发灶不明癌、结直肠癌、胶质瘤、头颈部癌、黑色素瘤、非小细胞肺癌、肾细胞癌)、药物类型(PD-1/PD-L1、CTLA-4、联合治疗)、生存时间、TMB等。为了探索每个FGFRs突变与ICIs患者生存期之间的关系,我们排除了原发灶不明的癌症患者样本。临床信息的详细信息见于表1。

Table 1. Clinical data of cBioPortal for cancer genomics
表1. cBioPortal数据库患者信息
2.2. FGFRs的生物信息学相关分析
我们分析了TCGA队列中肿瘤和正常组织之间FGFRs的差异表达情况。同时分析了FGFRs表达与患者总生存期之间的关系。通过ESTIMATE免疫评分和间质评分分析不同肿瘤微环境中免疫细胞和间质细胞的浸润水平。此外,我们定义了6种免疫亚型来测量肿瘤微环境中的免疫浸润,使用免疫亚型分析FGFRs表达和肿瘤微环境中免疫浸润类型之间的关系。采用Spearman相关法检测FGFRs表达与各评分之间的关系。
2.3. 列线图的构建
在cBioPorta数据库中分析肿瘤和正常组织之间FGFRs的突变情况。在本研究中,采用Kaplan-Meier生存分析方法分析FGFRs突变的生存差异,并采用log-rank检验检测显著差异。根据Kaplan-Meier生存分析选择的变量构建列线图。采用R软件包“rms”构建列线图。此外,我们通过C-index和矫正曲线来评估预后列线图的准确性。
2.4. 统计分析
采用R 3.6.1软件、Perl软件和GraphPad Prism 9.0软件进行统计学分析。采用Wilcoxon检验方法分析FGFRs在肿瘤和正常组织中的表达差异。Kaplan-Meier分析采用时序检验比较不同组间的生存差异。P < 0.05定义为差异具有统计学意义。
3. 结果
3.1. 泛癌中FGFRs的表达和预后关系
FGFR1在BLCA、BRCA、COAD、LUAD、LUSC、PRAD、READ、THCA、CESC、LIHC、SKCM、UCEC的正常组织中的表达高于肿瘤组织(图1)。FGFR1在CHOL和PCPG的肿瘤组织中的表达高于正常组织。FGFR2在BRCA、COAD、KICH、KIRC、KIRP、LUAD、PRAD、READ、THCA、BLCA、GBM、PCPG、UCEC、LICH的正常组织中表达高于肿瘤组织。FGFR2在SKCM和CHOL肿瘤组织中表达高于正常组织。FGFR3在COAD、GMB、KICH、KIRC、KIRP、LUAD的正常组织中表达高于肿瘤组织。FGFR3在BRCA、CESC、CHOL、ESCA、LIHC、LUSC、SKCM、STAD、THCA肿瘤组织中表达高于正常组织。FGFR4在KICH、LUAD、LUSC、PCPG、THCA的正常组织中表达高于肿瘤组织。FGFR4在BRCA、CHOL、COAD、ESCA、HNSC、KIRP、LIHC、READ、STAD、UCEC肿瘤组织中表达高于正常组织。
所有FGFRs在不同癌症中均有显著差异表达(图1(B))。FGFR1、FGFR2在肿瘤中主要下调,FGFR3、FGFR4除少数例外主要上调。此外,基于Spearman相关性检验,FGFR2和FGFR3 (r = 0.33, P < 0.005)、FGFR1和FGFR3 (r = −0.22, P < 0.005)的相关性最高,表明它们可能共享一些共同的通路或功能(图1(C))。
为了预测哪些FGFRs促进或抑制肿瘤发生,我们利用33种癌症类型的原发肿瘤样本探讨了FGFRs表达与预后之间的关系(图1(D))。FGFR1高表达与LGG (P = 0.002)、SARC (P = 0.015)和BLCA (P = 0.021)的不良预后相关。FGFR1低表达与SARC的不良预后相关(P = 0.015)。此外,FGFR2低表达与CESC (P = 0.007)和HNSC (P = 0.004)的不良预后相关。FGFR3低表达与CESC的不良预后相关(P = 0.025)。FGFR3高表达与LGG (P = 0.032)和UVM (P = 0.043)的不良预后相关。FGFR4高表达与LIHC (P = 0.034)和SKCM (P = 0.029)的不良预后相关。FGFR4低表达与STAD患者不良预后相关(P = 0.032)。一般而言,FGFRs表达的改变主要与预后相关,但关联的方向因FGFRs成员和癌症类型而异(图1(E))。
3.2. FGFRs的表达与肿瘤微环境和免疫应答相关
ESTIMATE算法,可以根据基因表达信息估计样本的基质分数(stromal score)和免疫分数(immune score),用于代表基质和免疫细胞的存在。在这项工作中,我们使用ESTIMATE算法分析了FGFRs的表达与肿瘤微环境中组织浸润的免疫细胞群和基质细胞群的群体丰度之间的相关性。在BRCA、LUSC、CESC和SKCM中,FGFR1与间质评分呈显著正相关(P < 0.0001)。FGFR1与UVM和THYM的间质评分呈显著负相关(P < 0.0001)。此外,FGFR2与SARC、PRAD、THCA、LUSC、LUAD和SKCM的间质评分显著正相关(P < 0.0001)。FGFR2与间质评分在LGG和LIHC中呈显著负相关。此外,FGFR3与PCPG和BRCA的间质评分显著正相关(P < 0.0001)。FGFR3与间质评分在COAD、HNSC、STAD、PRAD、KIRP、LUSC和KIRC中呈显著负相关(P < 0.0001)。在KIRC、COAD、LIHC、STAD、THCA、SKCM、LAML、PAAD中,FGFR4与基质评分呈显著负相关(P < 0.0001) (图2(A))。此外,我们在免疫评分中观察到与基质评分测试相似的结果(图2(B))。
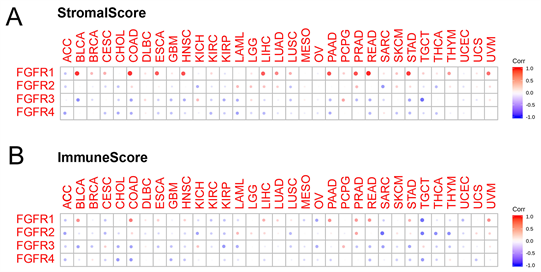
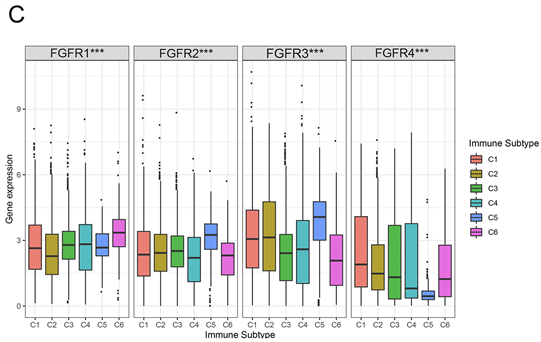
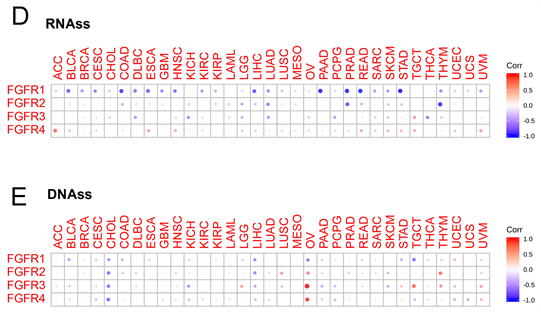
Figure 2. The role of FGFRs in tumor microenvironment and tumor stemness
图2. FGFRs的表达与肿瘤微环境和肿瘤干性关系
接下来,我们分析了FGFRs和肿瘤免疫浸润的相关性。在肿瘤中发现了六种类型的免疫浸润,包括C1 (伤口愈合),C2 (IFN-γ优势),C3 (炎症),C4 (淋巴细胞耗尽),C5 (免疫安静)和C6 (TGF-β优势),分别对应肿瘤促进和肿瘤抑制作用。既往研究表明,C3和C5免疫亚型患者的生存期明显优于其他免疫亚型,C4和C6型患者的生存期最差。FGFR1在C6免疫亚型中表达较高。FGFR1可能发挥促癌作用,因此这些类型的患者预后较差。FGFR2和FGFR3的高表达与C5免疫亚型相关。这表明FGFR2和FGFR3可能在肿瘤抑制中发挥主要作用。此外,FGFR4在C1免疫亚型中也有较高的表达(图2(C))。
在肿瘤发展过程中,肿瘤细胞可能逐渐失去其分化表型而获得干细胞样特征。目前测量肿瘤干性的方法主要有基于mRNA表达的RNA干性评分(RNAs)和基于DNA甲基化模式的DNA干性评分(DNAss)两种。在不同的癌症中,FGFRs与RNAs和DNAss显示出不同程度的相关性(图2(D)和图2(E))。不同类型的FGFRs在不同的RNAs和DNAss中显示出不同的相关性。例如,我们发现FGFR1主要与RNAs和DNAss负相关。FGFR4主要与RNAs呈正相关。这些结果表明,RNAs和DNAss可以识别不同肿瘤中具有不同特征或干性程度的不同细胞群。
3.3. cBioPortal癌症基因组学的FGFRs分析
FGFR1、FGFR2、FGFR3和FGFR4的突变频率分别为1.4%、3%、4%和1.9% (图3(A))。接下来,我们在癌症基因组学cBioPortal队列的不同肿瘤样本中观察了FGFRs的遗传改变状态(图3(B))。FGFRs的表达与接受ICIs治疗的癌症患者的预后密切相关(P = 0.0096) (图3(C))。此外,FGFRs的突变状态与高TMB值相关(图3(D))。在cBioPortal队列中,FGFR1-4突变与较高的TMB值相关(P < 0.0001) (图3(E))。
3.4. 列线图的构建
共整合了1571例癌症患者的基因突变信息和临床数据构建列线图。有许多临床病理变量被证实与ICIs治疗的癌症预后显著相关,包括FGFR1突变(P = 0.0443)、FGFR2突变(P = 0.0094)、FGFR4突变(P = 0.0462)、年龄(P = 0.0051)、药物类型(P < 0.0001)和TMB (P < 0.0001) (图3(F))。然而,FGFR3与患者预后无关。因此,FGFR1突变、FGFR2突变、FGFR4突变、年龄 ≥ 50岁、联合治疗、高TMB的癌症患者可能从ICIs治疗中获益。最后,我们基于这些变量建立了系统的列线图(图3(G))。该列线图的C-index为0.722 (95% CI 0.686~0.773)。这表明列线图在预测接受ici的晚期癌症患者预后方面具有潜在的临床价值。校准曲线显示我们的列线图具有良好的预测能力。校准曲线中的虚线对应的误差范围为10% (图3(H))。基于以上研究,我们合理地得出结论,FGFRs突变可能作为一种新的ICIs生物标志物。
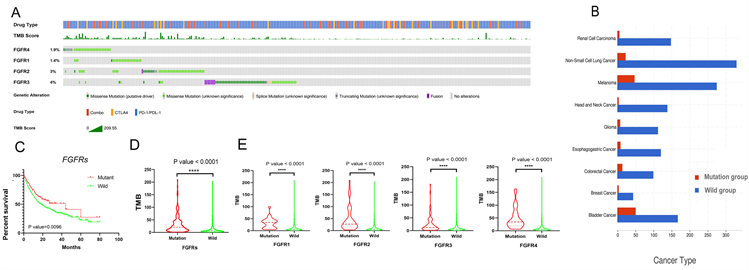
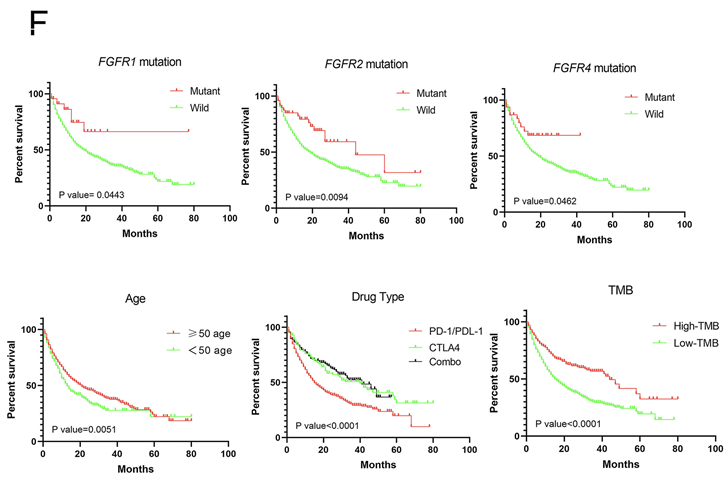
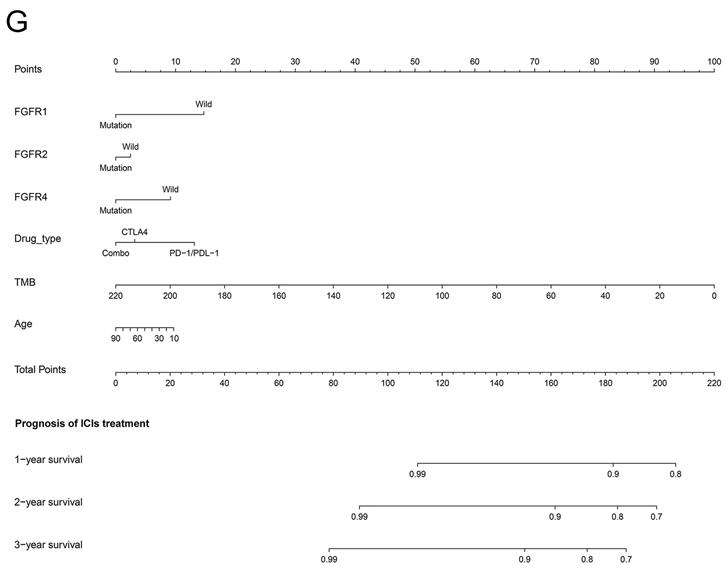
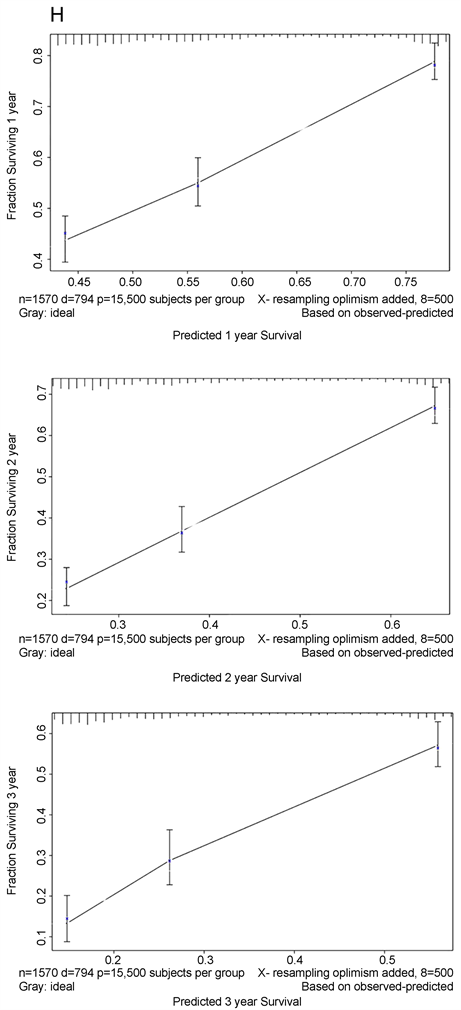
Figure 3. Analysis of FGFRs by cBioPortal Cancer Genomics
图3. cBioPortal癌症基因组学的FGFRs分析
4. 讨论
目前,免疫治疗最大的挑战是确定生物标志物,筛选最有可能从免疫治疗中获益的患者,从而开发新的有效治疗策略来提高疗效,以及克服治疗相关的毒性。随着深度测序技术的发展,FGFR信号通路在实体瘤中频繁发生分子改变 [15] 。既往研究表明,FGFR4可作为对ICIs敏感的晚期非小细胞肺癌患者的一种新型生物标志物 [16] 。
根据现有的报道,FGFRs在接受ICIs治疗的晚期患者中的作用机制尚不明确。目前尚缺乏研究证实FGFRs是否可作为免疫治疗的生物标志物。本研究首次利用大数据库建立了晚期肿瘤患者ICIs治疗预后的列线图预测模型,无疑为晚期肿瘤患者ICIs治疗提供了新的临床策略。此外,我们首次对FGFRs进行了系统的泛癌分析,并首次阐明了FGFRs在免疫治疗晚期癌症预后中的作用。明确了FGFRs在晚期肿瘤预后中的价值。FGFRs突变及其功能缺陷与肿瘤免疫治疗的敏感表型密切相关。基于我们的工作,我们认为FGFRs可能是晚期癌症免疫治疗和预后的重要生物标志物。
5. 总结
综上所述,我们提供了泛癌研究中所有FGFRs的全面和系统的特征,并研究了它们在癌症类型、免疫亚型和ICIs生物标志物中的作用。我们的工作将有助于揭示它们在肿瘤发生中的作用,特别是在免疫反应、肿瘤微环境和免疫治疗中的作用。FGFRs可作为接受免疫检查点抑制剂治疗的晚期癌症患者的潜在生物标志物。此外,我们的系统列线图为晚期癌症患者使用免疫检查点抑制剂提供了新的临床治疗策略。
基金项目
江西省卫生健康委科技计划(SKJP22020992)。
NOTES
*通讯作者。