1. 引言
特发性肺纤维化是一种原因不明,组织病理学表现为普通型间质性肺炎(Usual Interstitial Pneumonia, UIP),局限于肺部的慢性致纤维化型间质性肺炎。其发病机制可能与肺泡上皮受损及损伤后的反复异常修复有关,损伤后的肺泡上皮细胞不能通过再生正常修复;并释放多种促纤维化细胞因子,导致成纤维细胞的增殖失调,细胞外基质蛋白增多,基质聚集,形成肺纤维化实质破坏。与其他类型肺间质纤维化不同,特发性肺纤维化预后差,治疗手段有限,因此,早期发现肺间质纤维化,寻找可靠监测指标,对改善患者预后有重要意义;且既往无明确研究对比西宁地区(即中度海拔地区)与平原地区肺间质纤维化的发病特点,对该地区特发性肺纤维化的发病率和严重程度尚属空白。因此,如何能提高该地区特发性肺间质纤维化诊疗水平是临床工作重点。
目前对于特发性肺纤维化的检查手段包括:高分辨CT、支气管镜检查、外科肺活检、肺功能检查和血清生物标志物检查,肺功能不适合重症患者,且对患者配合度要求较高;肺活检及经支气管镜冷冻肺活检虽能明确病理,但受患者生理情况影响,如重度肺功能障碍、有凝血功能障碍出血倾向者属于相对禁忌;因HRCT对IPF中典型UIP诊断意义较大,其病理诊断的阳性预测值为90%~100% [1] ,UIP特征性表现是胸膜下和肺基底部分布为主的蜂窝影,伴或不伴外周牵拉性支气管扩张,故目前多用HRCT作为特发性肺间质纤维化初步筛查的诊断工具及长期随诊监测手段。关于特发性肺纤维化的血清学生物标记物目前正在探索中,如骨桥蛋白,CCL18,基质金属蛋白酶7 (MMP7)、表面活性蛋白D (SP-D)、涎液化糖链抗原(KL-6),甚至CA 19-9和CA-125也可作为潜在标记物 [2] 本研究旨在探讨特发性肺间质纤维化患者血清KL-6指标对疾病预测价值。
2. 资料和方法
选取2022年3月至2022年8月青海省人民医院呼吸与危重症医学科住院诊断为特发性肺纤维化的患者为研究对象,年龄在45~80岁之间,居住于西宁地区10年以上,平均年龄(66.48 + 9.32)岁。本项目主要是由于中海拔的地区对人体的影响主要体现在低压、低氧,尤其为低氧,机体会继发一系列生理或病理改变适应环境。国内外关于测定血清KL-6、PaO2/FiO2与尼达尼布、吡非尼酮、糖皮质激素不同药物在中海拔地区特发性肺纤维化的疗效评估的研究甚少,导致该地区特发性肺纤维化病人预后差,病死率高,加重社会的经济负担。为改善中海拔地区特发性肺纤维化病人预后提供理论参考依据。
2.1. 纳入标准
1) 符合2018年美国胸科学会联合欧洲呼吸学会、日本呼吸学会以及拉丁美洲胸科协会颁布的特发性肺纤维化治疗指南中的相关诊断标准且经影像学检测证实;2) 近两个月内未服用过免疫抑制剂或皮质类固醇药物;3) 自愿配合本次研究并签署知情同意书,符合医学伦理。排除标准:1) 合并其他呼吸系统疾病,如慢性阻塞性肺疾病、支气管哮喘、恶性肿瘤等;2) 血流动力学不稳定(如急性左心衰、恶性心律失常等);3) 合并其他系统性疾病的患者,如严重肝、肾功不全、血栓、神经肌肉疾病、消化道大出血等;4) 患有精神类疾病、中重度骨质疏松。同时选择健康受试者29例作为对照组。
2.2. 方法
2.2.1. HRCT评分标准
读取固定3个层面影像,根据纤维化征象面积占对应肺野比例,最终取平均值进行评分,0分:无纤维化征象;1分:1%~25%;2分:26%~50%;3分:及51%~75%;4分:76%~100% [3] 。
2.2.2. KL-6检测
对象均禁饮禁食10 h以上,于次日抽取晨起空腹肘正中静脉血4 mL,采用低温高速离心机以3000 r/min的速度进行离心,取上清血液,放于−80℃超低温冰箱中低温保存。采用酶联免疫吸附法测定血清KL-6。
2.3. 统计学方法
采用SPSS 20.0软件包进行统计学数据分析,计量资料比较釆用独立样本t检验。采用Pearson进行相关性检验分析。采用ROC曲线分析血清KL-6评分对于特发性肺纤维化患者的诊断价值,p < 0.05具有统计学意义。
3. 结果
1) 健康人群组和IPF组KL-6的之间的差异比较结果见表1。

Table 1. Comparison of KL-6 between healthy people and IPF group
表1. 健康人群和IPF组KL-6对比
2) 淋巴细胞、氧和指数、CT值与KL-6之间的线性相关,上述数据均符合正态分布,故采用采用Pearson相关性检验分析。见表2。

Table 2. Linear correlation between lymphocytes, oxygenation index, CT number and KL-6
表2. 淋巴细胞、氧合指数、CT值与KL-6之间的线性相关
3) 健康对照组与IPF组血清KL-6 ROC曲线
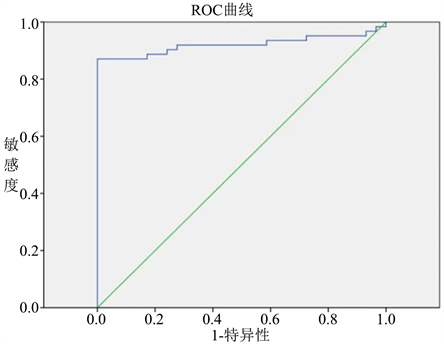
曲线下面积:0.921,p = 0.000 ≤ 0.05。
4. 讨论
KL-6是一种大分子糖链蛋白,是黏液唾液酸化的人黏蛋白1上的糖链。人黏蛋白1由1个大的细胞外结构域、1个单程跨膜区域和1个细胞内胞质尾部组成。起初作为一种肿瘤标志抗原进行研究,属于分类为Cluster 9的上皮性粘蛋白1 (MUC1),表达于肺、胃、胰腺和乳腺的正常腺上皮细胞,表达稳定,其在支气管肺泡灌洗液中有较高浓度,且还存在于血液循环中。不受肺部感染及吸烟影响,在我们观察到的数据中,性别、淋巴细胞、年龄与KL-6水平无显著性相关。KL-6在肺部主要集中在II型肺泡上皮细胞表面,在正常肺组织和终末细支气管上皮细胞有极少量表达,在退变的II型肺泡上皮细胞表达增强。KL-6对细胞粘附具有调节功能,并对人成纤维细胞具有趋化性。若肺部基底膜的损害,可致血管通透性增加,使KL-6入血。通常在中国患者中,KL-6以500 U/mL作为诊断的cut-off值。
血清KL-6可反映肺泡损伤。在过去20年中,血清KL-6作为评估ILD疾病严重程度的生物标志物进行了广泛研究,研究较多的集中在IPF和结缔组织病(CTD)相关ILD患者中 [4] [5] [6] ,且KL-6在ILD中参与一些重要过程,如KL-6参与成纤维细胞的趋化性及抗凋亡作用,可以反映肺泡细胞的损伤和再生,且是肺纤维化的重要生物标志物。因此,KL-6被认为是诊断ILD的核心生物标志物,并与疾病活动密切相关,可以提供预后信息 [7] [8] 。而在肺间质性疾病中,特发性肺纤维化外周血KL-6值显著高于其他类型的肺间质纤维化,如肺结节病和隐源性机化性肺炎 [9] 。我们的研究中,西宁地区特发性肺纤维化人群KL-6水平显著高于健康人群,且ROC曲线中AUC大于0.5,肯定了KL-6在特发性肺疾病中的诊断价值。
在一项纳入了549例类风湿性关节炎、系统性硬化症、炎性肌炎和其他CTDs (结缔组织疾病)伴或不伴ILD患者中观察KL-6水平及CT半定量分级的关系,发现CTD-ILD患者血清KL-6水平升高,且与CT分级呈正相关,与FVC、DLCO呈负相关 [5] 。我们的研究也证实了在特发性肺纤维化中血清KL-6与CT评分呈明显相关性,同时,也对KL-6与淋巴细胞、氧合指数进行相关性分析,未发现相关性,可能与样本量偏少有关。在研究过程中,因新冠肺炎疫情反复,导致部分患者未能及时进行病情评估,同时,特发性肺纤维化患者部分呈现快速进展,生存期短,中途失访及脱落。
综上,KL-6水平提示肺泡损伤,联合CT评分可显著提高患者特发性肺纤维化的诊断率。目前对于KL-6的监测,不仅用于诊断,在治疗期间的疗效评估及预后评估也有十分重要的意义,临床仍需不断探索证明。