1. 引言
乳腺癌是影响全世界妇女的最普遍的癌症之一,也是女性癌症相关死亡的主要原因。根据美国癌症协会的数据,在美国,每8名妇女中就有1人在其一生中被诊断为浸润性乳腺癌,每39人中就有1人最终死于此病。根据雌激素受体(ER)或孕激素受体表达状态和人类表皮生长因子2 (HER2)基因扩增情况,乳腺癌被分为三个主要亚组:激素受体+/HER2−、HER2+和三阴性乳腺癌。由于乳腺癌患者的分子水平上具有异质性,不同亚组之间的治疗和结果有很大的不同。目前乳腺癌的治疗方案通常是将手术与多种辅助治疗相结合,如化疗、放疗、内分泌治疗、靶向治疗和免疫治疗。对早期乳腺癌,手术是主要的治疗手段,可采取保乳手术或全乳房切除手术。对于晚期乳腺癌,手术常作为其综合治疗方案中的一个组成部分。放疗可以减少癌细胞的生长和扩散,常常用于手术后的辅助治疗,或用于晚期乳腺癌的症状缓解。化疗利用化学药物杀灭癌细胞,可在手术前、手术后或单独使用,可有效减少乳腺癌的复发和转移。对于雌激素受体+的乳腺癌,内分泌治疗可通过阻止雌激素的作用来抑制癌细胞的生长。靶向治疗针对乳腺癌细胞表面的分子靶点,通过抑制或阻断细胞生长和扩散来治疗乳腺癌。尽管包括手术、放疗和抗癌药物以及诊断在内的治疗方法取得了重大进展,降低了癌症相关的死亡率,但临床医生仍然面临治疗耐药引起的癌症复发、转移和死亡的挑战。而且,大多数患者在一定时间内对初始治疗有反应,但仍有一些乳腺癌,特别是三阴性乳腺癌,会发展成侵袭性更强的肿瘤形式,导致预后不良 [1] [2] [3] [4] [5] 。因此,有必要确定与乳腺癌异质性相关的预后因素,以准确预测患者生存。
肿瘤微环境(TME)主要由周围血管、炎症细胞、免疫细胞、淋巴细胞、成纤维细胞和细胞外基质组成 [6] 。到目前为止,越来越多的证据表明TME与肿瘤发生、癌细胞增殖、侵袭和转移密切相关。然而,这种联系也证明了一种很有前景的靶点,可用于癌症治疗。多项研究显示TME中的免疫细胞可以影响肿瘤生长,这为TME中的肿瘤浸润免疫细胞(TIC)提供了一种有希望的治疗方案 [7] 。例如,肿瘤浸润淋巴细胞(TIL)已被报道为胃癌患者的预后因素 [8] [9] [10] 。
外核苷酸焦磷酸酶/磷酸二酯酶6 (ENPP6)是ENPP家族的一员。该家族与许多关键的生物学和病理生理过程有关,包括核苷酸和磷脂信号、骨矿化、纤维化疾病和肿瘤相关免疫细胞浸润 [11] [12] 。目前ENPP6在乳腺癌中的作用尚不明确。因此,本研究使用生物信息学分析探索ENPP6在乳腺癌中的表达情况,同时分析其与免疫细胞浸润的关系。
2. 材料和方法
2.1. 基于GEPIA数据库的分析
GEPIA数据库是由北京大学张泽民教授团队开发的RNA-seq数据库,收录TCGA和GTEx数据库中的转录组数据、临床信息和生存数据。该数据库包括9736个肿瘤样本和8587个正常样本。我们使用GEPIA中的RNA-seq数据进行分析。首先,我们比较正常组织和乳腺癌组织中的ENPP6基因的表达。我们使用箱线图来进行可视化。
2.2. 基于TIMER数据库的分析
TIMER数据库可以提供免疫细胞浸润的在线分析,其提供的免疫细胞包括B细胞、CD4+T细胞、中性粒细胞、巨噬细胞和树突状细胞。我们使用散点图来表示样本中免疫细胞丰度与基因表达量之间的关系。除此之外,TIMER数据库还支持泛癌分析。我们使用箱线图来表示ENPP6在每种癌症和正常组织的表达情况。
2.3. 通过TCGA数据库的分析
我们下载了TCGA数据库中所有乳腺癌和正常组织的RNA-seq数据。使用“tinyarray”R包可视化肿瘤患者和正常患者的ENPP6基因的表达差异。根据ENPP6的表达将所有乳腺癌患者分成高ENPP6组和低ENPP6患者。对两组患者进行总体生存的分析,并通过Kaplan-Meier曲线绘制来可视化两组的预后上的差异。
2.4. 数据分析
本研究的统计学分析都是使用R软件进行(4.1.3版本)。p < 0.05被定义为有统计学意义。Kaplan-Meier曲线绘制使用“survminer”和“survival”R包进行。计量资料比较使用独立样本t检验。
3. 结果
3.1. ENPP6在泛癌中的表达情况
我们使用TIMER数据库来评估ENPP6在不同种类癌症和正常组织中的表达情况。如图1,ENPP6在14种癌症中表达与正常组织有差异,包括膀胱癌、乳腺癌、结肠癌、食管癌、头颈鳞癌、胆管癌、肾乳头状细胞癌、肺鳞状细胞癌、肺腺癌、前列腺腺癌、直肠癌、胃癌、甲状腺癌和子宫内膜样癌。有趣的是,在这14种癌症中ENPP6的表达均低于正常组织。随后,我们下载了TCGA中所有乳腺癌患者的基因表达数据、临床特征数据和生存数据。在排除生存信息缺失、临床特征数据和基因表达数据中任意一组数据缺失的样本后,我们分析了乳腺癌患者ENPP6的表达情况。如图2所示,ENPP6在乳腺癌中的表达较正常组织较高。
为了进一步探索ENPP6与乳腺癌预后之间的关系,我们使用“survminer”R包计算出患者的ENPP6表达最佳截断值,为0.325。表达高于截断值的患者被定义为ENPP6高表达患者,表达低于截断值的患者被定义为ENPP6低表达患者。K-M分析显示,ENPP6低表达患者预后较ENPP6高表达患者好(图3)。
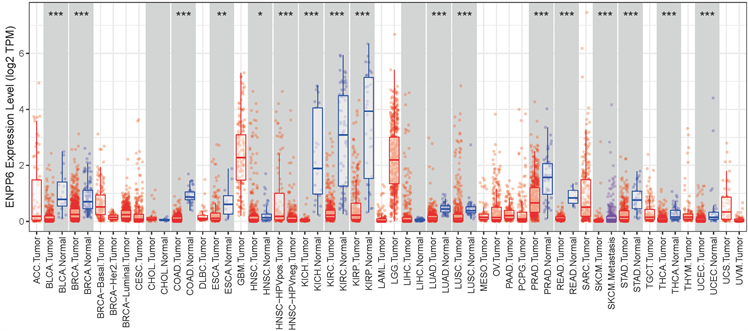 注:该柱状图中红色代表肿瘤组织中ENPP6的表达量,蓝色组织代表正常样本中ENPP6的表达量。*:p < 0.05,**:p < 0.01,***:p < 0.001。
注:该柱状图中红色代表肿瘤组织中ENPP6的表达量,蓝色组织代表正常样本中ENPP6的表达量。*:p < 0.05,**:p < 0.01,***:p < 0.001。
Figure 1. Expression of ENPP6 in different types of cancer and normal tissues
图1. ENPP6在不同种类癌症和正常组织的表达情况
 注:该柱状图中红色代表乳腺癌中ENPP6的表达量,蓝色组织代表正常乳腺组织中ENPP6的表达量。****:p < 0.0001。
注:该柱状图中红色代表乳腺癌中ENPP6的表达量,蓝色组织代表正常乳腺组织中ENPP6的表达量。****:p < 0.0001。
Figure 2. Expression of ENPP6 in breast cancer and normal tissues
图2. ENPP6在乳腺癌和正常组织的表达情况

Figure 3. Overall survival in patients with high and low expression of ENPP6
图3. ENPP6高表达患者和低表达患者总体生存率的比较
3.2. 免疫浸润分析
通过TIMER数据库,我们分析了ENPP6在乳腺癌中表达水平与样本的免疫细胞浸润水平之间的关系。如图4所示,在乳腺癌中ENPP6表达与B细胞(partial.cor = 0.144, p = 5.90e−06)、CD8+T细胞(partial.cor = 0.284, p = 1.46e−19)、CD4+T细胞(partial.cor = 0.346, p = 1.98e−28)、巨噬细胞(partial.cor = 0.21, p = 2.88e−11)、中性粒细胞(partial.cor = 0.319, p = 5.53e−24)、树突状细胞(partial.cor = 0.314, p = 3.51e−23)的浸润程度。basal乳腺癌中ENPP6表达与B细胞(partial.cor = 0.273, p = 2.17e−03)、CD4+T细胞(partial.cor = 0.292, p = 1.12e−03)、中性粒细胞(partial.cor = 0.3, p = 1.47e−03)、树突状细胞(partial.cor = 0.309, p = 8.28e−04)成正相关(p < 0.05)。HER-2乳腺癌中ENPP6表达与巨噬细胞(partial.cor = 0.356, p = 6.04e−03)成正相关(p < 0.05)。luminal乳腺癌中ENPP6表达与B细胞(partial.cor = 0.127, p = 3.01e−03)、CD8+T细胞(partial.cor = 0.353, p = 3.22e−17)、CD4+T细胞(partial.cor = 0.389, p = 8.37e−21)、巨噬细胞(partial.cor = 0.369, p = 6.46e−19)、中性粒细胞(partial.cor = 0.33, p = 4.55e−15)、树突状细胞(partial.cor = 0.319, p = 4.29e−14)成正相关(p < 0.05)。
3.3. ENPP6对于乳腺癌患者预后的预测
我们进一步使用timeROC R包来绘制ENPP6对于乳腺癌1年、3年和5年的预后预测的ROC曲线。如图5所示,ROC曲线下面积大小(AUC)分别为0.61 (1年)、0.60 (3年)和0.60 (5年)。

Figure 4. Relationship between ENPP6 expression and the level of immune infiltration in breast cancer (BRCA), BRCA-Basal, BRCA-HER2 and BRCA-luminal
图4. 在乳腺癌、Basal乳腺癌、HER2乳腺癌和luminal乳腺癌中ENPP6表达量与免疫细胞浸润水平的关系

Figure 5. ENPP6 ROC curves for predicting 1-year, 3-year and 5-year prognosis of breast cancer
图5. ENPP6预测乳腺癌1年、3年、5年预后的ROC曲线
4. 讨论
早期乳腺癌患者5年生存率明显高于发生邻近器官及淋巴结侵犯的患者,这说明早期发现乳腺癌为患者预后的提升十分有意义。但是,目前很少有方法可以精准预测乳腺癌的发生。因此,急需一个稳定的标志物来预测乳腺癌的发生。
在本研究中,我们首先评估了ENPP6在泛癌中的表达,结果显示在14种癌症中ENPP6在肿瘤组织中相比正常组织中均较低,差异具有统计学意义。该结果表示,ENPP6有作为区分正常组织和乳腺癌组织的分子标志物的潜力。此外,为了进一步发现ENPP6在乳腺癌中的意义,我们将TCGA数据库中所有乳腺癌患者的ENPP6基因进行生存分析,以发现ENPP6与总体生存率之间的关系。结果显示ENPP6高表达患者的总体生存较ENPP6低表达患者好(p < 0.05)。提示ENPP6可能具有抑制肿瘤发生、发展的特征。
本研究的另一个重要方面是ENPP6与不同的免疫细胞浸润水平相关。通过公共数据库分析,我们观察到ENPP6在所有分类的乳腺癌中和免疫细胞之间都具有相关性。其中Luminal亚型与免疫细胞浸润关联最密切,在分析的细胞中均可见相关性。其次是basal亚型,ENPP6表达与B细胞、CD4+T细胞、中性粒细胞和树突状细胞呈相关。而HER2乳腺癌中ENPP6表达只与巨噬细胞浸润相关,说明ENPP6在不同亚型乳腺癌中与免疫细胞浸润关系各不相同。而且,我们可以发现ENPP6与basal乳腺癌和luminal乳腺癌中与免疫细胞大多呈正相关。因此,我们推测ENPP6可能通过影响肿瘤免疫细胞浸润来对患者预后产生影响。但确定ENPP6如何影响各种免疫细胞和抗肿瘤活性是未来研究的一个重要领域。
准确预测乳腺癌患者的预后对患者病情的评估和指导个体化治疗非常有意义。而目前很少有能精准评估患者生存的分子标志物。因此,我们使用ENPP6在乳腺癌患者中的表达水平来预测1年、3年和5年的总体生存。ROC曲线显示ENPP6具有较好的预测能力。ENPP6具有作为预测乳腺癌患者预后的标志物的潜力。
综上所述,我们的研究为理解ENPP6在肿瘤免疫学中的潜在作用及其预后价值提供了见解。ENPP6 mRNA水平与乳腺癌的预后和免疫浸润水平相关,表明它有用作预后生物标志物的潜力。应评估ENPP6抑制剂干扰免疫细胞的可能性。