1. 引言
砜衍生物的合成是有机化学的一个探索方向,在生物活性化合物中有着广泛的应用 [1] [2] [3] 。β-酮砜的创新制备途径一直是有机化学领域的热点问题,特别是随着电催化有机合成的发展。基于电催化自由基磺酰化形成C-S键的文章的增长是显著的。β-酮砜是有机化学中一类非常重要的含氧化合物 [4] ,用途极为广泛。由于其特殊的生物学性质,以及广泛应用于合成天然产物 [5] 和各种重要的有机化合物,如乙烯砜、烯、酮和具有光学活性的β-羟基砜,它极大地吸引了有机合成化学家们以及激发了大家的研究兴趣 [6] 。鉴于其具有广泛的用途,β-酮砜的合成已经取得了阶段性的突破。常见合成β-酮砜的方法有:硝基乙烷引发 [7] 、O2氧化 [8] 、AgNO3/K2S2O8体系催化 [9] 、FeCl3/K2S2O8体系催化 [10] 、双蛋白体系催化 [11] 、光催化 [12] 、重氮砜与醛的反应 [13] 、IBX/I2 [14] ,以及磺酰氯与芳基乙炔的反应 [15] 。然而,这些方法大部分都存在局限性,比如需要使用昂贵的氧化剂、反应条件苛刻、副产物较多、需要多步反应来合成等。因此,发展一种不使用金属催化剂和外加氧化剂的合成方法来合成β-酮酚具有十分重要的意义。电化学合成是采用电子为氧化还原试剂、不使用金属催化剂便可发生反应的合成方法,不仅后处理简单,而且很大程度上可以减少对环境的污染,是一种非常绿色的合成方法。基于本课题组前期研究工作 [16] ,本工作利用电化学方法促使末端炔烃和金属芳烃亚硫酸盐合成β-酮砜,该反应避免了使用金属催化剂和外部添加剂。该研究具有操作简单、反应条件温和、对环境绿色友好等特点。
2. 实验部分
2.1. 仪器与试剂
GRX199-HY3005MT型直流稳压电源;RE-52C型旋转蒸发仪(上海兴创仪器设备有限公司);TBZ-14H型磁力加热搅拌器(上海隆拓仪器设备有限公司);XT4-100B型熔点仪(北京市科仪电光仪器厂);Varian Inoova-400型核磁共振谱仪(美国Varian公司);Varian Inoova-600型核磁共振谱仪(美国Varian公司);芳基炔类化合物(分析纯),上海泰坦科技股份有限公司;芳基亚磺酸钠类化合物(分析纯),上海泰坦科技股份有限公司;其余所用化合物、试剂均为分析纯。
2.2. β-酮砜的合成(以3a为例)
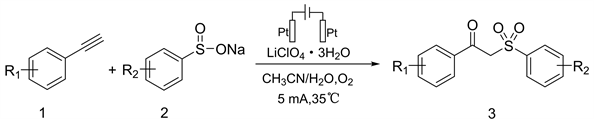
以合成化合物3a为例,向反应瓶中依次加入磁子、0.3 mmol LiClO4∙3H2O、0.45 mmol对甲基苯亚磺酸钠(2a)和3 mL 溶剂(CH3CN/H2O = 2:1),继续加入0.3 mmol苯乙炔(1a),插入Pt/Pt电极并通入O2,然后将反应瓶置于35℃的油浴锅中搅拌10 min后,通入5 mA电流进行恒流电解。用薄层色谱(TLC)监测反应进程。反应结束后,使用氯化钠饱和溶液和乙酸乙酯进行萃取,干燥,浓缩。粗产物通过柱层析法进行纯化,洗脱剂为石油醚/乙酸乙酯(V:V = 9:1),用柱层析法分离纯化得到50.8 mg白色固体1-苯基-2-对甲苯磺酰基乙酮(3a),分离产率62%。m.p.106~107℃ (lit. [17] 105~107℃);1H NMR (600 MHz, CDCl3),δ:7.94 (d, J = 12.0 Hz, 2H),7.76 (d, J = 12.0 Hz, 2H),7.61 (t, J = 6.0 Hz, 1H),7.47 (t, J = 12.0 Hz, 2H),7.32 (d, J = 6.0 Hz, 2H),4.72 (s, 2H),2.44 (s, 3H)。
用类似的方法合成3b~3i。
1-对氯苯基-2-对甲苯磺酰基乙酮(3b):39.7 mg白色固体,产率43%。m.p.136~137℃ (lit. [18] 136~138℃);1H NMR (400 MHz, CDCl3),δ:7.86 (d, J = 8.8 Hz, 2H),7.71 (d, J = 9.6 Hz, 2H),7.42 (d, J = 8.4 Hz, 2H),7.30 (d, J = 8.0 Hz, 2H),4.66 (s, 2H),2.42 (s, 3H)。
1-对氟苯基-2-对甲苯磺酰基乙酮(3c):42.2 mg白色固体,产率48%。m.p.130~131℃ (lit. [17] 128~130℃); 1H NMR (400 MHz, CDCl3),δ:7.96 (m, 2H),7.71 (d, J = 8.4 Hz, 2H),7.31 (d, J = 8.0 Hz, 2H),7.11 (t, J = 17.2 Hz, 2H),4.67 (s, 2H),2.42 (s, 3H)。
1-对溴苯基-2-对甲苯磺酰基乙酮(3d):38.1 mg白色固体,产率36%。m.p.142~143℃ (lit. [17] 141~144℃);1H NMR (400 MHz, CDCl3),δ:7.78 (d, J = 8.8 Hz, 2H),7.71 (d, J = 8.4 Hz, 2H),7.59 (d, J = 8.4 Hz, 1H),7.31 (d, J = 8.0 Hz, 2H),4.56 (s, 2H),2.43 (s, 3H)。
1-对甲苯基-2-对甲苯磺酰基乙酮(3e):46.7 mg白色固体,产率54%。m.p.104~105℃ (lit. [17] 103~105℃);1H NMR (400 MHz, CDCl3 ),δ:7.81 (d, J = 8.4 Hz, 2H),7.72 (d, J = 8.4 Hz, 2H),7.29 (d, J = 8.0 Hz, 2H),7.23 (d, J = 8.4 Hz, 2H),4.67 (s, 2H),2.39 (d, J = 6.8 Hz, 6H)。
1-苯基-2-苯磺酰基乙酮(3f):43.6 mg白色固体,产率56%。m.p.94~95℃ (lit. [17] 93~95℃);1H NMR (600 MHz, CDCl3),δ:7.85 (d, J = 12.0 Hz, 2H),7.82 (d, J = 6.0 Hz, 2H),7.58 (t, J = 6.0 Hz, 1H),7.53 (t, J = 6.0 Hz, 1H),7.46 (t, J = 6.0 Hz, 2H),7.39 (t, J = 6.0 Hz, 2H),4.67 (s, 2H)。
1-对甲苯基-2-对氟苯磺酰基乙酮(3g):48.2 mg白色固体,产率55%。m.p.157~158℃;1H NMR (600 MHz, CDCl3),δ:7.93 (dd, J = 6.0, 5.0 Hz, 2H),7.85 (d, J = 6.0 Hz, 2H),7.30 (d, J = 6.0 Hz, 2H),7.22 (t, J = 12.0 Hz, 2H),4.74 (s, 2H),2.44 (s, 3H)。
1-对甲苯基-2-苯磺酰基乙酮(3h):42.7 mg白色固体,产率54%。m.p.124~125℃ (lit. [17] 120~123℃);1H NMR (600 MHz,CDCl3),δ:7.89 (d, J = 6.0 Hz, 2H),7.83 (d, J = 6.0 Hz, 2H),7.66 (t, J = 6.0 Hz, 1H),7.54 (t, J = 6.0 Hz, 2H),7.27 (d, J = 12.0 Hz, 2H),4.71 (s, 2H),2.42 (s, 3H)。
1-对溴苯基-2-对氟苯磺酰基乙酮(3i):36.3 mg白色固体,产率34%。m.p.180~181℃;1H NMR (600 MHz, CDCl3),δ:7.90 (dd, J = 6.0, 5.0 Hz, 2H),7.82 (d, J = 12.0 Hz, 2H),7.65 (d, J = 12.0 Hz, 2H),7.24 (dd, J = 6.0, 8.2 Hz, 3H),4.70 (s, 2H)。
3. 结果与讨论
3.1. 反应条件的优化
为获得合成β-酮砜类化合物的最优条件,以对苯乙炔(1a)和对甲基苯亚磺酸钠(2a)为底物建立模板反应,实验过程中分别考察了电极的种类、电解质的种类、电流的大小、温度、溶剂等因素对模板反应的影响。首先以二氯乙烷(DCE)为溶剂,四丁基四氟硼酸铵(n-Bu4NBF4)作为电解质,使用Pt/Pt电极,通入5 mA电流在室温下进行了初步尝试,实验结果如表1所示。当使用Pt/Pt电极时,得到了目标产物3a,但是收率不高,仅为20% (Entry 1);当使用Pt/C电极时,3a的收率下降为15% (Entry 2);当使用C/C电极时,反应时间变长,收率更低,仅为13% (Entry 3)。因此,在后续的条件优化中,选择Pt/Pt电极作为反应电极。下一步工作中考察了乙醇(EtOH)、甲醇(MeOH)、乙腈(CH3CN)、乙酸乙酯/水(EA/H2O)、乙腈/水(CH3CN/H2O)等溶剂对反应的影响,研究过程中发现,溶剂对反应的影响较大,当以MeOH、CH3CN、EA/H2O为反应溶剂时,几乎没有目标产物3a生成(Entry 4~6);当以EtOH为溶剂时,反应收率为15% (Entry 7);当以CH3CN/H2O为溶剂时,反应收率上升,收率为30% (Entry 8)。接下来又考察了四丁基碘化铵(n-Bu4NI)、四丁基溴化铵(n-Bu4NBr)、四丁基硫酸氢铵(n-Bu4NHSO4)、四丁基高氯酸铵(n-Bu4NClO4)、三水合高氯酸锂(LiClO4∙3H2O)等电解质对反应的影响,研究过程中发现,当以n-Bu4NI、n-Bu4NBr为电解质时,没有目标产物3a生成(Entry 9~10);当以n-Bu4NHSO4、n-Bu4NClO4为电解质时,反应收率下降(Entry 11~12);但是当以LiClO4∙3H2O作为电解质时,反应收率显著上升,收率为62% (Entry 13)。接下来对通入电流进行了考察,当通入电流为10 mA时,基本没有目标产物3a生成(Entry 14)。下一步工作对温度进行了考察,当反应温度为50℃时,反应收率下降为41% (Entry 15);当反应温度为80℃时,没有目标产物生成(Entry 16)。接下来又进行了两组对照实验探究:1) 当筛选出的其它反应条件不变,不通入O2时,几乎没有目标产物3a生成(Entry 17)。2) 当筛选出的其它反应条件不变,反应不进行通电时,没有目标产物生成(Entry 18)。

Table 1. Optimization of reaction conditions
表1. 反应条件的优化
3.2. 底物的拓展
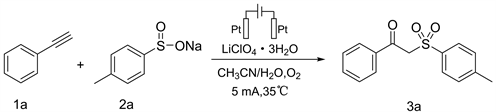
选用最佳模板条件:室温下以Pt/Pt电极、LiClO4∙3H2O作为电解质、CH3CN:H2O = 2:1为溶剂,通入O2,5 mA电流直接进行电解。分别考察了不同取代基的芳基炔和不同取代基的苯亚磺酸钠合成β-酮砜类化合物的反应情况,反应结果如图1所示。对于芳基炔类化合物,无论芳环的对位上含吸电子基团(氟、氯、溴),还是对位含供电子基团(甲基),均可实现相应β-酮砜的合成,产率为34%~62% (3a~3i)。芳环上取代基的种类会对β-酮砜合成产率有显著的影响,当芳基炔上带有供电子基团时,产物收率较高(3e),当芳基炔上带有吸电子基团时,产物收率下降(3b~3d)。当苯亚磺酸钠芳环上带有供电子基团时,反应收率要高于苯亚磺酸钠芳环上带有吸电子基团(3e和3g)。

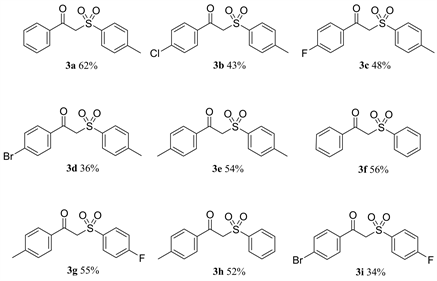
Figure 1. Application range of β-Ketosulfones substrate
图1. β-酮砜的底物适用范围
3.3. 反应机理
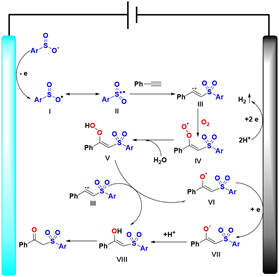
Figure 2. Reaction mechanism of β-ketosulfone compounds
图2. β-酮砜类化合物的反应机理
基于上述得到的结果,同时结合已报道的文献 [17] [18] 提出了可能的反应机理(图2)。起初,对甲基苯亚磺酸钠失去一个电子生成对甲基苯亚磺酸自由基I,I异构化生成磺酰自由基II,再将磺酰自由基与苯乙炔集合生成活性自由基III。随后,过氧自由基IV由自由基III捕获二氧生成,IV受到反应溶剂中水的作用生成中间体V,再通过还原生成化合物VI,最后化合物VI通过异构化反应生成β-酮酚(3a)。在机理探究过程中,做了两组对照实验。第一组,在最优反应条件下,不通入O2进行实验,发现目标产物3a的收率严重下降,几乎没有产物生成,因此说明该反应中O2直接参与反应。第二组,在最优反应条件下,不进行恒流电解,连续反应10 h发现并没有目标化合物生成,因此说明该反应在不通电的条件下无法发生反应。以上结果说明电化学促进β-酮砜的合成需要有O2参与反应,并且需要进行恒流电解。
4. 结论
综上所述,通过电化学合成方法促使芳基炔和芳烃亚磺酸钠在35℃下反应生成相应的β-酮砜类化合物。芳基炔的芳环上无论含有吸电子基团,还是含有供电子基团,都可以和芳烃亚磺酸钠实现相应β-酮砜类化合物的合成。同样地,芳烃亚磺酸钠的芳环上无论含有吸电子基团,还是含有供电子基团,也都可以和芳基炔实现相应β-酮砜类化合物的合成。相较其它合成β-酮砜类化合物的方法而言,该方法具有无金属催化和外加添加剂、后处理简单、反应条件温和、溶剂绿色等优点。
基金项目
新疆维吾尔自治区高校科研计划自然科学重点项目(NO. XJEDU2020I015)资助项目;新疆维吾尔自治区新疆师范大学2022年硕士研究生科研创新项目(NO. XSY202201007)资助项目。
NOTES
*通讯作者。