1. 引言
肺癌是我国乃至全世界发病率及死亡率最高的恶性肿瘤之一。根据最近的统计,全世界每年诊断出大约200万例恶性肿瘤,超过75%的患者死于这种疾病 [1] 。根据癌细胞的特征,肺癌通常分为两种亚型:非小细胞肺癌(Non-small cell lung cancer, NSCLC)和小细胞肺癌(Small cell lung cancer, SCLC),其中 NSCLC比SCLC更广泛,约占诊断肺癌病例的85% [2] [3] 。吸烟与肺癌之间的关系早已建立并得到证实 [4] ;然而,全世界大约25%的病例发生在非吸烟者身上,这一比例在亚洲甚至更高 [5] [6] 。最近的研究表明,除了吸烟,空气污染,包括接触厨房油烟,是一个不可忽视的危险因素,其他因素,如遗传易感性、不良饮食、职业暴露和空气污染,可能独立或与吸烟共同作用 [7] 。
NSCLC是临床中最为多见的肺癌类型之一,是起源于支气管黏膜、支气管腺体和肺泡上皮的一类肺恶性肿瘤性疾病,可分为腺癌、鳞状细胞癌、腺鳞癌、大细胞癌及肉瘤样癌等亚型 [7] 。早期肺癌患者一般无明显典型症状,中晚期患者则根据原发病灶位置的不同、是否有胸内播散、远处转移灶等情况,可出现咳嗽、咳痰或咯血、呼吸困难或喘鸣、发热、体重明显下降、声音异常、胸腔积水等不同症状 [2] 。由于大部分患者在发现NSCLC时已进入晚期,错过了最佳的手术时机,只能采取化疗手段来控制病情发展 [2] 。
许多实验积极评估MSC衍生的胞外囊泡(EV),包括外泌体(exosomes)和微泡(MV),在基于MSC的细胞治疗中的作用,MSC衍生的外泌体中包含细胞因子和生长因子、信号脂质、mRNA和调节miRNA的内容物。MSC外泌体可用于无细胞再生医学,这一过程很大程度上将取决于它们生产的质量、重复性和效力,这些参数决定了基于细胞治疗的MSC发展。然而,MSC外泌体的组成成分不是静态的,而是受MSC组织来源、其活性和和临近细胞类型的影响而改变,因此,当MSC与肿瘤细胞一起培养或在体内肿瘤微环境中培养时,由MSC产生的外泌体内的成分会发生改变。基于此,MSC外泌体可以为降低基于MSC的细胞治疗的风险 [8] 。脐带间充质干细胞外泌体将开启“无细胞”的干细胞治疗的新方法。
2. 材料与方法
2.1. 材料
A549非小细胞肺癌细胞购自武汉普诺赛生命科技有限公司购买;CD9一抗本购自美国abcam公司(ab236630);DAB显色试剂盒购自生工生物工程(上海)有限公司;研究利用的脐带由临沂市妇幼保健院产科提供(已取得临沂市妇幼保健院伦理委员会的许可:KYL-YXLL-2021025) BALB/c雄性裸鼠购自北京维通利华实验动物技术有限公司,共20只,荷瘤鼠分为模型对照组、低剂量外泌体组、中剂量外泌体组、高剂量外泌体组、化疗组,每组各4只裸鼠。利用脐带分离培养获取脐带间充质干细胞,进一步从培养液中分离获取外泌体。
2.2. CCK8检测方法
将对数生长期的A549细胞,以1 × 103个/孔的密度接种于96孔板内,细胞贴壁后移除培养液,分别加入100 μL含不同体积的外泌体(原液浓度:1 × 1011 particle∙mL−1) (模型对照组:0 μl、外泌体低剂量组:10 μl、外泌体中剂量组:20 μl、外泌体高剂量组:40 μl、化疗组:顺铂1 μl)的培养基,置于5% CO2、37℃的恒温培养箱中培养24 h。均设5个复孔,继续培养24 h、48 h、72 h、96 h后,将10 μl CCK-8溶液依次加入所有孔中,置于体积分数为5% CO2、37℃的恒温培养箱中继续孵2 h。使用酶标检测仪依次测定所有孔在450 nm处的吸光度值(A),每组实验重复3次。
2.3. 肺癌模型造模与制片
两人配合在小鼠后背部左右两侧分布注射1 × 106的细胞量,并给予低、中、高浓度外泌体及化疗药腹腔内注射,每周一次,共4次。裸鼠共分5组,每组4只:
① 模型对照组:1 × 106细胞(不打外泌体)
② 低浓度组:1 × 106细胞 + 低浓度外泌体(250 μL)
③ 中浓度组:1 × 106细胞 + 中浓度外泌体(500 μL)
④ 高浓度组:1 × 106细胞 + 高浓度外泌体(750 μL)
⑤ 化疗组:1 × 106细胞 + 顺铂25 mg/kg
观察6~8周后,肿瘤细胞注射部位有包块样肿瘤形成。脱颈法处死小鼠,将包块取出后置于10倍体积于组织大小的4%多聚甲醛中固定,4℃冰箱过夜,病理石蜡切片后进行H&E染色。
2.4. 外泌体提取方法
1) 上清液预处理:在去除杂质的离心上清液中加入Exosomoe Concentration Solution (ECS试剂),具体的加入剂量如下:细胞培养上清液20 mL加入ECS剂量5 mL;
2) 溶液混合:加入ECS试剂后将离心管盖紧,通过涡旋振荡器混匀1 min,再放置于4℃静置2 h;
3) 沉淀外泌体:取出装有混合液的离心管于4℃以10,000 q离心60 min,弃上清,沉淀中富含外泌体颗粒;(注:尽可能吸净上清液)
4) 外泌体重悬:取1 × PBS均匀吹打离心沉淀物,待其溶解后,将重悬液转移至新的1.5 mL离心管中;细胞上清20 mL样品体积加入0.2 mL PBS剂量;
5) 收获外泌体颗粒:将含有重悬液的1.5 mL离心管于4℃以12,000 q离心2 min,保留上清液,该上清液中富含外泌体颗粒。(注:若沉淀较多,可12,000 g/2 min离心多次至无明显沉淀,每次取离心上清液)
6) 纯化外泌体:将收获的外泌体颗粒粗品转入Exosomoe Purification Filter (EPF柱)上室中,于4℃以3000 q离心10 min,离心后收集EPF柱管底的液体,此液体即为纯化后的外泌体颗粒;
7) 外泌体的保存:纯化后的外泌体以50~100 μl进行分装保存于−80℃低温冰箱中,以备后继实验使用。
2.5. 划痕实验检测细胞迁移
1) 标记6孔板:使用marker笔在6孔板的底面画平行线。每个实验组三个复孔。
2) 铺6孔板:细胞计数后铺板,密度控制在第二天长满。
3) 制造划痕:用直尺比着,使用10 μl枪制造细胞划痕,划痕方向与标记线垂直。
4) 洗:PBS洗3次,充分洗去漂浮细胞。
5) 换液:换无血清培养基或低血清培养基(FBS ≤ 2%)。
6) 定时拍照:每次拍照前都用PBS洗3次,充分洗去漂浮细胞。
2.6. 统计学处理
将实验所得数据进行归纳整理,统计学分析采用Graphpad prism 7破解版软件进行数据处理,采用单因素方差分析CD9、肿瘤大小。P < 0.05为具有统计学差异。
3. 结果
3.1. 脐带间充质干细胞分离培养
剖宫产后获取脐带,使用装有DMEM-F12基础培养基的灭菌瓶从产房运输到临沂市出生缺陷重点实验室,75%酒精快速冲洗3遍,PBS冲洗3遍,使用眼科剪、眼科镊去掉脐动脉和静脉血管以及冲洗掉内部血液,剪成1.0 cm × 1.0 cm的组织块,先放入提前备好(0.5明胶铺皿)的10 cm培养皿中1 h促贴壁,随后加入完全培养基(DMEM-F12 + 10% FBS) 10 ml,隔天换液,第7~8 d组织周围开始爬出细胞,P3后可以冻存备用(图1)。
3.2. 脐带间充质干细胞外泌体提取及注射
根据外泌体提取试剂盒高速离心提取的溶液送暨南大学生科院进行检测,其形态、平均直径、分布主峰、浓度都符合实验要求,同时检测其特异标记物CD9、CD63、HSP70的表达(图2(A)~(D))。准备A549细胞及购买裸鼠,在裸鼠两后腿背侧分别注射1 × 106的细胞量,与此同时给予外泌体低剂量组、中剂量组、高剂量组分别腹腔注射250 μL、500 μL、750 μL的外泌体(1 × 109个/mL),在肿瘤形成的4周内每周注射外泌体一次,化疗组每周注射化疗药物(顺铂25 mg/kg)一次(图2(E)~(H))。
 (A):脐带去除动脉和静脉血管;(B):剪切好的脐带组织块放入备好的培养皿;(C):脐带组织块37℃培养箱静止促贴壁1 h后加完全培养基;(D):培养第7 d时可以观察到组织块周围有细胞爬出(200×);(E):培养第18 d时可以观察到组织块周围大量的细胞(200×);(F):P3冻存前脐带间充质干细胞的状态(200×)。
(A):脐带去除动脉和静脉血管;(B):剪切好的脐带组织块放入备好的培养皿;(C):脐带组织块37℃培养箱静止促贴壁1 h后加完全培养基;(D):培养第7 d时可以观察到组织块周围有细胞爬出(200×);(E):培养第18 d时可以观察到组织块周围大量的细胞(200×);(F):P3冻存前脐带间充质干细胞的状态(200×)。
Figure 1. Isolationg and culture of umbilical cord mesenchymal stem cells
图1. 脐带间充质干细胞分离培养
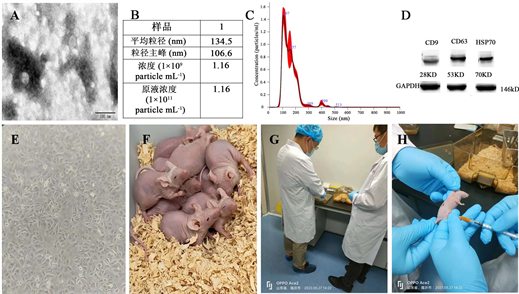 (A):电镜下的外泌体囊泡的形态(20万倍);(B):外泌体的主要特征;(C):外泌体流式分析其直径大小的平均分布;(D):WB检测外泌体所具有特异标记物的表达(200×);(E):A549细胞消化前的细胞状态(200×);(F):购买的裸鼠;(G):检查裸鼠;(H):给裸鼠注射外泌体。
(A):电镜下的外泌体囊泡的形态(20万倍);(B):外泌体的主要特征;(C):外泌体流式分析其直径大小的平均分布;(D):WB检测外泌体所具有特异标记物的表达(200×);(E):A549细胞消化前的细胞状态(200×);(F):购买的裸鼠;(G):检查裸鼠;(H):给裸鼠注射外泌体。
Figure 2. Isolation of exosomes from umbilical cord mesenchymal stem cells and injection of A549 cells
图2. 脐带间充质干细胞外泌体分离及A549细胞注射
3.3. A549肺癌模型肿瘤组织的取材及统计
荷瘤鼠第8周脱臼处死,去掉皮肤剥离取出肿瘤组织测量其大小(图3(A)、图3(C)),统计分析各实验组的差异,结果显示模型对照组与外泌体低剂量组、中剂量组、高剂量组的差异具有统计学意义(P < 0.05),对照组与化疗组的差异具有统计学意义(P < 0.05),而外泌体低剂量组、外泌体中剂量组、外泌体高剂量组之间的差异没有统计学意义(P > 0.05) (图3(B))。
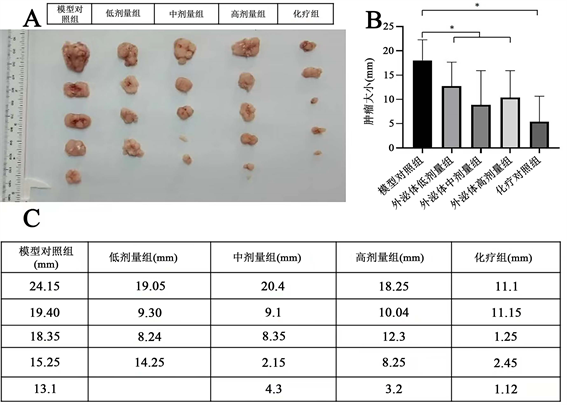 (A):荷瘤鼠(裸鼠)形成肿瘤的大小;(B):各实验组肿瘤大小的统计分析,外泌体低中高剂量组肿瘤组织的大小与模型对照组之间的差异具有统计学意义,化疗组肿瘤组织大小与模型对照组之间的差异具有统计学意义;(C):各实验组肿瘤组织测量的平均直径大小。
(A):荷瘤鼠(裸鼠)形成肿瘤的大小;(B):各实验组肿瘤大小的统计分析,外泌体低中高剂量组肿瘤组织的大小与模型对照组之间的差异具有统计学意义,化疗组肿瘤组织大小与模型对照组之间的差异具有统计学意义;(C):各实验组肿瘤组织测量的平均直径大小。
Figure 3. Statistical analysis of tumor size after injection of A549 cells
图3. A549细胞注射后形成的肿瘤规格测量统计分析
3.4. A549肺癌模型肿瘤组织免疫组化检测CD9的表达
肿瘤组织经过PFA固定后,常规石蜡切片进行CD9的免疫组织检测。结果显示模型对照组、化疗组没有CD9的表达,外泌体低剂量组、中剂量组、高剂量组表达CD9,而三组之间没有明显的差异(图4)。CD9表达的结果表明脐带间充质干细胞来源的外泌体吸收入血后,通过血流进入肿瘤组织作用于肿瘤细胞,抑制其增殖、迁移(图5)。
模型对照组的细胞迁移速度明显快于外泌体低剂量组、中剂量组、高剂量组三组,且三组之间有随着外泌体浓度的增高出现迁移能力逐渐减弱的现象,细胞状态显示细胞增殖速度也受到影响。化疗组显示细胞无法贴壁生长。
3.5. 外泌体对A549肺癌细胞增殖能力的影响
利用CCK8试剂盒检测外泌体对肿瘤细胞A549细胞增殖能力的影响(图6),模型对照组的细胞增殖能力高于外泌体低剂量组、中剂量组、高剂量组、化疗组,且外泌体低剂量组、中剂量组、高剂量组表现出细胞增殖能力逐渐减弱的现象,其中化疗组显示顺铂对细胞增殖增殖能力具有明显的抑制作用。
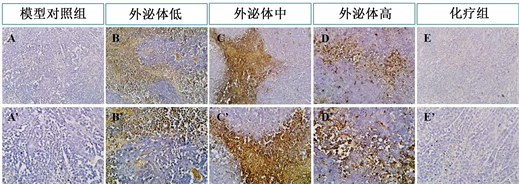 模型对照组(A, A’)与化疗组(E, E’)没有CD9的表达,外泌体低剂量组(B, B’)、中剂量组(C, C’)、高剂量组(D, D’)三组之间CD9的表达没有明显的差异。
模型对照组(A, A’)与化疗组(E, E’)没有CD9的表达,外泌体低剂量组(B, B’)、中剂量组(C, C’)、高剂量组(D, D’)三组之间CD9的表达没有明显的差异。
Figure 4. Expression of CD9 in tumor tissues of each experimental group after injection of umbilical cord mesenchymal stem cell exosomes
图4. 注射脐带间充质干细胞外泌体后各实验组瘤组织CD9的表达情况
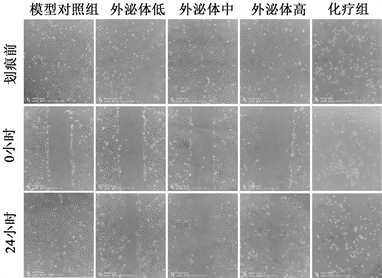
Figure 5. The effect of exosomes on cell migration was detected by A549 cell scratch assay
图5. A549细胞划痕实验检测外泌体对细胞迁移的影响
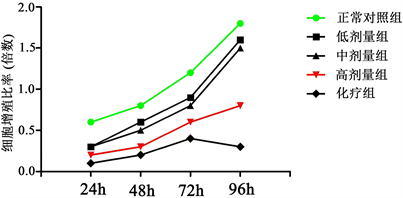
Figure 6. The effect of exosomes on A549 cell proliferation was detected by CCK8
图6. CCK8检测外泌体对A549细胞增殖的影响
模型对照组的细胞增殖能力高于外泌体低剂量组、中剂量组、高剂量组、化疗组,且外泌体低剂量组、中剂量组、高剂量组表现出细胞增殖能力逐渐减弱的现象。与化疗组相比其抑制细胞增殖的能力弱于顺铂对细胞增殖增殖能力的抑制。
4. 讨论
肺癌是一种高度流行的疾病,肺癌有着高发病率,且较低的5年生存率,具有重要的死亡率,现有治疗方法的有限疗效是导致该疾病存活率低的原因。常规化疗联合放疗可以改善预后,但相当一部分NSCLC患者对这些治疗没有反应 [9] [10] [11] [12] [13] 。临床治疗现状推促新的治疗手段的探索。
由于无创分离方法,没有伦理问题,免疫原性较低,自我更新能力更快,倍增时间更稳定,增殖能力更高,与其他来源相比,人脐带MSC (hUCMSC)是基于细胞的治疗和再生医学的首选候选者 [14] [15] 。然而,hUCMSC在维持生物活性、定量生物活性物质和临床治疗物流方面存在相对的局限性 [16] 。因此,寻找一种无细胞的方法具有相同的输出和功效似乎是必要的。
外泌体是一种平均大小在40~100 nm的纳米囊泡,由不同类型的细胞释放,含有蛋白质,mRNA,miRNA和DNA。外泌体通过生物分子传递改变受体细胞的生物化学特性,并在细胞通讯中发挥作用,是液体活组织检查中不为人知的成分之一。由于它们的膜起源,它们很容易与细胞融合,作为一个自然的传递系统,维持细胞的生物活性和免疫耐受性。有证据表明,间充质干细胞来源的外泌体(MSC-EXO)表现出与MSC相似的功能,具有低免疫原性和无肿瘤化。骨髓间充质干细胞也可以从包括人脐带(HUC)在内的各种来源分离出来。由于hUCMSC-EXO是一种非侵入性的采集方法,具有较高的增殖能力和较低的免疫原性,因此与其他MSC-EXO资源相比,hUCMSC-EXO经常被用于再生医学和各种疾病的治疗 [17] [18] ,由于它们的许多生物活性和细胞通讯,它们已经吸引了研究人员的注意力,作为基于细胞的无细胞疗法的新策略 [19] [20] 。
hUCMSC-EXO具有调节脓毒症诱导的急性呼吸窘迫症候群(ARDS)相关的各种生物事件的能力,包括细胞免疫代谢,促炎症细胞因子的产生,使其能够发挥治疗作用 [21] 。含有微小RNA (microRNA)的人脐带间充质干细胞的外泌体(Exosomes of human umbilical cord mesenchymal stem cells)已被强调为可能的癌症治疗选择 [22] 。外泌体中的miRNA促进细胞间高效传递的重要载体 [23] [24] 。MiR-598已被认为是不同类型癌症的肿瘤抑制剂,包括骨肉瘤 [25] ,大肠癌肿瘤和胃癌 [26] 。硬皮病是一种多系统疾病,其中组织纤维化是由炎症和血管损伤引起的。由于缺乏有效的治疗手段,硬皮病的死亡率一直居高不下。(hUCMSC-EXO)对小鼠急性肝衰竭(ALF)的治疗作用及其机制,在APAP诱导的ALF小鼠模型中,单尾静脉注射hMSC-EXO有效地提高了ALF小鼠的存活率,抑制了肝细胞的凋亡,改善了肝功能 [27] 。hUCMSC-EXO已被认为是各种自身免疫性疾病的潜在治疗方法,并且也可以作为治疗硬皮病的制剂 [28] 。
由于脐带间充质干细胞具有很好的抑制肿瘤发生发展的作用,但是截至目前开展对于NSCLC的作用研究较少。因此,本课题选用NSCLC细胞株A549为研究对象。研究来自hUCMSCs来源的hMSC-Exo与非小细胞肺癌发展发展的相关性。本课题同时开展SNPR1细胞株的研究,数据正在整理收集中。
本课题检测了荷瘤鼠肿瘤组织的大小以及A549细胞的形态、增殖、迁移证实hMSC-EXO对NSCLC的作用机制。所取得结果显示外泌体组间的没有明显的差异,可能与外泌体的剂量大小的分组有关,需在后续的实验中进一步求证。为了更好的证实hMSC-EXO对NSCLC的作用,本课题设计机使用制外泌体抑制剂gw4869,再次求证抑制作用是否消失。hMSC-EXO对NSCLC的作用机制需要从转录水平进行深入的研究,本课题所获取的结果仅仅为后续研究奠定基础。hUCMSC-EXO对于A549细胞作用的具体机制需要从基因水平进一步探究。hUCMSC-EXO可能成为NSCLC临床诊治过程的新的治疗药物:它们已经吸引了研究人员的注意力,作为基于细胞的无细胞疗法影响NSCLC临床诊治的新策略。
基金项目
临沂市妇幼保健院院级科研项目(人脐带间充质干细胞的外泌体对肺癌细胞生物学活性的影响及其机制,编号:Y202212)。
NOTES
*通讯作者E-mail: yuzhuang2002@163.com