摘要: 目的:应用三维斑点追踪成像(3D-STI)评价心房颤动(房颤,AF)患者经导管射频消融术(RFCA)前后左心室收缩功能的变化。方法:选取进行RFCA治疗成功的31例阵发性AF患者(PAF组)及32例持续性AF患者(CAF组),另选取30例健康志愿者(对照组),三组均于术前及术后3个月完成超声心电图检查,并对采集图像进行三维应变分析,得到左心室心肌整体纵向、径向、圆周应变(GLS, GRS, GCS)。比较三组间各参数差异及PAF组和CAF组术前、术后差异。结果:与对照组比较,术前PAF组e'、E/e'增加,GLS减低,CAF组E、E/e'增加,LVEF、GLS、GCS减低,差异有统计学意义(P < 0.05)。与术前相比,术后PAF组e'、GLS增加(P < 0.05),CAF组E/e'减低,e'、LVEF、GLS、GCS增加(P < 0.05)。结论:较健康志愿者,AF患者的左心室收缩功能已受损;RFCA能有效逆转PAF和CAF患者的左心室重构,改善患者左心室收缩功能;3D-STI能早期有效评价左心室功能的微小变化。
Abstract:
Objective: To evaluate the changes in left ventricular systolic function before and after transcathe-ter radiofrequency ablation (RFCA) in patients with atrial fibrillation (AF) by applying three- di-mensional speckle tracking imaging (3D-STI). Methods: Thirty-one patients with paroxysmal AF (PAF group) and 32 patients with persistent AF (CAF group) who underwent RFCA successfully, and 30 healthy volunteers (control group) were selected. All three groups completed echocardiography before and 3 months after the procedure, and 3D strain analysis was performed on the acquired images to obtain the overall longitudinal, radial, and circumferential strains of the left ventricular myocardium (GLS, GRS, and GCS). The differences in the parameters between the three groups and the preoperative and postoperative differences between the PAF and CAF groups were compared. Results: Compared with the control group, e' and E/e' increased and GLS decreased in the PAF group before surgery, while E and E/e' increased and LVEF, GLS and GCS decreased in the CAF group, with statistically significant differences (P < 0.05). Compared to the preoperative period, e', GLS in-creased in the PAF group (P < 0.05) and E/e' decreased and e', LVEF, GLS, GCS increased in the CAF group (P < 0.05). Conclusion: In healthy volunteers, LV systolic function was already impaired in AF patients; RFCA was effective in reversing LV remodeling and improving LV systolic function in PAF and CAF patients; 3D-STI was effective in early evaluation of small changes in LV function.
1. 引言
心房颤动(atrial fibrillation, AF)是成人中最常见的房性心律失常,可引起卒中、心衰等严重并发症。AF治疗的主要目的是心室率控制 [1] ,抗心律失常药物被广泛应用,但药物的不良反应及有限的治疗效果促使了新的治疗方法的产生。射频消融术自20世纪80年代被应用于室上性心律失常的姑息治疗后,经过几十年的发展,如今已经成熟的应用于临床,它的安全性和作用得到了肯定 [2] 。AF可导致心脏结构和功能的变化,既往的研究多局限于左房,左室的研究较少,特别是经导管射频消融(radiofrequency catheter ablation, RFCA)前后左室结构和功能的变化,而左室功能的评价对临床尤为重要。三维斑点追踪成像(three-dimensional speckle tracking imaging, 3D-STI)是在二维斑点追踪成像的基础上,结合了三维超声心动图发展起来的新技术,通过追踪各个心肌斑点的运动轨迹从而得出心肌整体的三维应变 [3] [4] ,克服了二维斑点追踪成像仅能局限于平面内追踪心肌运动的缺点 [5] ,能更准确地评价左室功能。本研究旨在应用3D-STI评价AF对左心室功能的影响及RFCA前后AF患者的左心室功能的变化。
2. 资料与方法
2.1. 研究对象
选取2021年12月~2022年6月于青岛大学附属医院心内科进行RFCA治疗成功的AF患者63例,其中持续性AF (continuous AF, CAF) 32例(CAF组)男性16例,年龄39~76岁,平均年龄(58.9 ± 8.3)岁;阵发性AF(paroxysmal AF, PAF) 31例(PAF组),男性16例,年龄40~67岁,平均年龄(56.5 ± 7.5)岁。纳入标准:1) 经标准的12导联心电图记录或单导联心电图描记 > 30 s显示心律,无明显的重复P波和不规则的RR间期 [6] 。2) 符合《2020年欧洲心脏病学会和欧洲心脏外科协会合作制定的心AF动诊断和治疗指南》关于PAF和CAF的诊断标准 [6] 。PAF:在发病后7天内自行终止或干预终止。CAF:持续时间超过7天,包括在>7天后由复律(药物或电复律)终止。排除标准:1) 合并冠心病、心脏瓣膜病、心肌病、先天性心脏病、非首次行射频消融治疗的患者;2) 合并肾功能不全、甲亢、经食道超声检查有血栓者;3) 多方因素致图像质量不佳,无法达到三维斑点追踪成像技术要求的患者。另外选取30例健康体检者作为对照组,男性13例,年龄32~78岁,平均年龄(54.7 ± 10.9)岁,经临床病史、体格检查、心电图和经胸超声心动图筛查未发现异常。受检者术前2天内行二维及三维超声心动图检查,术后三月行二维及三维超声心动图复查。该研究经医院道德伦理委员会批准,所有受检者均对本研究知情同意。
2.2. 仪器与方法
使用PHILIPS EPIQ 7C彩色多普勒超声诊断仪,配备S5-1二维探头(探头频率1~5 MHz)及X5-1容积探头(探头频率1~5 MHz)。连接心电图,嘱患者平静呼吸,取左侧卧位,用S5-1常规扫查,调节合适的深度,于胸骨旁左心室长轴切面测量,舒张末期左心室内径(left ventricular end-diastolic diameter, LVDd),收缩末期左心室内径(left ventricular end-systolic diameter, LVDs),于心尖四腔心切面测量,频谱多普勒测量二尖瓣口舒张早期血流峰值流速(early diastolic transmitral velocity, E)、舒张晚期血流峰值流速(late diastolic transmitral velocity, A),计算E/A,测量二尖瓣口舒张期E波减速时间(deceleration time of E, EDT),组织多普勒测量二尖瓣环舒张早期心肌峰值运动速度(early diastolic tissue velocity, e'),分别测量二尖瓣环室间隔、侧壁、下壁、前壁4个位点的e',求平均值,计算E/e'。探头切换到X5-1,调节合适的深度,于心尖四腔心切面显示清晰的左室心内膜,启动实时三维超声,Full Volume全容积图像模式,调整为四个心动周期,探头位置固定,嘱患者屏住呼吸,采集图像,以DICOM格式存储,以便图像脱机分析。将图像导入Tomtec工作站,选取清晰的三维图像,启动4D LV-Analysis 3进行分析,软件自动描绘左心室内膜,必要时可手动修正,依据左心室容积变化曲线获得左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV),左心室舒张末期容积指数(LVEDVI)及左心室射血分数(LVEF),同时获得左心室整体纵向、径向、圆周应变(global longitudinal strain, GLS; global radial strain, GRS; global circumferential strain, GCS) (见图1)。
2.3. 统计学方法
采用SPSS 26.0软件对数据进行分析,计数资料以百分比(%)表示,比较采用χ2检验;计量资料采用均数 ± 标准差(
)表示,行正态性检验,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P < 0.05表示差异有统计学意义,绘制GLS的ROC曲线,随机选取30例研究对象应用Bland-Altman进行一致性检验。

Figure 1. GLS curve of left ventricle (a) GLS in control group was normal, (b) GLS in PAF group was decreased, (c) GLS in CAF group was significantly decreased
图1. 左心室GLS曲线(a)对照组GLS正常,(b) PAF组GLS减低,(c) CAF组GLS显著减低
3. 结果
3.1. 一般资料参数比较
与PAF组比较,CAF组心率加快有统计学差异(P < 0.05),对照组、PAF组和CAF组三组患者,性别、年龄、体表面积、体质指数、高血压、糖尿病无明显统计学差异(P > 0.05) (见表1)。

Table 1. Comparison of general data parameters
表1. 一般资料参数比较
注:与PAF组比较,#P < 0.05。
3.2. 常规超声心动图及三维斑点追踪指标比较
手术前:与对照组比较,PAF组e'、E/e'增加,CAF组E/e'增加,与对照组和PAF组比较,CAF组E增加,差异有统计学意义(P < 0.05)。手术后:PAF组e'增加,CAF组e'增加,E/e'减低,差异有统计学意义(P < 0.05) (见表2)。
手术前:与对照组比较,PAF组GLS减低,与对照组和PAF组比较,CAF组GLS、GCS、LVEF减低,差异有统计学意义(P < 0.05)。手术后:PAF组术后与术前比较,GLS增加,CAF组术后与术前比较,GLS、GCS、LVEF增加,差异有统计学意义(P < 0.05) (见表3)。

Table 2. Comparison of conventional echocardiographic parameters
表2. 常规超声心动图参数比较
注:与对照组比较,*P < 0.05;CAF组与PAF组比较,#P < 0.05,PAF组术后与术前比较,aP < 0.05,CAF组术后与术前比较,bP < 0.05。

Table 3. Comparison of 3D-STI parameters
表3. 3D-STI参数比较
注:与对照组比较,*P < 0.05;与PAF组比较,#P < 0.05,PAF组术后与术前比较,aP < 0.05,CAF组术后与术前比较,bP < 0.05。
3.3. 绘制房颤患者的GLS值ROC曲线
房颤患者GLS值最佳截断值为−17.85,其特异性为0.80,敏感度为0.76,约登指数为0.56,曲线下面积为0.86 (见图2)。
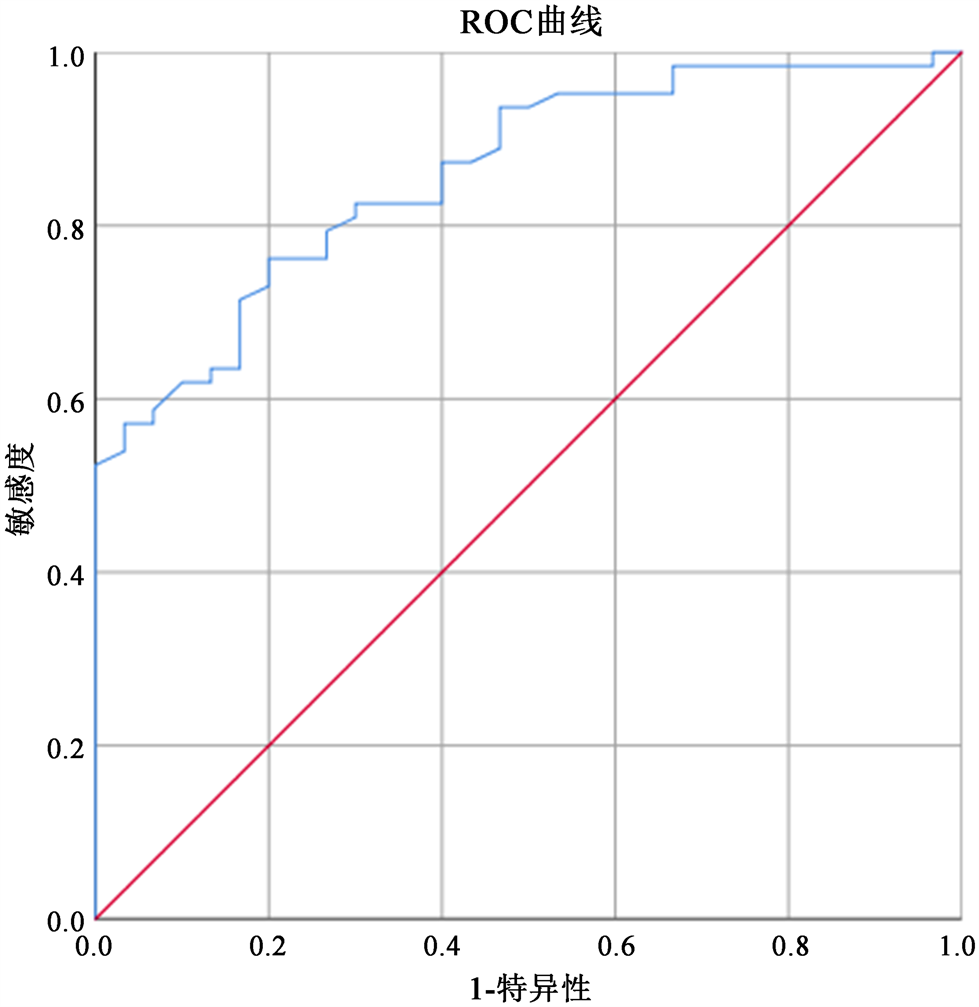
Figure 2. ROC curve of GLS value in patients with atrial fibrillation
图2. 房颤患者GLS值ROC曲线
3.4. 重复性检验
Bland-Altman图显示:GLS在不同观察间和观察者内间均具有良好的一致性(见图3)。
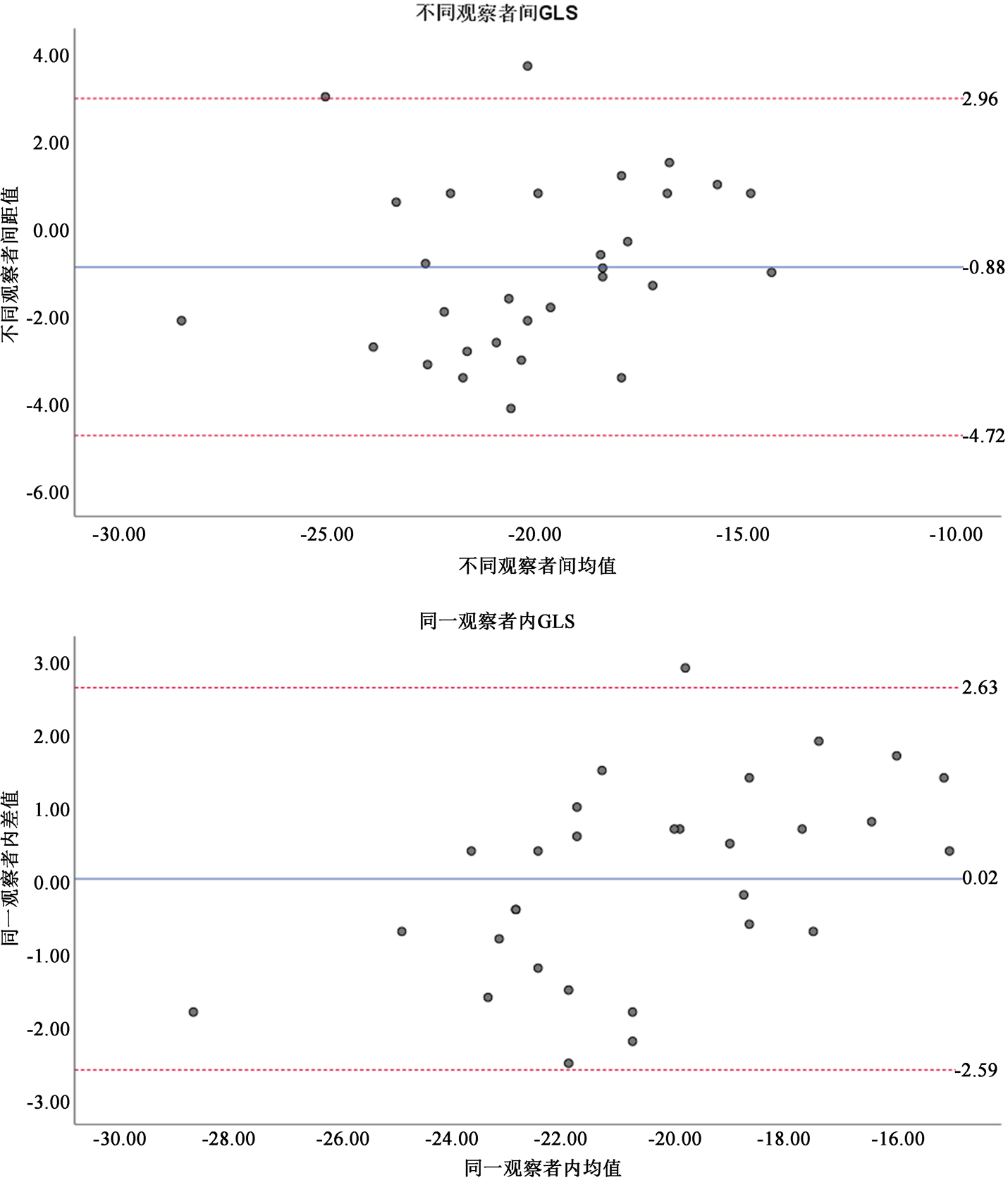
Figure 3. Bland-Altman analysis results of GLS in different observation rooms and observers
图3. 不同观察间和观察者内GLS的Bland-Altman分析结果
4. 讨论
据2010年统计,全球AF患者估测约3350万例 [1] 。年龄是AF的危险因素之一,每增加10岁,AF发病率就会增加一倍 [7] 。随着人口老龄化的持续加剧,AF的发生率逐步增加。亚洲AF流行病学研究结果显示,预计到2050年,亚洲AF患病人数将达到7200万人 [8] 。AF增加了卒中、心衰、心肌梗死、痴呆和肾功能不全等疾病的风险,这将导致现代医疗保健系统的压力不断增加,造成巨大的经济负担。
左心室心内膜和心外膜心肌纤维的方向存在差异,它的心肌结构是由两种螺旋纤维几何形状构成的跨壁连续体,心内膜区域的右旋螺逐渐转变为心外膜区域的左旋螺 [9] 。心肌纤维这种复杂的排列方式使得左心室心肌分为深层纵向和环形运动的心肌以及浅层的径向运动的心肌,三个方向的空间运动形式,分别产生了纵向、圆周及径向应变,这可以用来评估左心室功能变化 [10] 。本研究采用3D-STI对PAF和CAF患者RFCA前后的左心室功能变化进行评价。发现与对照组相比,PAF术前,虽然左心室收缩功能保留,但GLS明显降低,说明PAF患者早期心功能已经受损,3D-STI所得出的应变参数较LVEF更能反映心功能的微小变化。本研究中,各种应变之间存在差异,以GLS变化显著,这种差异可以用以下事实来解释,即位于心内膜下的纵向纤维可能更容易受到病理变化的影响。Reant [11] 等人注意到,在心肌缺血的动物模型中,纵向应变和周向应变对冠状动脉血流减少最为敏感。此外,Fang [12] 等人证明了,与对照组相比,53名糖尿病患者纵向应变显著受损,这些结果都与本研究的结果一致。
AF患者的心律不齐是诱发心肌病的常见原因,其病理生理过程与心室纤维化密切相关,心室的纤维化引起其结构、功能的重塑 [2] 。左心室功能不全的程度和左心室心肌的变化与心律不齐的持续时间和频率有关 [13] 。本研究中,相比对照组术前CAF较PAF的GLS减低更显著,同时CAF的GCS也出现了较大改变。说明CAF患者心肌受损较PAF患者更严重,而GCS的减低则表明心肌损害已经达到了影响较外层心肌的程度。与PAF患者相比,CAF患者通常承受更重的AF负担,例如频率更高、持续时间更长、症状更严重,这进一步加速了心肌纤维化的进程,从而加重左室系统功能障碍,因此,CAF患者通常具有更低的GLS、GCS。
在没有结构性心脏病病史的情况下,AF的心肌功能障碍是可逆的 [14] [15] 。AF患者,左房的收缩功能受损、房室的同步性丧失和心室节律不规则均会降低左心室功能。研究发现PAF和CAF患者与术前相比,术后GLS较术前增加。说明RFCA术后,心脏节律得到调节、左房收缩功能改善和房室收缩同步化,可增加AF患者的心肌变形能力,证明左心室功能发生逆转。术后GLS改善较大,证明GLS更早、更能敏感的反映心肌的变形能力。GRS在本研究中存在改变,但改变无统计学意义,笔者分析可能原因,左心室功能虽然改变,但心外膜受影响较小且变化较缓慢,心肌的损害还没有达到影响最外层心肌的程度,所以本研究中未表现出较明显的改变。
本研究样本量较小,在以后的研究中可以扩大样本量、多中心合作、长时间随访,以获得更准确的数据。3D-STI其时间及空间分辨率仍较低,对二维图像的清晰度要求较高,尽管本研究中CAF患者尽量选取心率较齐且取五个心动周期取平均值,仍可能存在一定的误差。
综上所述,RFCA能有效逆转PAF和CAF患者的左心室重构,改善患者左心室收缩功能。3D-STI的GLS、GCS能有效评价心功能,并在LVEF变化不明显时可早期发现心功能的微小变化,为临床早期干预提供有效的理论支撑。
NOTES
*通讯作者Email: fuxiuxiu999@163.com