摘要: 肝癌起病隐匿,80%左右的患者确诊时已失去手术机会。而TACE、RFA和MWA等治疗方式因微创和临床疗效确切等优势,已经成为肝癌治疗的重要选择。然而由于热沉效应及高温对消融范围内组织的破坏无选择性,限制了热消融在临近大血管、胆管和重要器官等高危部位的肝癌治疗中的应用。本例患者经纳米刀联合DEB-TACE治疗后,短期内肿瘤控制效果良好,临近血管保存完好,提示针对高危部位肝癌,纳米刀联合DEB-TACE的综合治疗模式可能是有效和安全的新治疗方案,为高危部位肝癌治疗提供新的方向。
Abstract:
The onset of liver cancer is hidden, and about 80% of patients have lost the opportunity for surgery when diagnosed. TACE, RFA, and MWA have become important choices for the treatment of liver cancer due to their precise clinical efficacy and minimally invasive advantages. However, due to the heat sink effect and the non selective destruction of the tissue within the ablation range by high temperature, the application of thermal ablation in the treatment of liver cancer near high-risk ar-eas such as Great vessels, bile ducts and important organs is limited. After the combination of nanoknife and DEB-TACE treatment, the tumor control effect of this patient was good in the short term, and the adjacent blood vessels are well preserved, indicating that the comprehensive treat-ment of nanoknife and DEB-TACE may be an effective new treatment plan for high-risk liver cancer, providing new ideas for the treatment of high-risk liver cancer.
1. 引言
肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌最常见的病理类型(约占91.5%),近年来发病率逐步上升 [1] 。因肝癌起病隐匿,80%左右的患者已失去手术机会 [2] 。而经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)、射频消融(radiofrequency ablation, RFA)和微波消融(microwave ablation, MWA)等方式因临床疗效确切及微创等优势,已成为肝癌治疗的重要选择 [3] [4] 。然而由于热沉效应及高温对消融范围内组织的破坏无选择性,限制了热消融在临近大血管、胆管和重要器官等高危部位的肝癌治疗中的应用 [5] 。Lee等 [6] 分析猪肝脏IRE消融后的范围、细胞死亡及安全性,发现所有消融灶的平均最大直径为(3.61 ± 0.41) cm,消融14 d后靶区与正常肝组织之间存在明显的分界,消融灶内肝细胞发生凋亡而血管、胆管以及邻近的正常肝实质保持完整的结构,且未见并发症。国内学者应用纳米刀前瞻性治疗35个位于主要胆管及门静脉旁5 mm内的肝癌病灶,术后平均随访22个月,消融区邻近的血管、胆管未见狭窄或栓塞,也未见任何胆囊或胃肠道并发症,消融成功率达91.4%,局部复发率仅为6.2% [7] 。而不可逆电穿孔(irreversible electroporation, IRE)消融俗称纳米刀,因不依赖高热消除了热沉效应的影响,特别适合消融临近大血管、胆管和重要器官等高危部位的肝癌 [8] [9] 。根据《中国肝癌多学科综合治疗专家共识》,TACE已经成为中晚期原发性肝癌治疗的首选方案 [10] ,近年来可载药微球(Drug-Eluting Beads, DEB)的出现,进一步提高了肝癌TACE的治疗效果 [11] ,所以本病例采用纳米刀联合DEB-TACE的综合治疗方案。
患者女,51岁。因“查体发现肝占位2月余,为求进一步治疗”入院。乙肝病史25年余,规律服用恩替卡韦抗病毒治疗。无既往手术史。患者2019年5月于青岛市胶南人民医院健康查体,B超提示:肝占位。2019年7月5日为进一步诊治转青岛大学附属医院门诊就诊,上腹部CT动态增强扫描示:① 肝右后叶上段异常强化灶,建议MR增强扫描进一步检查。② 肝硬化、脾大。③ 肝左外叶小囊肿。2019年7月26日进一步检查肝脏特异性对比剂MR增强扫描示:① 肝右后叶上段异常强化影(长径约25 mm),考虑恶性肿瘤(肝细胞癌)可能性大,请结合临床。② 肝硬化、脾大。③ 肝左外叶小囊肿可能性大,请结合临床。
2019年7月29日于青岛大学附属医院介入医学中心入院后完善相关检查,肿瘤标志物筛查示:AFP 48.72 ng/mL,CEA 0.88 ng/mL,CA19-9 5.60 U/mL,CA125 8.36 U/mL。肝脏肿瘤穿刺活检,病理提示:穿刺少许肝组织,部分肝细胞异形增生,可见核分裂像,考虑肝细胞肝癌,待免疫组化协助诊断。免组化示肿瘤细胞:Hepatocyte (+),GPC3 (+),Arginase-1 (+),HSP70 (+),GS (+),CD34示肿瘤组织内肝窦毛细血管化,CD10结合HE形态及免疫组化结果,符合肝细胞肝癌(II级)。余检查未见明显正常。
会诊后,考虑患者肿瘤已侵犯肝静脉,无手术切除指征,因热沉效应等限制了RFA和MWA等热消融方式在此病例中的应用,所以本病例采用纳米刀联合DEB-TACE的综合治疗方案。
简要治疗过程为:① TACE:常规准备后,患者仰卧于DSA手术床。常规双侧股动脉区域消毒,铺巾。2%利多卡因局麻后,采用改良版的Seldinger技术穿刺患者右股动脉,并置入5F鞘。送5F·肝导管至腹腔干、肝动脉造影,见肝右叶肝顶部可见片状肿瘤染色,肝右动脉参与供血,门静脉间接造影主干显影可。透视下将微导管超选择至肿瘤供血动脉内应用雷替曲塞2 mg + 奥沙利铂100 mg行动脉灌注化疗,应用1/2支载有伊立替康120 mg的聚乙烯醇栓塞微球[蓝色型(1 mL栓塞微球:7 mL生理氯化钠溶液)/70~150μm + 碘化油3 mL混合液行动脉化疗栓塞,后造影显示栓塞适量,退出导管、动脉鞘,局部压迫10 min,加压包扎。患者术中未诉不适,术后平车安返病房。在TACE治疗的1~2周内联合对病灶行IRE消融治疗。② 纳米刀消融:患者取仰卧位,全身麻醉后,右上腹壁皮肤区域放置体外定位器,根据TACE后增强CT (图1(a))及增强MR (图1(b))行CT扫描确定皮肤穿刺点及进针路径。穿刺点区域皮肤碘伏消毒,铺孔巾,2%利多卡因局部浸润麻醉,手术尖刀片在穿刺点位置作一2 mm小切口。调整消融针暴露深度2.0 cm,在CT导向下经穿刺点将2根消融针分别经皮肤穿刺平行进入肝内肿瘤组织边缘,两针间距2.0 cm,复查CT,确认进针位置良好(图1(c))。连接不可逆电穿孔消融仪,行消融治疗,消融电压为3000 V,共行20组消融。术毕拔针,即刻增强CT复扫示消融区呈低密度改变,范围可,肺内无渗出、肝包膜下无出血,胸腔无气胸及出血(图2(a))。之后给予穿刺点消毒、加压、包扎。患者术中、术后未诉明显不适,术后平车安返麻醉复苏室,给予抗感染、护胃、保肝、营养补液等对症支持治疗。
术后1个月复查上腹部MR动态增强(图2(b))提示:肝脏,左侧腹膜肿瘤可见大片状低密度坏死区,但肝脏肿瘤外周仍有少许强化灶。复查血结果提示:AFP 17.52 ng/mL,CEA 0.78 ng/mL,CA19-9 5.42 U/mL,CA125 7.25 U/mL。
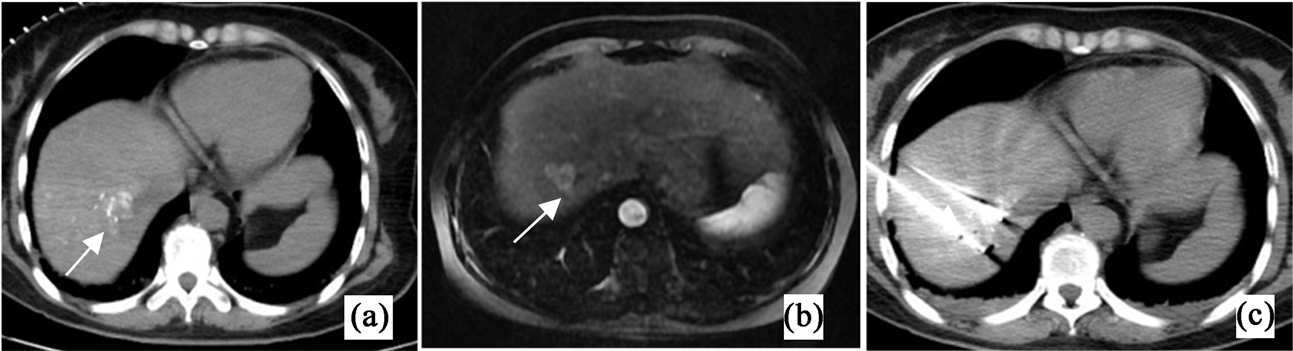
Figure 1. (a) shows post TACE and pre IRE enhanced CT (arrow); (b) represents enhanced MR after TACE and before IRE (arrow); (c) represents the intraoperative image of IRE guided by CT (arrow)
图1. (a)为TACE术后、IRE术前增强CT(箭头);(b)为TACE术后、IRE术前增强MR(箭头);(c)为CT引导下IRE术中图像(箭头)
术后每3个月复查上腹部MR动态增强,24个月后图像(图2(c))提示:肝右后叶上段见片状稍短T1信号影,边界欠清,长径约26 mm,增强扫描未见明显强化,较前相比无明显变化。复查血结果示:AFP 4.63 ng/mL,CEA 0.64 ng每/mL,CA19-9 4.32 U/mL,CA125 6.53 U/mL,肿瘤标志物均已降至正常范围。
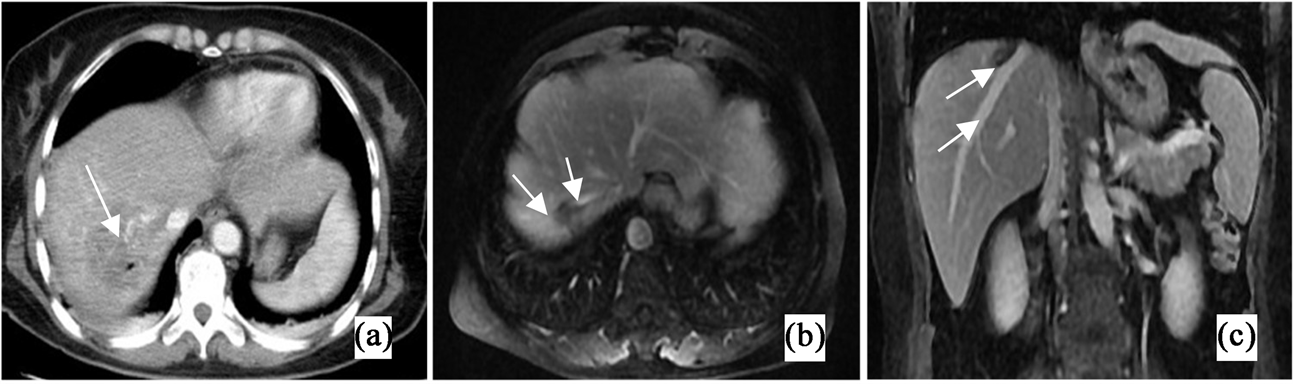
Figure 2. (a) is immediately enhanced CT after IRE surgery; (b) represents one month post surgery enhancement of MR images showing no enhancement of the tumor and good display of hepatic veins (arrow); (c) shows no enhancement of the tumor and good display of hepatic veins on contrast-enhanced MR imaging at 24 months after surgery (arrow)
图2. (a)为IRE术后即刻强化CT;(b)为术后1个月增强MR图像显示肿瘤无强化、肝静脉显示良好(箭头);(c)为术后24个月增强MR显示肿瘤无强化、肝静脉显示良好(箭头)
2. 讨论
纳米刀是一种最新的局部非热性消融技术,其原理为肿瘤细胞在高频脉冲电场作用下,细胞膜会出现纳米级别的孔隙,这些孔隙在电场去除后并不会自动闭合,进而引起细胞内环境的紊乱,引起细胞凋亡并最终导致细胞死亡,而血管、胆管及神经等主要结构成分为纤维组织,缺乏磷脂双分子层,理论上纳米刀不会对此类脉管支架组织及细胞外基质产生严重破坏 [7] 。纳米刀最早于2015年被应用治疗前列腺癌 [12] ,后来被广泛应用于肝癌、肺癌、胰腺癌及肾癌的治疗上 [13] ,且被证明安全有效、不良反应可控、无热沉反应影响,对病灶附近血管有很好的保护作用。来自德国的一项前瞻性临床试验的研究结果表明:所有病灶均位于门静脉或肝静脉旁,术后平均随访24个月,技术成功率为93%,局部复发率为5%,除5例患者发生轻微胆汁淤积外,未见严重并发症 [9] 。即使是对于肝功能较差的患者,纳米刀治疗成功率仍可达100%,随访至180 d,局部复发率仅为3%,且纳米刀消融后并发症发生率及住院时间远低于MWA治疗组,显示出微创、耐受性好的优点 [14] 。这些临床数据初步表明了纳米刀消融治疗位于高危部位的肝内肿瘤病灶是安全有效的。本例患者肝脏肿瘤侵犯肝静脉,无手术切除指征,且因热沉效应限制了热消融在此病例中的应用,而应用纳米刀消融安全性高,术中、术后并发症安全可控,治疗效果显著。
可载药微球一方面可以栓塞肿瘤血管,另一方面可以使放化疗药物长时间作用于肿瘤内部。目前主要搭载药物为阿霉素等化疗药物,未来可与各类靶向药物或其他放射性药物等结合进行治疗 [15] 。DEB-TACE (Drug-eluting Beads TACE或D-TACE)中,加载了化疗药物的微球被超选择性送入肿瘤供血血管(肿瘤滋养血管)内,缓慢并可控性释放在肿瘤病灶组织内,起到双重治疗作用。D-TACE是肿瘤供血动脉栓塞与局部持续化疗的结合,改善了cTACE治疗肝癌的不足 [16] 。DEB-TACE治疗肝癌的作用特点:1) 从微球中持续释放化疗药物,可达更远端的栓塞,使肿瘤内细胞毒性药物的局部浓度更高,并减低全身浓度,疗效和耐受性改善;2) 产生标准化的栓塞效应;3) 对cTACE抵抗患者产生临床应答。
近期研究显示TACE后再行IRE治疗可提高疗效,其原理可能是IRE过程中所包含的可逆电穿孔(reversible electroporation, RE),从而造成肿瘤内化疗药物浓度升高,进而达到最佳的组织内的细胞毒性,提高治疗有效率 [17] 。具体分子机制如下,20世纪50年代,有学者发现电场刺激可以诱发细胞膜的渗透性改变甚至裂解,被描述为“电穿孔”。研究认为电穿孔效应的原因是电场改变了细胞膜上的电化学势,从而诱导了细胞膜脂质双层膜极化的不稳定性。根据电脉冲刺激的强度,其导致细胞膜的穿孔分为可逆及不可逆两种状态。前者常被应用于辅助化疗药物进入肿瘤细胞,是电化学治疗的基本原理,也是本治疗方案的理论依据 [18] 。
Bhutiani等 [19] 对原位胰腺癌小鼠先给予吉西他滨化疗再行IRE消融,对照组单纯吉西他滨化疗,结果发现化疗——IRE序贯治疗组胰腺组织中吉西他滨的浓度较单纯化疗组显著升高,达到了肝组织与血清的5.52和5.96倍。
Peter Isfort等 [20] 对DEB-TACE是否增强IRE的局部效应——猪模型的影像学和组织病理学评估中发现:与单独使用IRE相比,IRE联合DEB-TACE导致消融体积更大,可以增强IRE的局部疗效。本例患者中采用纳米刀消融前给予DEB-TACE治疗,在消融过程中可能提高了肿瘤内的化疗药物浓度,取得了理想的局部杀伤肿瘤效果,而且无明显肝肾和血液系统不良作用。后来复查上腹部MR动态增强显示肿瘤完全缓解,AFP等肿瘤标志物明显下降,后继续复查标志物已降至正常范围。
本例患者经纳米刀联合DEB-TACE治疗后,中短期内肿瘤控制效果良好,临近血管保存完好,提示针对高危部位肝癌,纳米刀联合DEB-TACE的综合治疗模式可能是有效和安全的新治疗方案,为高危部位肝癌治疗提供新的方向。
NOTES
*通讯作者Email: wangzhenguang@aliyun.com