1. 引言
随着分子技术的发展与更新,很多抗寒基因被甄别并表达。通过导入其中的全部或者部分抗寒基因(比如CBF基因 [1] ,COR诱导基因 [2] 、抗冻蛋白基因 [3] 、HSP热休克基因 [4] 、WRKY转录因子 [5] 、AP2/EREBP转录因子 [6] 等),提升园艺及园林植物体本身的能量及代谢系统的平衡性,增强细胞呼吸水平以及渗透调节能力,使植物在适度的低温环境下保持正常的生活能力,经济产量和品质不受到影响。目前研究最多的是CBF转录因子,其信号转导在基因的表达中时刻处于活性,当植物遭受来自外界的寒冷应急,CBF基因被诱导激活,体内的激素、能量、免疫及膜系统被激活共同对寒冷程度做出判断 [7] 。随着更多相关基因的发现及先进手段的使用,植物在寒冷环境中耐受的下限温度会更低,抵御寒冷逆境胁迫的能力会提高,进而寒冷伤害造成的损失也会相应地降低。
简单重复序列(Simple Sequence Repeat,简称SSR)是指重复单位长度和碱基组成基本一致,只有少数基因出现微小的差异的一类短串联重复序列。SSR是以PCR技术为核心的DNA分子标记技术,或称微卫星序列标记(Microsatellite sequence, MS),或短串联重复标记(Short Tandem Repeat, STR)。SSR广泛用于种子纯度鉴定 [8] 、真实性检测 [9] 、新品种或种质资源之间的亲缘关系分析 [10] 。
紫穗槐(Amorpha fruticosa L.)属于蝶形花科(Papilionaceae)紫穗槐属(Amorpha L.)多年生落叶丛生灌木,适应性强,是是城乡绿化、水土保持的特色树种。“金野”紫穗槐(Amorpha fruticosa “Jinye”)是紫穗槐实生苗的栽培变种,其新梢金黄色,基部黄绿色;新叶金黄色,老叶绿色,具有良好的观赏价值 [11] 。关于“金野”紫穗槐的研究多见于栽培、抗旱生理、抗寒生理等方面。目前尚未有报道关于利用CBF基因甄别紫穗槐与“金野”紫穗槐之间的抗寒能力,也少有利用SSR标记来鉴别两者之间的遗传差异性。本研究比较“金野”紫穗槐和紫穗槐之间的遗传差异并利用SSR分子标记技术进行紫穗槐等两个品种抗寒性的鉴定,以期为学院新品种的选育建立快速的室内检测方法,为新、老品种之间的鉴别在分子水平上提供一定的参考。
2. 材料与方法
2.1. 试验材料
紫穗槐及“金野”紫穗槐品种均选自北京农业职业学院彩色苗木繁育中心,“金野”紫穗槐已于2021年申请新品种权。试验所用材料取自两类品种2022年新萌生枝条的新鲜幼嫩叶片。
2.2. 试验仪器与试剂
移液器、恒温水浴锅、离心机(赛默飞世尔)、紫外分光光度计、凝胶成像仪、PCR仪、水平电泳仪。
试验所用试剂中限制性内切酶、DNAMarker和Taq酶均为青岛西弥斯检测技术服务有限公司产品,其余均为国产分析纯试剂。
2.3. 试验方法
2.3.1. DNA提取
参考CTAB法 [12] [13] 提取DNA,略加修改。用于PCR分析的DNA样品。将“金野”紫穗槐和“紫穗槐”分别设置3个重复,1~3样品对应前者,4~6样品对应后者。
(1) 称取250 mg叶片置于研钵中,加液氮研磨至粉状,转入至2 ml的灭菌离心管中。
(2) 加入65℃预热CTAB抽提缓冲液700 μL、70 μL无水乙醇充分振荡混匀,在65℃恒温水浴中保温1 h,每隔10 min颠倒摇荡数次。
(3) 1 h后取出离心管,冷却至室温,在4℃下离心10 min (12000 r/min)。
(4) 取上层清液转移至另一支2 ml无菌离心管,加入等体积的加入氯仿–异戊醇(24:1),颠倒混匀,在室温下离心10 min (12000 r/min)。
(5) 取上层清液至新的2 ml离心管中,加入2倍体积95%冰预冷的无水乙醇,轻轻混匀。在−20℃下放置30 min,出现絮状沉淀。
(6) 将上述絮状沉淀在4℃离心10 min (12000 r/min),去除上清液,即为DNA沉淀。
(7) 向DNA沉淀加70%乙醇并清洗2次,风干,加入100 μL PH8.0TE缓冲液充分溶解DNA沉淀。
(8) 用分光光度计检测DNA浓度及其与蛋白质比值。新提取的DNA用1倍的TE溶液溶解,贮存在−20℃或−70℃冰箱中备用。用前稀释到10~20 ng/ul的浓度,置4℃冰箱保存。
2.3.2. PCR扩增反应
目前抗寒基因CBF2存在很多已知序列,根据其中的序列特点设计1对引物 [14] [15] ,分为正、反向引物,其中正向引物为:5'-GCTCCGATTACGAGTCTCCGGTTTC-3';反向引物为5'-CAGGCGGTGATTACAGTCCGAAGCT-3' [16] 。PCR扩增反应程序采用25 µL的体系,其中包括:10 × TaqBuffer 2.5 µL,dNTPs (2.5 mmol/L) 2.0 µL,TaqDNA聚合酶0.2 µL,上、下游引物(10 µmol/L)各1.0 µL,DNA模板2.0 µL,双蒸水补足至25 µL。PCR反应扩增程序为:94℃预变性3 min;94℃变性30 S,57℃退火30 S,72℃延伸45 S,35个循环;最72℃延伸5 min,16℃保存。
2.3.3. PCR产物检测
采用琼脂糖凝胶电泳方法检测PCR产物。主要过程为1%琼脂糖凝胶制备、胶板制备、加样、漂洗、电泳等步骤 [17] ,最后在凝胶成像仪上观察、照相。其中要注意在吸取DNA样品时,用5 µL量与6*loadingbuffer混合均匀,通过1%琼脂糖凝胶点样后电泳,电泳槽电压控制在100~150 V,时间1小时,电泳完毕用1 × TAE溶液染色约20 min后清水漂洗10 min,在凝胶成像系统上观察、拍照。
3. 结果与分析
3.1. 抗寒基因扩增结果
由图1可以看出,对“金野”紫穗槐扩增出4、7、6条谱带(图中1、2、3);对紫穗槐扩增出6、5、4条谱带(图中4、5、6)。扩增的谱带分子量在400~500 bp之间,1对引物共计扩增出32条谱带,平均每个引物扩增16条谱带。“金野”紫穗槐共扩增出17条谱带,紫穗槐共扩增出15条谱带;2个品种扩增出相同谱带的样品数相同。从每条谱带的数量上看,图中2号样品谱带条数最多;其次是3号、4号样品和5号样品;谱带最少的是1号和6号样品。从谱带的亮度上看,2号样品亮度最优;其次是1号、6号和3号;最暗的是4号和5号。通过PCR产物的检测,紫穗槐两个品种都含有耐寒基因,从谱带的数量及表现来看,两个品种存在一定的差异,“金野”紫穗槐在同样低温环境下具有更强的耐寒潜在能力,相对于紫穗槐具有一定的优势。今后可通过抗寒锻炼来提高“金野”紫穗槐对寒冷的适应性,继续对品种的栽培适应性做深入研究。可继续利用PCR扩增技术来分析植物体内的抗寒基因的表达,亦可在寒冷条件下通过抗寒基因导入来检测相关生理指标的变化。
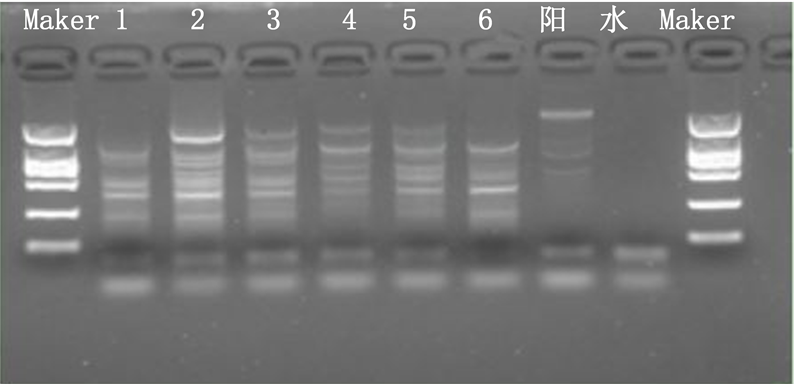
Figure 1. Results of cold resistance gene amplification in Amorpha fruticosa “Jinye” and Amorpha fruticosa L.
图1. 对“金野”紫穗槐和紫穗槐抗寒基因扩增结果
3.2. SSR标记差异性分析

Table 1. Information for SSR marking
表1. SSR标记信息

Table 2. Fingerprint information of primer labeled sample sites
表2. 引物标记样品位点的指纹信息
以对照样品为参照,观察各样品与对照样品之间的位点数差异。当样本间差异位点数 ≥ 2,判定为“不同”;当样本间差异位点数 = 1,判定为“近似”;当样本间差异位点数 = 0,判定为“极近似或相同”。样品1号与对照差异位点数为0;样品2号与对照差异位点数6;样品3号与对照差异位点数4;样品4号与对照差异位点数3;样品5号与对照差异位点数3;样品6号与对照差异位点数4 (表1,表2)。除1号样品与对照可判定“极近似或相同”,剩下的样品可判定为“不同”。综合指纹数据和位点信息来看,2号样品(“金野”紫穗槐的一次重复)和对照的差异位点数最多,与同品种或紫穗槐(4~6号)样品间的差异也存在;紫穗槐与对照间的点位全部存在差异,而“金野”紫穗槐的1个样品与对照的位点没有差异。从“金野”紫穗槐与紫穗槐的毛细管电泳对比图(图2)也能看出具有相同的遗传特点但也有一定的差异。峰图符合特异峰的特点 [18] ,主峰独立并且突出,周边有部分小峰,峰值清晰可见,高度在221~1396之间,区域分布范围在180~320之间,为精确分析数据,提高检测精度做出了保证。品种与对照之间SSR标记点位的指纹信息差别肉眼可见,同一品种以及不同品种之间既有一定的联系又存在点位差异,通过对9个点位的比较分析,可初步判定两品种“不同”,而两个紫穗槐品种的遗传背景是否相同,是否存在遗传差异性还有待进一步研究。今后可继续利用SSR标记多态性分析、PCR扩增等位基因,结合聚类分析计算遗传相似系数,通过统计软件并结合指纹数据库对比来判定品种间的遗传差异性。
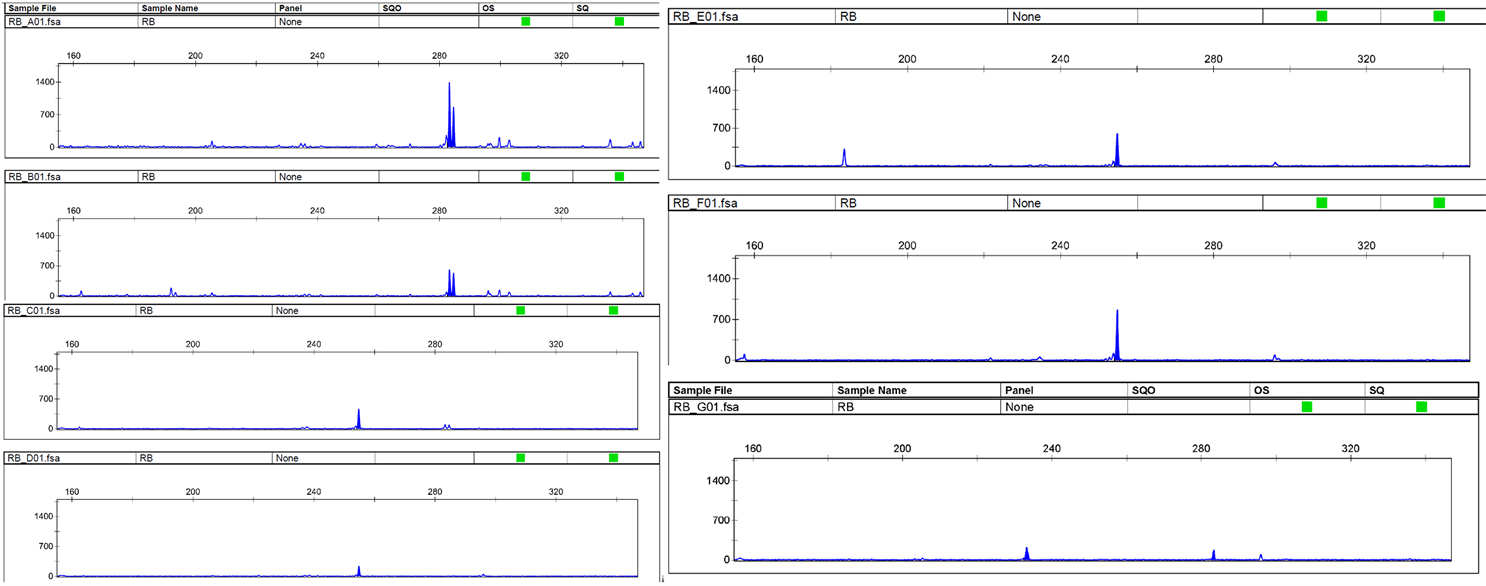
Figure 2. A16 peak plot of capillary electrophoresis
图2. A16的毛细管电泳峰图
4. 讨论
4.1. CBF在植物抗寒性方面发挥的作用
植物受低温影响,干物质合成量减少、籽粒干瘪、产量相应降低。为了抵御低温,植物自身会发生一些列变化,比如叶片厚度降低、根系体积增加、细胞结构发生改变等形态变化;同时细胞膜结构的稳定性被迫增强,细胞的组成和代谢调节受到干扰,细胞内部蛋白和磷酸等营养物质发生一系列变化,体内大量酶活性增加等 [19] 。而通过栽培技术及生长调节剂的运用、基因的转入与传导等手段使植物在适当低温的环境下生存能力提高,其目的是充分提高植物自身的抗寒能力。
CBF基因可调控下游大量抗寒基因的表达,包括一系列基因组成员,在调节植物抗寒性方面起到了非常重要的作用。植物在受到寒冷刺激后被激活的ICE蛋白可以诱导CBF基因的表达,脯氨酸、可溶性糖等与抗寒性物质的含量大量增加 [20] 。在低温逆境下,CBF基因可以增强了细胞膜的透性,维持了细胞膜的稳定型,提高了SOD、CAT、POD等抗氧化酶的活性,降低了MDA的含量,植物的抗寒性得到显著提高 [21] 。ABA与Ca2+具有冷信号传递功能,可以将信息传递转录因子,后者再进行给抗寒基因CBF的调控。而在抗寒锻炼下,抗冻蛋白可以通过增强渗透调节能力,提高酶的活性、清除氧自由基等方式来提高细胞的耐寒能力 [22] 。植物的抗寒性决定于外部环境和自身因素的两方面。通过抗寒性品种的筛选、施用与抗寒性有关的激素或者Ca2+、利用基因手段导入CBF调控基因或者LpAFP、CaAPX等功能性基因等方法来提高植物的抗寒水平 [23] 。
4.2. 遗传差异性分析
通过ISSR、SSR等分子水平上的遗传多样性的研究,不仅可以识别系谱之间的亲缘关系远近,又可以在同一品种间进行快速鉴定以识别性状的真伪。张曼等 [24] 对35份朝天椒进行了遗传差异性分析,通过SSR多态信息显示的有效等位基因数、观测杂合度、期望杂合度等变量的变化幅度,利用聚类分析观察遗传相似系数大小,来区分不同种质间的亲缘关系。刘旭颖等 [25] 通过ISSR标记技术对9中耐寒杜鹃花 的亲缘关系进行了研究分析,发现它们的遗传背景之间存在一定的差异性,不同类别的多态谱带表现不同。在育种材料选择、鉴别等方面也可以双管齐下,既观察并比较材料之间的基本生长性状(比如:叶片数、茎宽)、产量和品质(比如:淀粉、蛋白质、纤维素)等 [26] ,同时利用现代分子手段分析资源之间的遗传差异性,这样数据更加准确、结果更加可靠。
5. 结论
“金野”紫穗槐和紫穗槐两个品种都具有PCR产物的检测抗寒基因,但从普带上基因的表达量来看两个品种之间稍有不同,前者的抗寒水平更高,相对于后者具有更加耐寒的潜质。通过SSR标记并综合指纹数据和位点信息观察,“金野”紫穗槐和紫穗槐遗传背景相同,差异点位之间存在差异。“金野”紫穗槐在分子水平上的研究仍处于空白,希望通过本研究为“金野”紫穗槐及相关树种的品种选育及逆境生理提供一定的理论基础。
基金项目
北京市科技计划项目“‘金野’紫穗槐性状基因标记的研究”,基金编号:KM202012448003。
NOTES
*第一作者。