摘要: 目的:探讨艾司洛尔(Esmolol, ES)对脓毒症大鼠肺损伤的保护以及全身多个器官炎症的改善作用。方法:60只清洁级SD雄性大鼠随机分为假手术(Sham)组、脓毒症(CLP)组和艾司洛尔(ES)组,每组20只。CLP、ES组采用盲肠结扎穿孔法制备脓毒症模型,Sham组仅开腹暴露盲肠后还纳腹腔。盲肠结扎穿孔术后1 h始,ES组每隔12小时经腹腔注射ES (20 mg/kg),其余两组在相同时间点给予等质量生理盐水。观察各组大鼠行为学及生存情况,术后48 h,酶联免疫吸附法(ELISA)检测血清及肺组织匀浆中炎性细胞因子水平,测定肺组织湿/干重(W/D)比值,苏木精–伊红(HE)染色观察脓毒症大鼠肺、心、肠组织形态学变化,免疫组化(IHC)染色检测肺组织中闭合蛋白(Occludin)、闭锁小带蛋白-1 (ZO-1)的表达。结果:艾司洛尔能有效提高脓毒症大鼠生存率。术后48 h,CLP组血清和肺组织匀浆中肿瘤坏死因子-α (TNF-α)、白细胞介素-10 (IL-10)均升高(P < 0.05),且ES组各因子含量显著低于CLP组(P < 0.05),48 h时,CLP组大鼠肺水肿明显,与CLP组相比,艾司洛尔可降低脓毒症大鼠肺水肿程度(P < 0.05)。48 h时,与Sham组相比,CLP组脓毒症大鼠肺、心、肠组织炎症细胞较Sham组明显浸润,ES组炎症细胞减少,细胞坏死程度较CLP组改善。术后48 h,与Sham组相比,CLP组脓毒症大鼠肺组织中Ocloudin和ZO-1的表达水平显著下降(P < 0.05)。与CLP组相比,ES组脓毒症大鼠肺组织中Occludin和ZO-1的表达水平升高(P < 0.05)。结论:艾司洛尔可通过减少炎性细胞因子释放,抑制机体炎症反应,保护脓毒症大鼠肺损伤并改善全身多个器官的炎症状态。
Abstract:
Objective: To investigate the effects of early application of Esmolol on lung injury and improvement of systemic inflammation of multiple organs in sepsis rats. Methods: Sixty male Sprague Dawley rats with seven or eight weeks were randomly divided into sham operation (Sham) group, sepsis (CLP) group and Esmolol (ES) group, with twenty rats in each group. Sepsis models were prepared by ce-cum ligation and perforation in the CLP and ES groups, while rats in Sham group only underwent laparotomy to expose the cecal. Starting from 1 h after cecal ligation puncture, the ES group was in-jected intraperitoneally with 20 mg/kg Esmolol every 12 h and the remaining two groups were in-jected with equal quality normal saline at the same time. We observe the behavioral changes of rats and survival rate in each group. The remaining surviving rats were sacrificed after 48 h surgery, every rat’s tumor necrosis factor-α (TNF-α), interleukin-10 (IL-10) levels were detected in rat blood and Lung tissue by enzyme linked immunosorbent assay (ELISA). The wet/dry-to- weight ratio of lung tissue of rats in each group was determined. The morphological changes of lung, heart and in-testine tissues in rats with sepsis were observed by hematoxylin-eosin staining. Immunohisto-chemical staining detected the expression of Occludin and ZO-1 in lung tissue. Results: Esmolol is effective in improving survival rate in rats with sepsis. At 48 h, compared with the Sham group, TNF-α and IL-10 were significantly increased in the CLP and ES groups (P < 0.05) and the content of each factor in the ES group was significantly lower than in the CLP group (P < 0.05). At 48 h, pulmo-nary edema in rats in the CLP group was obvious, and compared with the CLP group, esmolol could reduce the degree of pulmonary edema in rats with sepsis (P < 0.05). At 48 h, compared with the Sham group, the inflammatory cells of lung, heart and intestinal tissues of rats with sepsis in the CLP group were infiltrated significantly compared with the Sham group, while the inflammatory cells in the ES group were reduced and the degree of cell necrosis improved compared with the CLP group. At 48 h after surgery, compared with the Sham group, the expression levels of Occludin and ZO-1 in the lung tissue of rats with sepsis in the CLP group decreased signi- ficantly (P < 0.05). Compared with the CLP group, the expression levels of Occludin and ZO-1 in the lung tissue of sepsis rats in the ES group increased (P < 0.05). Conclusion: Esmolol exerts a protec- tive effect against lung injury and the inflammatory state of multiple organs throughout the body in sepsis rats by inhibiting inflammatory cytokine release.
1. 引言
脓毒症是宿主对感染反应失调所导致的危及生命的器官功能障碍 [1] 。部分脓毒症患者早期开始即发生急性肺损伤或者急性呼吸窘迫综合征,故肺被认为是脓毒症最容易并且最早累及的器官 [2] ,与脓毒症早期发生炎症因子风暴,导致循环中炎症因子刺激肺血管内皮细胞,肺血管通透性增加,肺泡上皮细胞损伤,肺泡水肿,肺免疫炎性细胞活化和浸润等有关 [3] [4] 。关于脓毒症肺损伤没有特定的治疗方案,其机制也尚未得到充分研究,目前认为脓毒症肺损伤机制主要与炎症紊乱密切相关。
自主神经系统和宿主免疫系统在抵抗感染中起关键作用,但这种抵抗通常是过度和有害的 [5] 。交感神经的过度刺激和儿茶酚胺的过度激活,促进炎症因子释放,可进一步驱动多个器官功能障碍的正反馈循环。艾司洛尔作为选择性β1-受体阻滞剂,可以通过抑制交感神经的过度活化 [6] ,有效降低体内促炎因子释放,也可抑制脓毒症大鼠单个核细胞TLR4及其下游NF-κB表达 [7] 。既往研究证实,艾司洛尔在降低脓毒症患者28天死亡率、控制心率和提供心脏保护功能方面可能安全有效,其心脏功能的改善可能与血清炎症介质的变化有关 [8] [9] 。目前艾司洛尔对脓毒症的研究集中在其对心肌以及血流动力学方面的保护,鲜有研究探讨其针对脓毒症肺损伤及肠屏障损伤的保护作用,本实验观察脓毒症大鼠肺损伤及全身炎症程度,探讨艾司洛尔对脓毒症大鼠肺的保护作用及其全身多个器官炎症改善效果,有助于开发针对脓毒症肺损伤的有效治疗方法。
2. 材料与方法
2.1. 实验动物分组及处理
本实验中动物操作均参照《实验动物管理条例》进行,符合动物伦理学要求,由毓璜顶医院伦理委员会批准,实验动物均由济南朋悦实验动物有限公司购入。60只健康成年雄性SD大鼠,体重250~300 g。按照随机数字表法将大鼠分为三组:假手术组(Sham组)、脓毒症组(CLP组)、艾司洛尔组(ES组),每组20只。大鼠术前自由饮水,禁食12 h,采用盲肠结扎穿孔法(CLP)建立脓毒症大鼠模型 [10] :3%戊巴比妥钠(20 mg/kg)腹腔注射麻醉大鼠后取仰卧位固定,打开腹腔游离盲肠末端,于盲肠1/3处用3~0无菌丝线结扎,并用18 G无菌针头在结扎段盲肠中点贯穿2次,挤出少量肠腔内容物,保证穿刺点通畅后,将盲肠回纳腹腔并逐层缝合。Sham组开腹暴露盲肠后立即关腹。ES组分别于CLP术后1 h,12 h、24 h、36 h经腹腔注射艾司洛尔20 mg/kg,Sham组和CLP组分别于相同时间点经腹腔注射等体积生理盐水。观察大鼠行为学及生存率,术后48 h各组剩余存活大鼠均被处死,留取标本进行后续实验。
2.2. 标本采集
CLP术后48 h处死剩余存活大鼠,打开胸腔暴露心脏,左心室采血留取血液标本5 ml,室温静置后低温离心10 min (3500r/min)后留取上清。剪开右心耳处心肌,沿左心室向主动脉灌注0.9%生理盐水100 ml,留取肺、心、肠组织,部分置于4%多聚甲醛中固定用于病理学研究,剩余标本液氮暂存后保存在−80℃冰箱中待检。
2.3. ELISA检测血清及肺组织匀浆中TNF-α及IL-10表达
麻醉大鼠,经左心室取血5 mL,离心取上清液,肺组织研磨后取上清用ELISA试剂盒检测肿瘤坏死因子-α (TNF-α)、白细胞介素-10 (IL-10)水平,酶标分析仪检测560 nm波长处吸光度值,根据标准曲线计算各组大鼠血清中各因子水平。实验操作严格按照说明书步骤进行。
2.4. 肺组织湿/干重比值(W/D)测定
分离双肺周围结缔组织,0.9%生理盐水将大鼠新鲜的右肺组织冲洗后吸水纸吸干表面水分,立即称量湿重(W),随后右肺组织于恒温烤箱(75℃)中烘烤48 h,称取干重(D),计算W/D值并记录数据用于评估肺组织水肿程度。
2.5. 肺、心、肠组织病理学观察
将4%甲醛溶液固定的肺、心、肠组织经脱水、包埋、切片、染色、封片等处理后,于光镜下观察各组织病理学改变并拍照。
2.6. 免疫组织化学检测肺组织Occludin、ZO-1
取大鼠肺组织切片,体积分数3%过氧化氢溶液阻断,柠檬酸盐抗原修复液修复,山羊血清封闭;加入闭合蛋白(Occludin) (1 × 100)、闭锁小带蛋白-1 (ZO-1) (1 × 100)一抗,4℃孵育过夜;随后加入HRP标记的IgG二抗,DAB显色,苏木素复染,显微镜下观察细胞呈棕褐色为阳性表达。计算肺组织ZO-1、Occludin蛋白阳性表达率。
2.7. 统计学方法
GraphPad Prism 8.0软件绘图,SPSS 25.0统计学软件进行数据分析。计量资料用
表示,组间比较则采用单因素方差分析,以P < 0.05为差异有统计学意义。
3. 结果
3.1. 大鼠行为学及48小时存活情况
Sham组大鼠毛发均匀有光泽,反应敏捷,精神、食欲、大小便均正常。CLP组大鼠出现毛发束立,扎堆取暖,不进食、进水,对外界刺激反应迟钝,出现呕吐、腹泻,眼角可见渗血,12小时以后开始出现死亡大鼠。与CLP组比,ES组大鼠饮食、毛发状态、活动度、腹泻等多种情况均有明显好转,生存率较CLP组明显上升见图1。
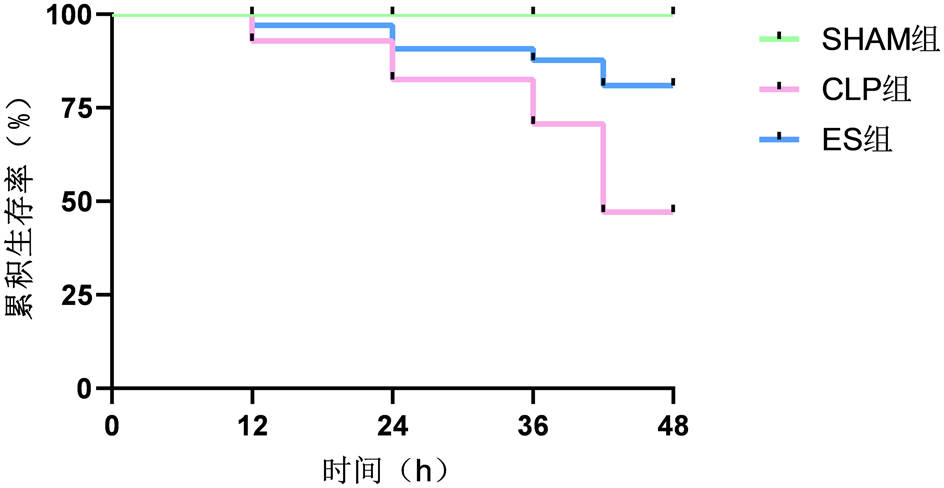
Figure 1. Effect of esmolol on 48 h survival in rats with sepsis
图1. 艾司洛尔对脓毒症大鼠48 h存活率的影响
3.2. 各组大鼠血清及肺组织匀浆中炎性因子水平比较
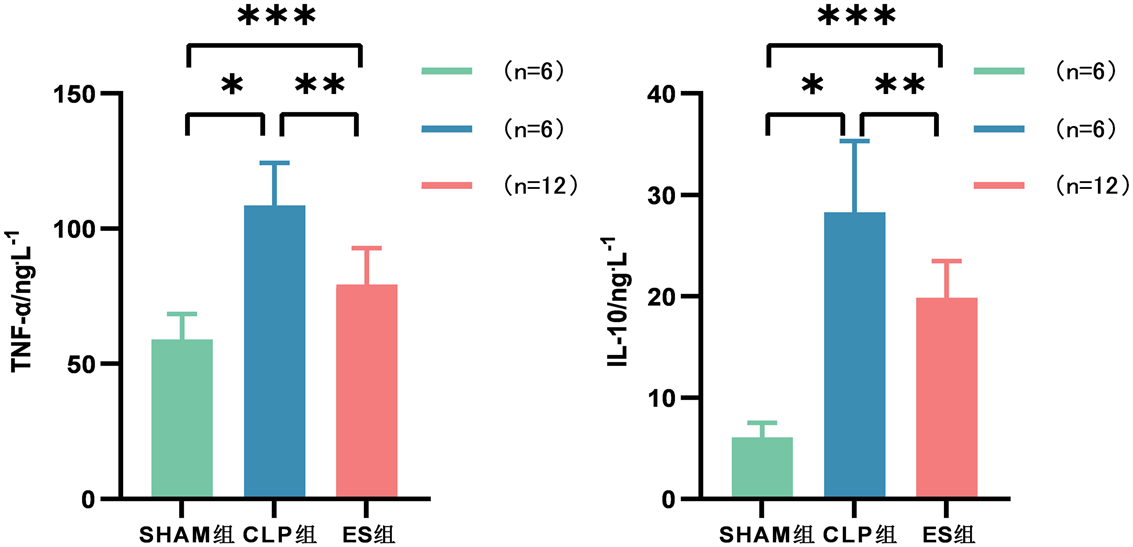
术后48 h,与Sham组比较,CLP组、ES组大鼠血清及肺组织匀浆中TNF-α、IL-10水平明显上升(P < 0.05);与CLP组比较,ES组大鼠血清及肺组织匀浆中TNF-α、IL-10水平显著降低(P < 0.05)见图2、图3。
3.3. 肺组织湿/干重比值
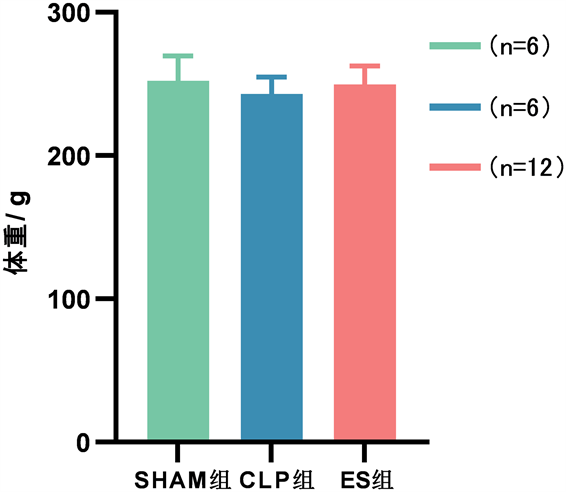
术前三组大鼠体重差别无统计学意义(P > 0.05)见图4。术后48 h,与Sham组相比,CLP组、ES组
 *P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
*P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
Figure 2. Comparison of serum levels of TNF-α and IL-10 in each group
图2. 各组大鼠血清TNF-α、IL-10水平
 *P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
*P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
Figure 3. Comparison of Lung tissue homogenate levels of TNF-α and IL-10 in each group
图3. 各组大鼠肺组织匀浆中TNF-α、IL-10水平
 *P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
*P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
Figure 4. Body weight of rats in each group before surgery
图4. 术前各组大鼠体重
大鼠肺组织W/D比值显著升高(P < 0.05);与CLP组比较,ES组大鼠肺组织W/D比值显著降低(P < 0.05)见图5。
 *P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
*P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
Figure 5. Wet/dry weight ratio of lung tissue in each group
图5. 各组大鼠肺组织湿/干重比值
3.4. 肺、心、肠组织病理
术后48 h,Sham组大鼠肺组织结构正常,肺泡轮廓完整,肺泡壁无增厚,未见炎性细胞浸润;与Sham组比较,CLP组脓毒症大鼠肺泡萎缩塌陷,肺泡壁水肿、增厚,可见炎症细胞浸润;与CLP组比较,ES组大鼠肺泡萎缩塌陷范围明显减少,肺泡部分结构正常,肺泡壁水肿程度减轻,炎症细胞浸润减少。
术后48 h,Sham组大鼠小肠显示规则的肠绒毛结构,肠黏膜上皮层与固有层完整连接。CLP组大鼠小肠绒毛明显排列紊乱,结构异常,肠黏膜可见炎症细胞浸润。ES组大鼠小肠绒毛结构破坏减轻,排列较规则,炎症细胞浸润减少。
术后48 h,Sham组心肌细胞形态正常,心肌纤维排列紧密,无明显水肿及渗出。CLP组心肌细胞水肿、坏死,呈带状空泡样变形,心肌纤维排列紊乱,可见炎症细胞浸润。与CLP组比较,ES组心肌细胞水肿、坏死程度减轻,心肌纤维排列较规整,可见少量炎症细胞浸润见图6。
3.5. 免疫组化
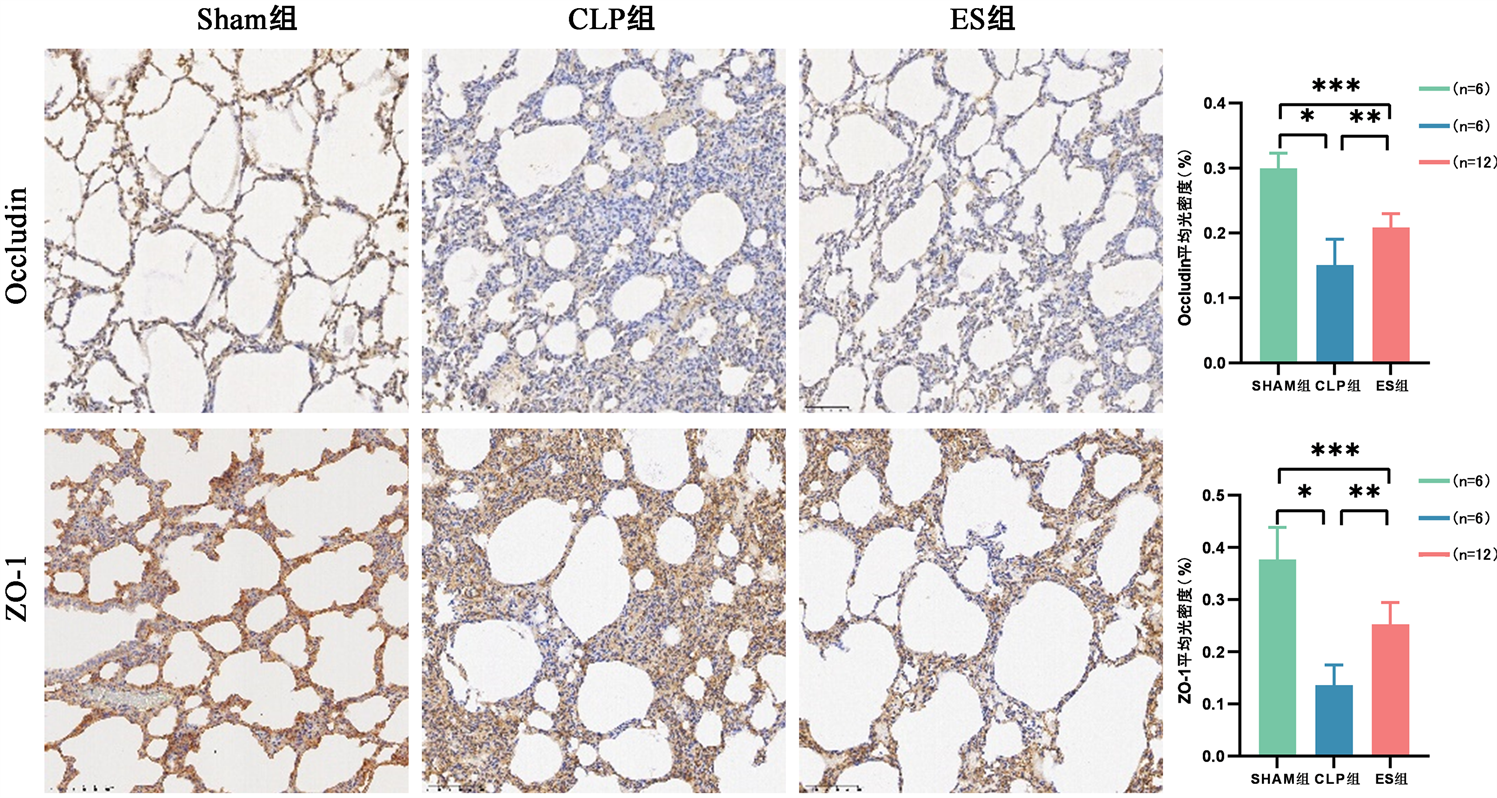
术后48 h,与Sham组比较,CLP组、ES组大鼠肺上皮屏障中紧密连接蛋白Occludin、ZO-1表达水平降低(P < 0.05);与CLP组比较,ES组肺上皮屏障中紧密连接蛋白Occludin、ZO-1表达水平显著上升(P < 0.05)见图7。
4. 讨论
脓毒症是一种由机体免疫反应过度激活引起的炎症性疾病 [1] [11] ,近年来研究证明胆碱能神经系统参与炎症反应的调节,脓毒症机体内交感神经兴奋增加,儿茶酚胺分泌加剧,包括TNF-α、白细胞介素(IL)-1b、IL-6和IL-18等促炎细胞因子进一步释放,促使机体产生强烈炎症反应,常常累及各个重要器

Figure 6. Pathological results of lung, intestine and heart histopathology in rats (HE staining, 100×)
图6. 各组大鼠肺、肠、心组织病理结果(HE染色,100×)
 *P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
*P < 0.05,与Sham组相比;**P < 0.05,与CLP组相比;***P < 0.05,与Sham组相比。
Figure 7. Immunohistochemical results of lung tissue of rats in each group (HE staining, 100×)
图7. 各组大鼠肺组织免疫组化结果(HE染色,100×)
官。肺作为炎性损伤的敏感靶器官,脓毒症感染后免疫应答诱导促炎因子和趋化因子释放 [12] ,一方面可以清除入侵的病原体,另一方面则导致弥漫性肺水肿和肺组织损伤,肺功能持续恶化 [13] [14] 。艾司洛尔作为一种新型的选择性β1受体阻滞剂,在抗炎、改善微循环、保护心肌、改善预后等方面的作用均已进行研究,成为治疗脓毒症的潜在药物 [7] 。既往研究证实,艾司洛尔不仅减慢脓毒症患者心率、减轻心肌损伤和改善左心室的舒张功能,而且可以抑制炎症反应和细胞凋亡过程 [6] [15] 。TNF-α作为重要的促炎因子,在炎症级联反应中最先被激活,作为预测脓毒症严重程度及并发症发展的指标 [16] 。而IL-10作为重要的抗炎因子,能抑制促炎介质产生。既往研究发现,IL-10在脓毒症患者血清中表达上调,可能与脓毒症早期,机体内炎症因子释放失控,促炎与抗炎介质失衡有关,其表达水平可预示死亡风险 [16] [17] 。本研究结果显示,CLP术后大鼠血清及肺组织匀浆中TNF-α水平高于正常大鼠,IL-10水平也极度升高,提示机体内炎症反应失衡,这与既往研究结果一致,脓毒症大鼠早期不仅出现肺组织水肿,炎症细胞浸润,在心、肠组织中也观察到炎症细胞浸润破坏正常组织结构,应用艾司洛尔治疗后可有效降低脓毒症大鼠循环中的炎性因子,减少组织炎症细胞浸润,改善全身多器官炎症状态。
肺泡表面覆盖的上皮细胞层是阻止微生物入侵的主要屏障,所以肺上皮屏障功能障碍被视为肺损伤的主要标志。紧密连接蛋白是肺泡上皮屏障的重要组成部分,对建立上皮屏障和维持上皮极性至关重要,在调节气体交换、液体转运,阻止有害物质入侵等环节发挥重要作用 [18] 。Occludin是是构成细胞膜紧密连接的重要成分之一,作为紧密连接的调节器参与细胞通透性和细胞信号传导调节,调节细胞膜的通透性,只允许小分子物质通过 [19] 。ZO-1是一种胞质外周膜蛋白,具有多个专门用于蛋白质相互作用的结构域,在紧密连接处形成了一个组织蛋白质的支架,参与机械转导,维持细胞的屏障功能 [20] 。既往已有研究证实,脓毒症小鼠早期即存在支气管肺泡灌洗液中炎性因子累积,肺泡上皮屏障中紧密连接相关蛋白水平表达降低,提示存在肺上皮屏障破坏 [21] 。TNF-α是重要的促炎介质,脓毒症期间释放后导致肺血管通透性增加,肺泡上皮屏障受损,ZO-1蛋白表达水平下调,紧密连接结构破坏加重 [22] ,受损的上皮屏障促进炎症因子浸润,产生恶性循环。在本研究中使用Occludin和ZO-1作为肺泡上皮屏障的指标,实验结果发现艾司洛尔能抑制脓毒症大鼠血清及肺组织中的中炎症因子TNF-α和IL-10的释放,上调ZO-1和Occludin蛋白的表达水平,减轻肺水肿,提高脓毒症大鼠生存率。以上结果证明艾司洛尔具有抑制炎症和保护肺上皮屏障的作用。
综上,艾司洛尔可能通过抑制炎性因子释放,减少炎症细胞浸润,维持体内炎症反应平衡,增加紧密连接相关蛋白表达,保护肺上皮屏障,缓解脓毒症导致的肺损伤并改善全身多器官炎症状态。
基金项目
心血管多学科整合思维研究基金项目(Z-2016-23-2001-32);烟台毓璜顶医院科研发展基金项目(2022-17)。
NOTES
*第一作者。
#通讯作者。