1. 引言
过氧化氢(H2O2)是生物和环境系统中的重要分子。在生命系统中,H2O2在物理信号通路、细胞生长、分化和增殖中起着重要作用 [1] [2] 。过氧化氢(H2O2)是最重要的活性氧之一,它参与许多细胞过程,从信号转导到免疫防御和氧化应激 [3] 。作为活性氧物种的成员,过氧化氢(H2O2)在氧化应激和细胞信号转导中起着关键作用 [4] ,H2O2水平升高会对活细胞造成严重损害,被广泛认为是细胞中的细胞毒剂 [5] 。大量研究表明,H2O2与多种人类疾病密切相关,如心血管疾病、糖尿病、帕金森病、阿尔茨海默、代谢性疾病和癌症 [6] 。因此,寻找一种准确、灵敏的检测方法以实现H2O2的快速检测,对于进一步研究H2O2在疾病病理方面的作用机制和影响具有重要的意义。到目前为止,已经开发了许多技术,如比色、发光、荧光和电化学方法 [7] [8] 。在众多方法之中,光电化学检测方法因其快速、灵敏、准确的优点备受关注 [9] [10] 。
卤氧化铋(BiOX, X = Cl, Br, I)因具有层状结构、合适的带隙和环境友好性,在光电化学应用中越来越受到关注 [11] 。BiOBr是一种四方晶相的半导体化合物,因其呈现花瓣状,具有较大的比表面积和更多的活性位点,有助于光生–电子空穴分离,进一步提高光电化学性能。虽然BiOBr因其独特的层状结构、合适的禁带宽度而具有相对较好的光电化学活性,但是在可见光的吸收范围和光生载流子的利用率上仍具有进一步提高的可能。目前常用的提高活性的改性方法有:元素掺杂、贵金属沉积和半导体复合等 [12] 。
纳米技术是一个不断发展的领域,因为它在各种学科中的应用范围更广。金属纳米粒子因其独特的生物亲和性、粒径小、制作方法简便、高导电性而被广泛使用 [13] 。金纳米材料在不同尺寸、距离、形状、成分等基底上的生长会产生不同的局域表面等离子共振(LSPR)峰以及显著的传感信号变化,通过控制颗粒形态和表面等离子体共振来调节和增强金纳米粒子的光学性质能力 [14] 。对于不加修饰的金纳米粒子 (Au NPs)的传感器往往受到其较差的选择性和特异性识别的限制 [15] 。因此将Au NPs和BiOBr进行复合,可以缓解光生–电子易重组的缺点,两组分协调发挥作用,可实现对特定分子的检测。
碳纳米材料是指三维空间尺寸中至少有一维处于纳米尺度范围且小于100 nm的碳材料,是21世纪主要研究和应用的纳米材料之一 [16] 。碳纳米管是一类常见的一维纳米材料,具有良好的导电性和化学稳定性。碳纳米管通常根据碳层数分为单壁(SWNTs)或多壁(MWNTs)碳纳米管 [17] 。单壁碳纳米管是包裹在管中的单层石墨烯,多壁碳纳米管由多个缠绕在彼此顶部的石墨层组成,管壁之间的直径约为0.34纳米 [18] 。在多壁碳纳米管(MWNTs)中,由于强的范德华引力,碳纳米管以聚集和纠缠网络的形式存在,与单壁碳纳米管相比,多壁碳纳米管由于成本较低而得到了广泛的应用 [19] 。然而碳纳米管的分散性差,且表面缺少活性基团,需要对其进行改性 [20] 。目前,对碳纳米管改性的方式主要是通过浓硫酸等氧化剂进行表面修饰从而得到含氧官能团,另一种活化方式是通过生物分子修饰或者是通过聚合物非共价键的方式活化碳纳米管防止其团聚增强其分散性 [21] 。
本课题通过水热法合成了Au NPs,将其与花状BiOBr通过搅拌制备Au@BiOBr纳米复合材料,结合MWNTs,制备Au@BiOBr/MWNTs复合材料,应用于对过氧化氢的光电化学检测。如流程图1所示,在可见光照的辅助下,Au NPs的LSPR效应以及BiOBr会产生光生电子(e−)空穴(h+)对,能够吸附溶液中的H2O2至电极表面并将其进行氧化,增强光电流。另一方面,MWNTs具有优异的导电性能,传导光生电子以及H2O2被氧化所产生的电子,有效抑制电子与空穴的复合,进一步提高光电流,在这三者的协同作用下,将实现对H2O2的超灵敏的光电化学检测。
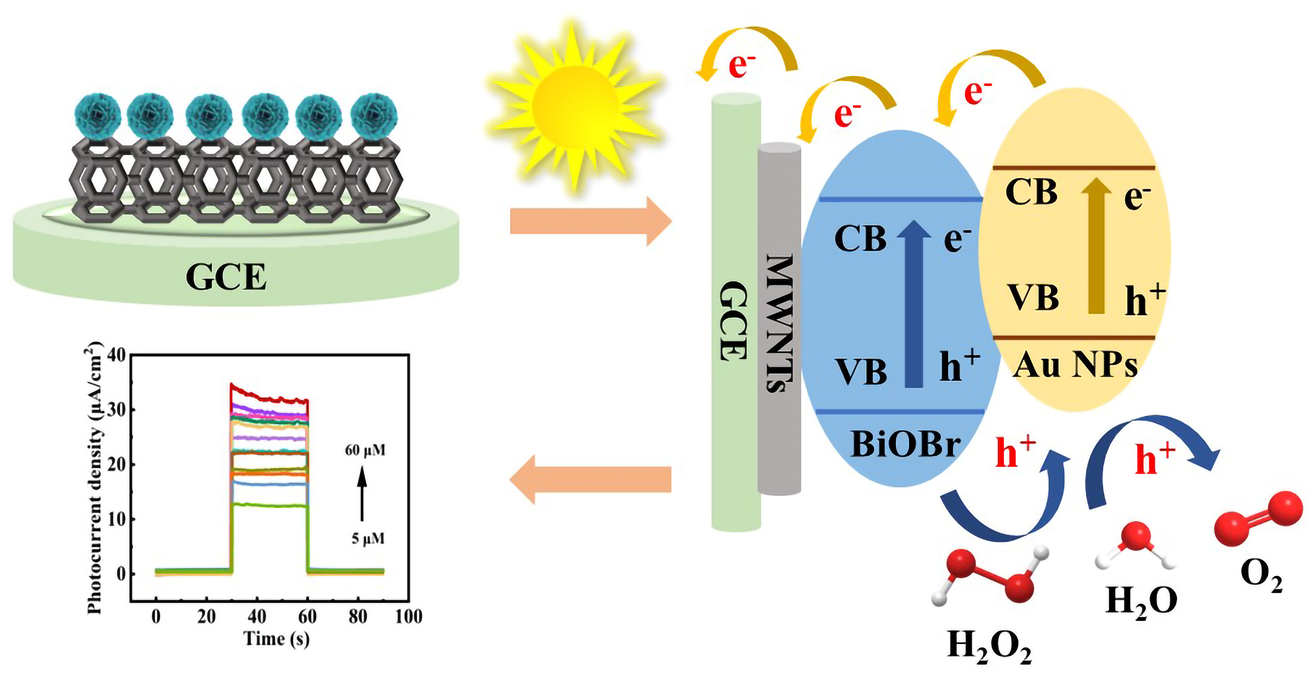
Scheme 1. Detection mechanism of the photoelectrochemical sensor
流程图1. 光电化学传感器的检测机理图
2. 实验部分
2.1. 实验试剂
本实验中使用的所有试剂均为分析级。无水柠檬酸钠(Na3Cit))购买自国药集团化学试剂有限公司;磷酸二氢钠二水合物(NaH2PO4∙2H2O)、聚乙烯吡咯烷酮(PVP)、铁氰化钾(K3[Fe(CN)6])、氯化钾(KCl)、五水合硝酸铋(Bi(NO3)3∙5H2O)购买自上海阿拉丁生化科技股份有限公司;无水柠檬酸(H3Cit)、多壁碳纳米管(MWNTs)购买自南通飞宇生物科技有限公司;十二水合磷酸氢二钠(Na2HPO4∙12H2O)、磷酸(H3PO4)、硝酸(HNO3)、过氧化氢(H2O2)购买自广东省西陇化工股份有限公司;尿酸(C5H4N4O3)、乙二醇(C2H6O2)、氯化钠(NaCl)、无水葡萄糖(C6H12O6)、亚铁氰化钾三水合物(K4[Fe(CN)6]∙3H2O)购买自上海麦克林生化科技有限公司;氯金酸(HAuCI4)购买自Sigma-Aldrich公司。
2.2. 实验仪器
实验所用仪器:SEM-300型扫描电子显微镜,德国CARL ZEISS卡尔蔡司公司生产;UV-3600型紫外分光光度计,日本日立有限公司生产;D8 Advance型X射线衍射仪,德国布鲁克AXS有限公司生产;GY-10型氙灯,天津拓普仪器有限公司生产。所有实验均采用传统的三电极系统进行,CHI660E电化学工作站,上海晨华仪器公司生产;3 mm型玻碳电极(GCE),10 mm型铂网电极,天津艾达科技有限公司生产;RO232饱和甘汞电极(SCE),上海Ruosull公司生产。
2.3. 实验方法
Au@BiOBr/MWNTs/GCE的制备
采用热还原法制备金纳米粒子。将0.9 mL柠檬酸和2.1 mL柠檬酸钠(0.1 mol/L)加入150 mL沸水中,搅拌15 min。再加入1 mL (25.4 mmol/L)氯金酸,搅拌3 min后,放入冰水中淬灭,用超纯水离心洗涤多次,将沉淀物分散至10 mL超纯水中。
将Bi(NO3)3∙5H2O分散在30 mL混合溶液中(超纯水与乙二醇的体积比为1:5),超声分散后加入0.40 g PVP,搅拌30 min,得到无色透明溶液。再加入0.12 g KBr继续搅拌30 min后得到白色悬浮液。将溶液转移到160℃的高压釜中反应3 h,得到的溶液用超纯水和乙醇离心洗涤多次,沉淀物冷冻干燥过夜,得到BiOBr白色粉末。在Au NPs (2 mL)溶液中加入BiOBr (5 mg),搅拌30 min,得到Au@BiOBr复合材料。
将1.0 g多壁碳纳米管分散在50 mL浓硝酸(68 wt%)中,通过超声处理30 min,在150℃油浴锅内加热回流5 h [22] 。得到的产物用超纯水大量洗涤,直至pH达到7,将制备好的样品冷冻干燥后保存待用。
先后滴涂10 μL MWNTs和Au@BiOBr溶液至GCE表面,置于50℃的红外灯下烘干,制备Au@BiOBr/MWNTs复合材料。
3. 结果与讨论
3.1. BiOBr、MWNTs和Au@BiOBr/MWNTs的形貌表征
采用扫描电子显微镜(SEM)对样品的形貌进行表征。图1(A)、图1(D)为制备的BiOBr的样品,BiOBr是由层层纳米片堆积而成的纳米花结构,合成的BiOBr纳米花大小均一,尺寸约为250 nm。图1(B)、图1(E)显示了MWNTs的SEM图,MWNTs具有相互缠绕、错综交织的管状结构,这是因为碳纳米管主要是由石墨烯卷曲而形成的一维管状分子。复合材料Au@BiOBr/MWNTs的形貌图如图1(C)、图1(F),金纳米颗粒分散在BiOBr纳米花上,Au@BiOBr立体置于MWNTs上。
3.2. Au、BiOBr、MWNTs和Au@BiOBr/MWNTs的物理表征
采用X射线衍射仪对材料的晶体结构进行分析,如图2(A)所示,粉线展示了Au NPs的XRD峰,其衍射峰在2θ为38˚、44˚、65˚和76˚分别对应于(111)、(200)、(220)、(311)晶面 [23] 。蓝线显示了BiOBr的衍射峰在2θ为25˚、31˚、46˚、53˚、57˚、77˚处 [24] 。MWNTs的典型的衍射峰在2θ为25˚和44˚对应的晶面为(002)和(100) [25] [26] 。与Au@BiOBr复合之后,在Au@BiOBr/MWNTs复合材料的X射线衍射图中能清楚地观察到典型的Au的(200)、(311)晶面,BiOBr的(110)、(211)与(212)晶面和MWNTs的(002)晶面,证实Au@BiOBr/MWNTs复合材料制备成功。
通过紫外–可见吸收光谱(UV-vis)对材料吸收光的能力进行表征。如图2(B)所示BiOBr在375 nm处有一个吸收峰,主要是BiOBr为间接带隙半导体,在近紫外区域吸收明显。MWNTs在254 nm处的吸收峰为基底吸收峰,与碳原子的sp2杂化有关。Au NPs约在520 nm出现典型的局域表面等离子共振带的吸收峰,Au@BiOBr/MWNTs复合材料在254和520 nm有明显的吸收峰,在375 nm有一个较宽的吸收峰,分别对应MWNTs、Au NPs和BiOBr的吸收峰,证实材料成功复合 [27] 。

Figure 1. (A) (D) SEM images of BiOBr, (B) (E) SEM images of MWNTs, (C) (F) Au@BiOBr/ MWNTs at different magnifications
图1. 不同放大倍数下的(A) (D) BiOBr的扫描电镜图,(B) (E) MWNTs的扫描电镜图,(C) (F) Au@BiOBr/MWNTs的扫描电镜图
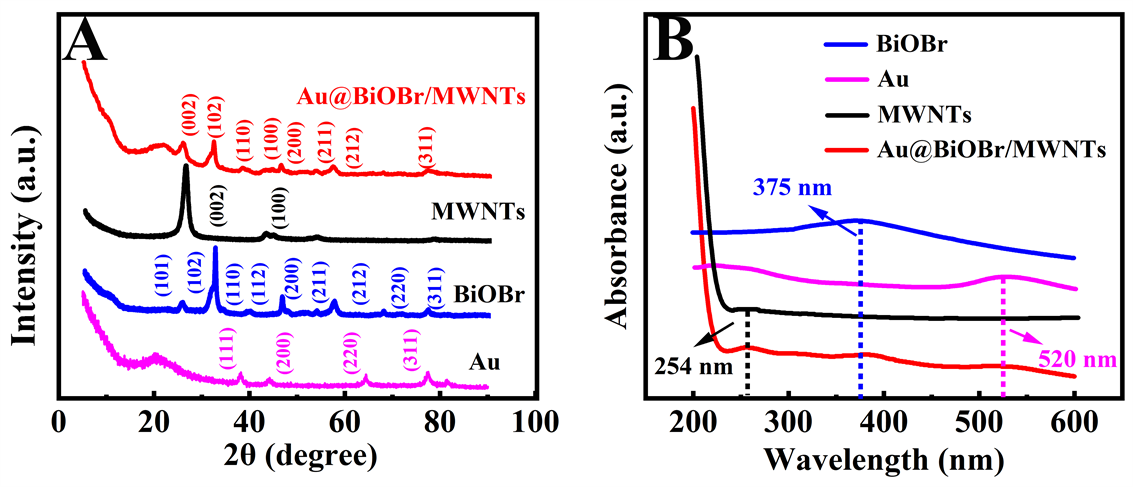
Figure 2. (A) The XDR patterns of Au, BiOBr, MWNTs, Au@BiOBr/MWNTs, (B) Ultraviolet-visible diffuse reflectance spectra (UV-vis) of Au, BiOBr, MWNTs, Au@BiOBr/MWNTs
图2. (A) Au、BiOBr、MWNTs和Au@BiOBr/MWNTs的X射线衍射图,(B) Au、BiOBr、MWNTs和Au@BiOBr/MWNTs的紫外–可见吸收光谱图
3.3. Au@BiOBr、MWNTs、Au@BiOBr/MWNTs的电化学和光电化学性能
通过循环伏安法研究制备的不同电极在电化学反应中的电荷转移情况,如图3(A)在5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]和0.1 mol/L KCl溶液中,MWNTs电极具有最大的氧化峰电流,Au@BiOBr/MWNTs电极的氧化峰电流略高于Au@BiOBr电极,这主要是因为MWNTs具有优异的导电性,经过MWNTs修饰后的电极大大提高了电流。通过EIS对不同电极的电荷转移能力进行比较,图3(B)是制备的电极在5 mM K3[Fe(CN)6]/K4[Fe(CN)6]和0.1 M KCl溶液中的EIS曲线。在EIS图中,半圆的直径可以评估出电极的电荷转移电阻(Rct)的大小,半圆直径越大,电荷转移电阻越大。由图可知:Au@BiOBr > Au@BiOBr/ MWNTs > MWNTs,电子传递能力依次增强,证明MWNTs具有较高的电荷转移能力,这与循环伏安法的结果一致。
通过差分脉冲法(DPVs)研究了在可见光照射下Au@BiOBr/GCE、MWNTs/GCE和Au@BiOBr/MWNTs/ GCE电极在含有1 mmol/L H2O2的PBS缓冲溶液中的光电化学活性如图3(C)。Au@BiOBr/MWNTs/GCE在可见光照射下的氧化峰电流(约为1196 μA)比在无光情况下的氧化峰电流(约为1118 μA)高出78 μA。从恒定电压下测量的i-t曲线也可以清楚的观察到这一现象图3(D),在光照条件下,Au@BiOBr/MWNTs/GCE光电流密度急剧增加,而在黑暗条件下,光电流密度迅速下降。相比于Au@BiOBr/GCE和MWNTs/GCE,Au@BiOBr/MWNTs/GCE显示出最强的光电流密度,这主要是因为Au@BiOBr和MWNTs之间的协同作用所产生的。一方面,在光照条件下,Au NPs会产生局域表面等离子共振效应,会增强光电流响应,而BiOBr会产生电子空穴对,吸附溶液中的H2O2到电极表面进行氧化,光电流进一步提高。另一方面,MWNTs具有优异的导电性能,有效抑制电子与空穴的复合,从而氧化H2O2产生更多的电子,进而提高光电流密度。
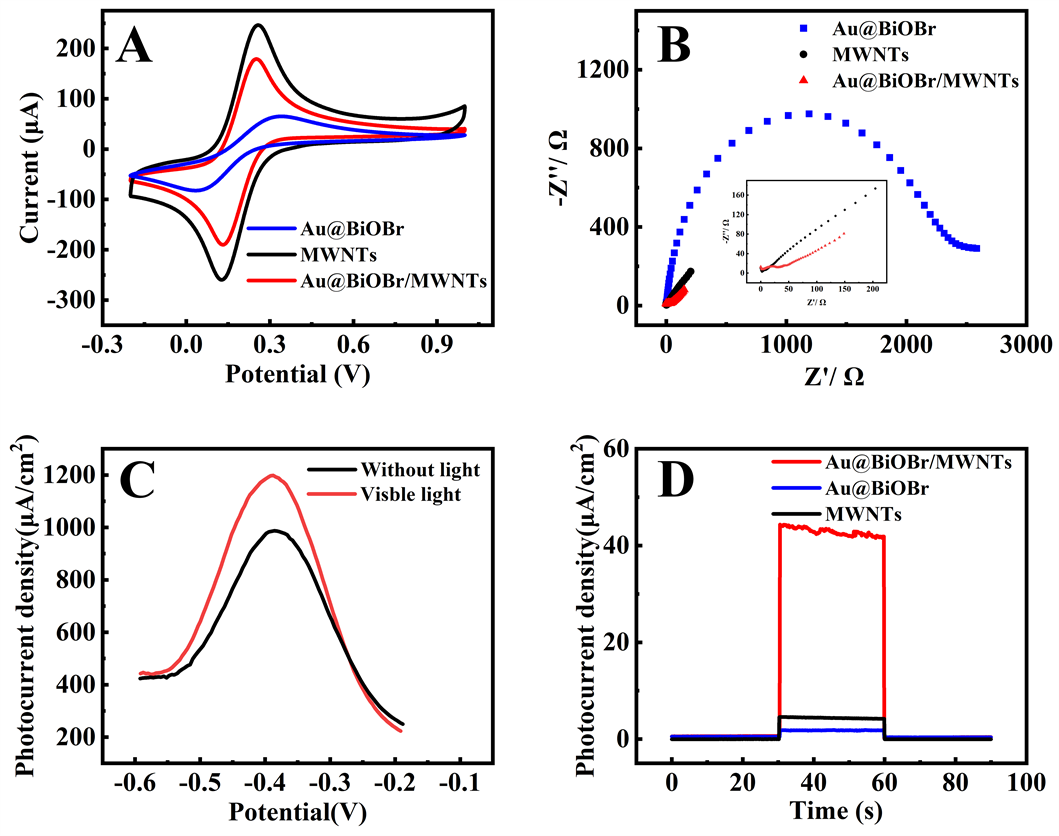
Figure 3. (A) CVs and (B) EIS of Au@BiOBr, MWNTs, Au@BiOBr/MWNTs electrodes recorded in 5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6] + 0.1 mol/L KCI solution, (C) DPVs of Au@BiOBr/MWNTs electrode recorded in PBS (pH = 9.0) conataining 1 mmol/L H2O2 under visible light and dark environment, (D) Transient photocurrent density versus time plotted in PBS (pH = 9.0) containing 1 mmol/L H2O2 under visible light illumination. The illumination from a Xe lamp was interrupted every 30 s
图3. (A) Au@BiOBr、MWNTs、Au@BiOBr/MWNTs修饰电极在5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]和0.1 mol/L KCI溶液中的循环伏安曲线和(B) 阻抗曲线图,(C) 在有光无光条件下,Au@BiOBr/ MWNTs在含有1 mmol/L H2O2的PBS (pH = 9.0)中的差分脉冲伏安曲线图,(D) Au@BiOBr、MWNTs、Au@BiOBr/MWNTs在含有1 mM H2O2的PBS (pH = 9.0)中的瞬态光电流和时间曲线,光源为氙灯,每30 s中断一次
3.4. Au@BiOBr/ MWNTs检测H2O2的条件优化
溶液的pH值和工作电极的扫描速率是影响电化学反应过程的关键因素。为了探索Au@BiOBr/ MWNTs的光化学反应动力学因素,在可见光照射下研究了扫描速率和溶液的pH值对检测过氧化氢的影响。图4(A)显示了Au@BiOBr/MWNTs在不同pH溶液中的光电流响应。图中可观察到,最大的氧化峰电流出现在pH为9.0处,因此选择pH为9.0进行后续的实验。同时,氧化峰电流密度随pH的增加而负移,说明反应过程中存在质子转移过程 [28] ,相应的线性方程为Epa = −0.0247pH − 0.2265,(R2 = 0.9905) (图4(B))。
图4(C)显示了在1 mmol/L H2O2中Au@BiOBr/MWNTs在可见光照射下的线性扫描伏安曲线,扫描速率范围为20到200 mV∙s−1。可以观察到氧化峰电流随着扫速的增加而增加,线性回归方程为Ipa (μA) = 11.8137v + 612.6,(R2 = 0.9949),表明过氧化氢在Au@BiOBr/MWNTs/GCE上的电子转移为吸附过程控制 [29] 。
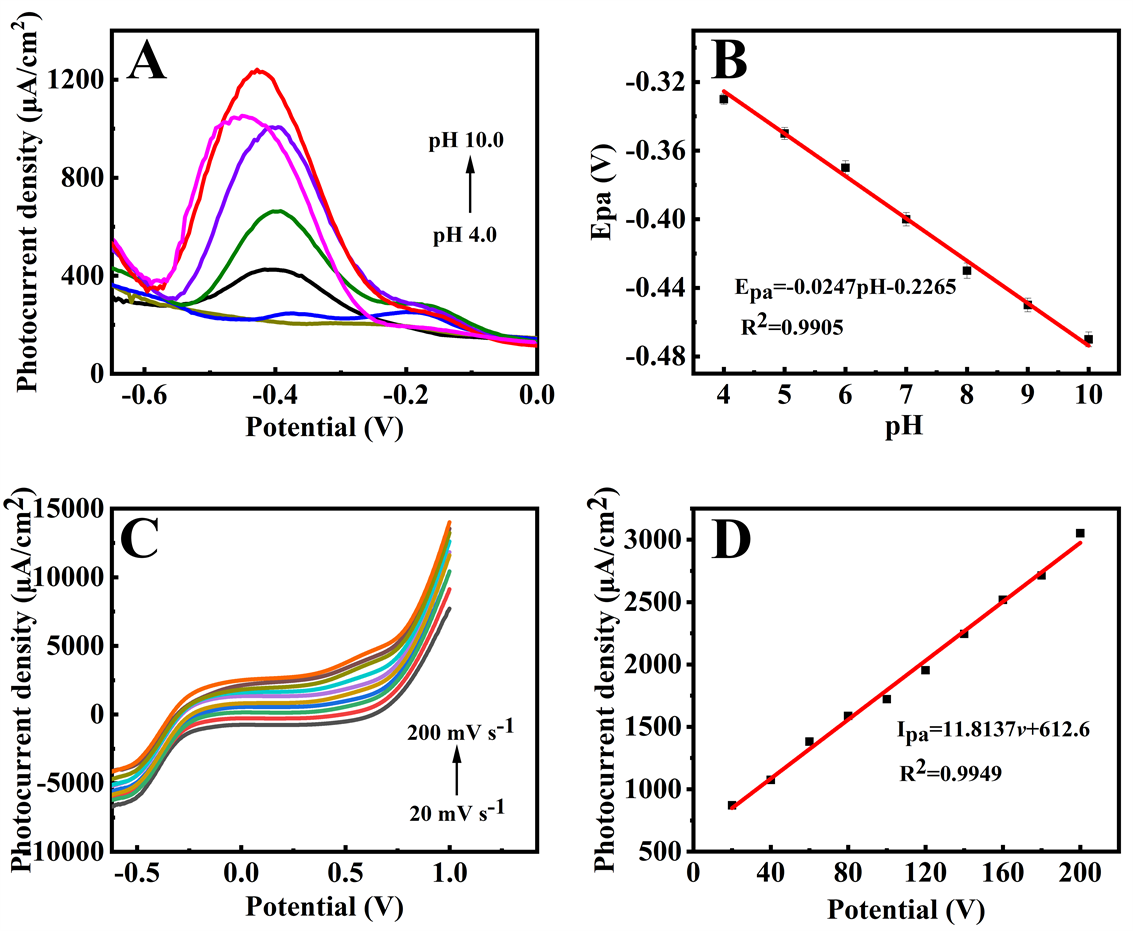
Figure 4. (A) The DPVs of the Au@BiOBr/MWNTs/GCE in PBS solution containing 1 mmol/L H2O2 under visible light illumination at various pH values from 4 to 10, (B) The linear relationship between oxidation peak potential versus pH values, (C) The LSVs of scan rates of the Au@BiOBr/MWNTs/GCE from 20 to 200 mV∙s−1 in 1 mmol/L H2O2, (D) The linear relationship between oxidation peak current and scanning rate
图4. (A) 在光照下,Au@BiOBr/MWNTs/GCE在含有1 mmol/L H2O2的PBS缓冲液中不同酸碱度下(pH = 4、5、6、7、8、9、10)的差分脉冲伏安曲线图,(B) 相应的氧化峰电位和pH之间的线性关系图,(C) 在光照下,Au@BiOBr/MWNTs/GCE在扫描速率不同(20~200 mV∙s−1) 时的线性扫描伏安曲线图,(D) 相应的氧化峰电流和扫描速率之间的线性关系图
3.5. 优化检测限,稳定性,抗干扰性的研究
通过瞬态光电流和时间曲(i-t)来探究在可见光照射下Au@BiOBr/MWNTs对不同浓度的过氧化氢的PEC性能。如图5(A)所示,光电流密度随着H2O2浓度从5 μmol/L增加到60 μmol/L而增强。图5(B)为氧化峰电流和不同H2O2浓度之间的线性关系,线性回归方程为I = 0.3259C + 12.8834,(R2 = 0.915),计算出检出限为1.7 μmol/L。
通过i-t曲线来研究Au@BiOBr/MWNTs/GCE在含有5 μmol/L H2O2的PBS缓冲液中的光电化学性能。如图5(C)所示,氙灯照射情况下,Au@BiOBr/MWNTs/GCE电流显著增大,而关闭氙灯时,电流迅速下降,进一步说明在有光照的条件下,Au@BiOBr/MWNTs/GCE检测过氧化氢电流响应会增强。在经过多次的开–关之后,光电流密度几乎保持不变,表明Au@BiOBr/MWNTs/GCE具有优异的稳定性。
抗干扰性也是免疫分析的一个非常重要的标准,它可能受到非特异性吸附的影响。在抗干扰的实验中,选取了五种相似的物质作为抗干扰物,分别是葡萄糖(GIu)、尿酸(UA)、抗坏血酸(AA)、NaCI、牛血清蛋白(BSA)。用DPVs来测定Au@BiOBr/MWNTs/GCE上光电流响应Ip和Ipa的相应变化曲线(Ip/Ipa,Ip是H2O2溶液中的氧化峰电流,Ipa为H2O2中添加抗干扰物质后的氧化峰电流)。可以观察到,在加入不同抗干扰物质后,Au@BiOBr/MWNTs/GCE的氧化峰电流变化很微小,表明添加的抗干扰物质对过氧化氢的检测几乎没有影响,说明Au@BiOBr/MWNTs/GCE具有优异的抗干扰性。
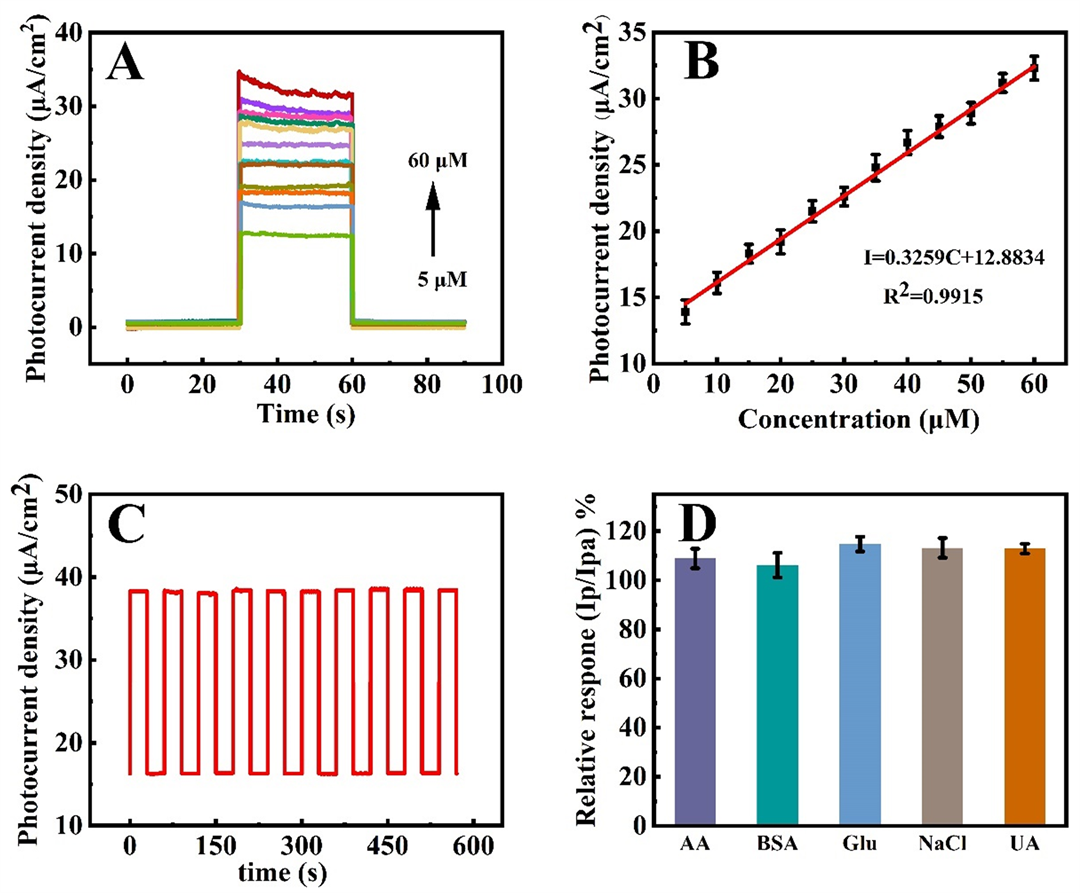
Figure 5. (A) I-t curves of Au@BiOBr/MWNTs in PBS buffer containing different concentrations of H2O2. The illumination from a Xe lamp was interrupted every 30 s, (B) Corresponding calibration curve, (C) I-t curve of Au@BiOBr/MWNTs in PBS buffer containing 5 μmol/L H2O2, (D) Relative analytical response (Ip/Ipa) for 5 μmol/L H2O2 in presence of compounds. The potential interferents are 50 μmol/L AA, BSA, Glu, NaCl, UA, respectively
图5. (A) Au@BiOBr/MWNTs在含有不同浓度H2O2的PBS缓冲液中的i-t曲线图,光源为氙灯,每隔30 s开关一次,(B) 相应的校准曲线,(C) Au@BiOBr/MWNTs在含有5 μmol/L H2O2的PBS缓冲液中的i-t曲线图,(D) 5 μmol/L H2O2和存在干扰物质时的相对应的光电流值,干扰物质分别为50 μmol/L AA (ascorbic acid 抗坏血酸),BSA (bovine serum albumin牛血清蛋白),Glu (Glucose 葡萄糖),NaCl,UA (Uric Acid 尿酸)
4. 结论
如上所述,我们构筑了基于Au@BiOBr/MWNTs光电化学传感器,用于对过氧化氢的超灵敏检测。在可见光照射下,Au NPs的LSPR效应、BiOBr会产生光生电子(e−)空穴(h+)对以及MWNTs优异的导电性能,实现对H2O2的超灵敏检测。Au@BiOBr/MWNTs电极检测过氧化氢有明显的光电流响应,检测范围为5~60 μmol/L,检出限为1.7 μmol/L。因此,所建立的PEC传感器开辟了一个全新的途径来监测细胞内活性氧(ROS)水平,具有快速、简单、可重复的识别性能。
基金项目
本项目由国家自然科学基金(批准号:32101215)。
NOTES
*通讯作者。