1. 引言
火焰原子吸收光谱仪因其抗干扰能力强,检出限低而被广泛运用于矿石的测定 [1] [2] 。铁矿石是钢铁生产企业的重要原材料,广泛用于建筑、汽车、机械、航空航天等领域,天然矿石中铁元素以单质和化合物形式存在 [3] [4] [5] 。铁矿石的种类很多,用于炼铁的主要有磁铁矿、赤铁矿和菱铁矿等。铁矿石中铁含量检测通常是有汞法和无汞法两种方法 [6] [7] 。对于有汞法,试样溶解后,铁元素以Fe3+存在,在强酸性条件下,用过量SnCl2将其还原为Fe2+,HgCl2除去过量的SnCl2,生成的白色丝状沉淀不会被滴定剂K2Cr2O7氧化。然后在硫磷混酸介质中,二苯胺磺酸钠为指示剂,用K2Cr2O7溶液滴定至溶液呈现紫色,即为终点。该方法成熟,准确度高,但是将有害元素Hg引入环境,造成严重污染。而对于无汞法则是用SnCl2将大部分Fe3+还原为Fe2+,再用TiCl3还原剩余的Fe3+。当全部Fe3+定量还原为Fe2+之后,稍过量的TiCl3即可使溶液中作为指示剂的Na2WO4由无色还原为蓝色的W5+,俗称钨蓝 [8] 。然后用少量的稀K2Cr2O7溶液将过量的钨蓝氧化,使蓝色恰好消失,从而指示预还原的终点,该方法避免Hg对环境的污染 [9] [10] [11] [12] 。但是这两种方法都属于滴定法,操作复杂,需要用到试剂较多,而且无法同时测定里边其他金属元素 [13] [14] 。本文用火焰原子吸收法测定了铁矿石中的铁、铜和钾三种常见元素,并对测试条件进行优化和不确定度分析,建立了一种快速、准确检测铁矿石中的铁、铜和钾含量的方法。
2. 实验部分
2.1. 主要试剂
盐酸、氢氟酸和硝酸(优级纯,东南化工);高氯酸(优级纯,国药);铁、铜、钾标准储备液(1000 ug/ml,钢研纳克)。实验用水为超纯水。
2.2. 仪器
火焰原子吸收光谱仪(北京海光GGX810);电子天平(赛多利斯,BSA224S);铁、铜和钾空心阴极灯(北京普析通用仪器有限责任公司);电热板。
2.3. 样品前处理方法
精密称取约1 g试样于烧杯中(精确至0.0001 g),用10 mL润湿,加入王水:氢氟酸:高氯酸比例为 7:7:1的四酸混合液20~25 mL,电热板上加热消解并不时摇动,直至蒸发至无高氯酸烟雾产生。冷却至室温后,加入20 mL 6 mol盐酸,加热10 min待可溶性盐全部溶解后过滤,将滤液转移至250 mL容量瓶中,定容,摇匀,待测。按上述相同操作步骤制备试剂空白溶液。
2.4. 标准溶液配制
铁系列标准溶液:使用铁标准储备溶液分别配制浓度为2.0 mg/L、4.0 mg/L、6.0 mg/L、8.0 mg/L、10.0 mg/L的系列标准溶液。
铜系列标准溶液:使用铜标准储备溶液分别配制浓度为1.0 mg/L、2.0 mg/L、3.0 mg/L、4.0 mg/L、5.0 mg/L的系列标准溶液。
钾系列标准溶液:使用钾标准储备溶液分别配制浓度为0.4 mg/L、0.8 mg/L、1.2 mg/L、1.6 mg/L、2.0 mg/L的系列标准溶液。
介质均为体积分数为4%的盐酸。
2.5. 仪器准备
至少提前2 h打开仪器,并预热元素灯30 min,点燃火焰后以超纯水代替测试液冲洗2 min以上,测试时从低浓度开始到高浓度,依次测量系列标准溶液的吸光度。然后以浓度为横坐标,吸光度为纵坐标建立标准工作曲线。分别测定空白溶液和试样溶液中铁、铜和钾的吸光度,代入工作曲线计算待测液中铁、铜和钾含量。仪器工作条件见下表1。

Table 1. Working parameters of the instrument
表1. 仪器工作参数
3. 结果与讨论
3.1. 基线稳定性测试
仪器稳定性直接影响实验结果的准确性,因此以铜元素灯为光源,超纯水为样品,进行20 min测试来校准仪器稳定性。结果表明(图1),20 min内基线波动±0.008,其相对误差在允许范围内,满足测试需求。
3.2. 仪器精密度测试
为减少误差,使测试结果更准确,0.5 mg/L铜标准溶液重复测定7次,计算其相对标准偏差(RSD)值来表示仪器的精确度,结果见表2。由表可知,相对标准偏差0.0010,仪器精密度(RSD) 0.7%,符合测试标准。

Table 2. Instrument precision test
表2. 仪器精密度测试
3.3. 火焰燃气流量的选择
FAAS测试时不同元素的分析需要选择贫燃、富燃不同的条件。固定助燃气空气流量为16 L/min,调整乙炔流量,测定铁,铜和钾混合标准溶液,记录其吸光度来确定合适的燃烧条件,结果见图2(a)。由图可知,当乙炔流量为1.2 L/min左右时,三种元素均能得到最高的吸光度。因此,当空气流量为16.0 L/min时,确定乙炔流量为1.2 L/min。
3.4. 狭缝宽度的选择
狭缝宽度对不同元素分析有重要影响,因此选择合适狭缝宽度非常必要。一般来说,吸光度随着狭缝宽度的增加先增大,当达到最大时,随着狭缝增宽,吸光度就开始减小。因此最大吸光度时的狭缝宽度即为适合的狭缝宽度。将铁、铜和钾混合标准溶液作为样品,喷入火焰中,调节狭缝宽度,测定不同狭缝宽度下的吸光度。由图2(b)可知,对于Fe和Cu元素,狭缝宽度0.2 nm最适合;0.4 nm狭缝宽度适合钾元素。
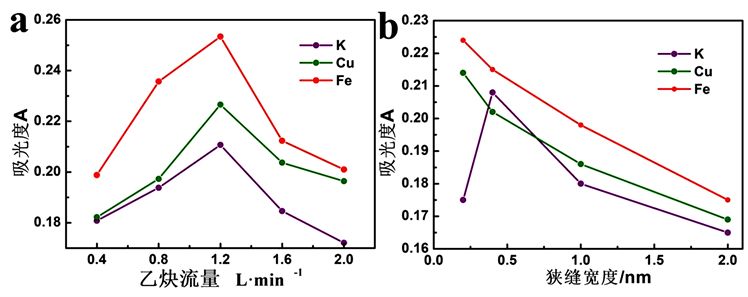
Figure 2. Absorbance of (a) Different flame gas flows and (b) With different slit widths
图2. (a) 不同火焰燃气流量的吸光度图;(b) 不同狭缝宽度的吸光度
3.5. 线性方程和检出限
通过配制一系列质量浓度的相应元素标准溶液,测试时由低浓度到高浓度依次测量。绘制工作曲线时,以吸光度(y)为纵坐标,以质量浓度(x)为横坐标。通过拟合线性方程和相关系数见图3。由图3可得,铁元素标准曲线线性方程为:y = 0.7324x − 0.2205,相关系数R2 = 0.999;铜元素标准曲线线性方程为:y = 0.217x − 0.0117,R2 = 0.999;钾元素标准曲线线性方程为:y = 0.2865x + 0.0037,R2 = 0.999。
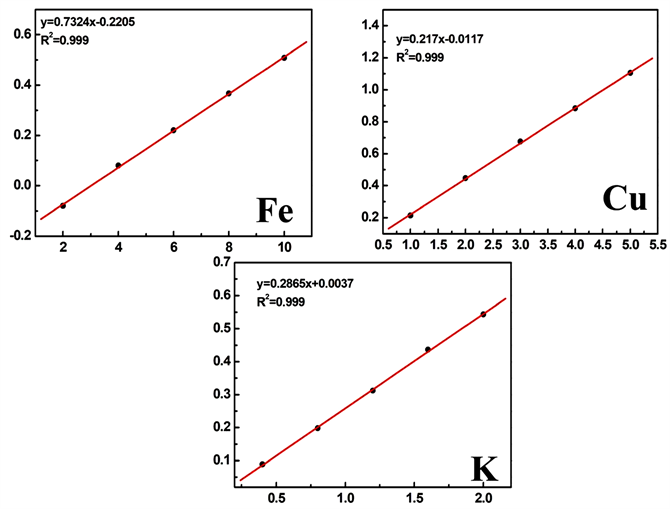
Figure 3. Standard curve of iron, copper and potassium
图3. 铁、铜和钾元素标准曲线
3.6. 精密度和回收率试验
称量3份铁矿石试样,按实验方法进行处理,对每个样品中的铁、铜和钾分别重复测定3次,然后计算其RSD值;计算加标回收率时,分别加入是适量的铁、铜和钾标准溶液于上述试样中,其结果见表3。由表3可知,铁含量的相对标准偏差(RSD)为0.1%~0.7%,加标回收率为97%~98.6%;铜含量的相对标准偏差(RSD)为0.1%~1%,加标回收率为99%~100%;钾元素含量的相对标准偏差(RSD)为0.7%。


Table 3. Experimental results of precision and recovery
表3. 精密度和回收率实验结果
4. 不确定度评定
4.1. 数学模型
式中:ω——矿石中元素中质量分数;c0——扣除试剂空白后样品测定液中元素的浓度;V——样品处理后的定容50 mL;m——样品质量1.0000 g。
4.2. 不确定度分量的评定
4.2.1. 测量重复性u0
铁含量单次测量标准偏差s = 0.0387%,以3次测量的平均值作为测量结果,那么平均值的标准偏差sa = 0.0387/31/2 = 0.2023%。因此u0rel = 0.0223/16.508 = 0.0014。
同理得到铜含量sa = 0.0607/31/2 = 0.0350%,u0rel = 0.0350/97.8 = 0.0053;钾含量sa = 0.0217/31/2 = 0.0125%,u0rel = 0.0125/97.8 = 0.0030。
4.2.2. V的标准不确定度u1
50 mL的A级容量瓶允差为±0.050 mL,矩形分布k = 31/2,u2 = 0.050/31/2 = 0.0289 mL,那么u1rel = 0.0289/50 = 0.000577。所有实验在环境温度为25℃进行,因此温度对体积的影响可忽略 [15] 。
4.2.3. m的标准不确定度u2
天平的误差范围为±0.0001 g,需要空瓶质量m1和样品质量m2两次称量,符合矩形分布k = 31/2,则μ2 = 0.0001 × 21/2/31/2 = 0.000245 g,那么μ2rel = 0.000245 g/1.0000 g = 0.000245。
4.2.4. 稀释过程引入的标准不确定度u3
1000 μL可调移液器的允差为±1.5%,按矩形分布k = 31/2,μ3 = 1000 μL × 1.5%/31/2 = 8.66 μL那么μ3rel = 8.66 μL/1000 μL = 0.00866。
4.2.5. 取样标准不确定度u4
按GB/T 10322.1-2000《铁矿石校核取样和制样方法》规定,样品充分混匀,然后随机取样,取样不确定度可忽略。
4.2.6. 试剂空白标准不确定度u5
使用试剂均为优级纯,符合GB/T5009.13-2003的要求,因此不确定度的影响可忽略。
4.3. 计算合成标准不确定度uc
Fe:ucrel = [Σu2irel(y)]1/2 = 0.0088 μc = 15.508% × 0.0088 = 0.1453%
Cu:ucrel = [Σu2irel(y)]1/2 = 0.0102 μc = 6.530% × 0.0102 = 0.0666%
K:ucrel = [Σu2irel(y)]1/2 = 0.0092μc = 4.189% × 0.0102 = 0.0385%
4.4. 计算扩展不确定度U (取包含因子k = 2)
Fe:U = 2 × uc = 2 × 0.1453% = 0.2906%
Cu:U = 2 × uc = 2 × 0.0666% = 0.1332%
K:U = 2 × uc = 2 × 0.0385% = 0.0770%
4.5. 结果表示
铁矿石中数据结果汇总于表4:

Table 4. Results of element content in iron ore samples
表4. 铁矿石中元素含量测定结果
5. 结论
本工作提出了FAAS测定铁矿石中的铁、铜和钾含量的方法。结果表明,对于Fe和Cu元素,狭缝宽度0.2 nm;K元素0.4 nm狭缝宽度,乙炔流量为1.2 L/min时为测定铁、铜和钾含量的最佳条件。该方法测得铁含量为(15.51 ± 0.3)%,RSD为0.1%~0.7%,加标回收率为97%~98.6%;铜含量的RSD为0.1%~1%,加标回收率为99%~100%。滴定法需要用到许多重金属试剂如SnCl2,HgCl2,K2Cr2O7,不仅会造成环境污染,而且操作复杂,终点判断完全依靠眼睛识别,误差较大。与之相比,本方法所用试剂较少,操作简单,能快速、准确、可靠测定铁矿石中铁、铜和钾元素含量,是一种快速并且高效的方法。
HgCl2除去过量的SnCl2,生成的白色丝状沉淀不会被滴定剂K2Cr2O7氧化。然后在硫磷混酸介质中,二苯胺磺酸钠为指示剂,用K2Cr2O7溶液滴定至溶液呈现紫色,即为终点。该方法成熟,准确度高,但是将有害元素Hg引入环境,造成严重污染。而对于无汞法则是用SnCl2将大部分Fe3+还原为Fe2+,再用TiCl3还原剩余的Fe3+。当全部Fe3+定量还原为Fe2+之后,稍过量的TiCl3即可使溶液中作为指示剂的Na2WO4。
NOTES
*通讯作者。