1. 引言
在过去的十年里,尤其是在晚期非小细胞肺癌的管理取得了重大进展,异常基因的识别和靶向药物以及免疫治疗的突飞猛进,使得非小细胞癌的治疗推向了精准诊疗的前沿 [1] 。但对于一些晚期NSCLC患者的亚组,尽管有了进展,NSCLC患者的5年相对生存率约为26%,且经常出现耐药和复发 [2] 。因此,开发新的靶向和策略来恢复患者对普通药物的反应性是至关重要的。
新的证据表明,驱动蛋白-11 (KIF-11)在癌症的发生、发展和进展中起着关键作用。然而,驱动蛋白-11在肺腺癌中的生物学意义、基因组织学和免疫学价值尚未得到全面研究。本课题基于癌症基因图谱(The Cancer Genome Atlas, TCGA)公共数据库,旨在分析驱动蛋白-11在正常肺组织及肺腺癌组织中差异性表达情况,探讨驱动蛋白-11基因表达与肺腺癌临床分期及预后的关系,为肺腺癌的精准诊疗提供新的靶点找寻实验室依据。
2. 资料与方法
1) 利用癌症和基因图谱(The Cancer Genome Atlas, TCGA)公共数据库分析驱动蛋白-11在正常肺组织与肺腺癌组织中的表达,筛选范围为:a) scan by gene:KIF11;b) TCGA dateset:lung adenocarcinoma;c) sample Type:Normal vs primary tumor,共纳入59例正常肺组织,腺癌515例,找寻临床资料分析人口学特征。
2) KIF11基因的表达与肺腺癌分期相关性及生存率的影响
采用生存数据库Kaplan-Meier Plotter分析,研究KIF11基因表达与肺腺癌患者总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)结果。运用在线数据库工具TCGA分析KIF11在正常肺组织和肺腺癌组织中不同临床分期(T/N/M)和共突变P53的表达差异,以及评价对患者预后的影响因素。
3) 肺腺癌组织样本来源收集2021年12月至2022年12月于我院病理科外科手术后的石蜡样本60例,所有肺腺癌患者术前均未接受化疗、放疗及免疫治疗,术后病理证实均为肺腺癌,临床病理资料完整;本研究经蚌埠医学院第二附属医院伦理委员会同意。
4) 采用SPSS 23.0统计学软件进行数据分析。生存分析使用Kaplan-Meier软件分析;使用Wilcox秩和检验比较KIF11表达与肿瘤分期的关系。采用单因素及多因素Cox比例风险模型评价KIF11表达及肺腺癌患者临床资料与预后的关系,以P < 0.05为差异具有统计学意义。
3. 结果
1) 与正常肺组织相比KIF11在肺腺癌中的表达明显增高(图1);与不吸烟相比吸烟患者中KIF11明显增高,且随着抽烟时间延长,KIF11表达明显增高(图2)。
2) KIF11基因表达在肺腺癌组织中的表达与临床病理特征及预后的关系
免疫组化显示肺腺癌组织中KIF11基因表达成细胞膜明细黄染(图3),其表达水平与患者年龄、性别无明显相关(P > 0.05),与T/M/N分期有显著性差异(P < 0.05);单因素COX分析结果显示,Stage分期、T分期、N分期均可以作为肺腺癌潜在的预后因素(P < 0.05) (图4);
3) KIF11的表达与肺腺癌患者的生存性的相关性
根据临床数据随访生存统计数据,建立Kaplan-Meier生存曲线,结果如(图5,图6)显示,KIF11在肺腺癌组织中的表达与患者的生存时间呈显著相关(P = 0.00067)。且部分患者合并有TP53突变,提示预后不良。
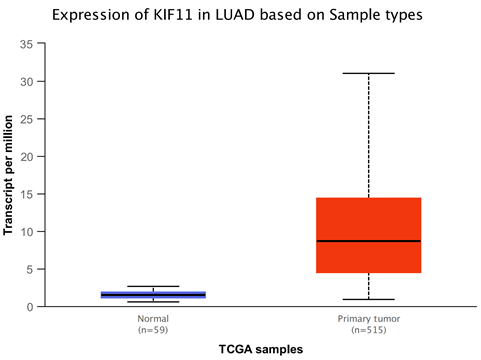
Figure 1. KIF-11 is expressed in lung adenocarcinoma
图1. KIF-11在肺腺癌中的表达
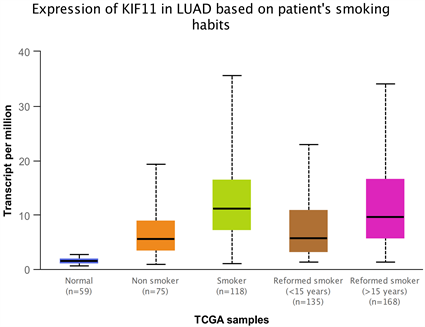
Figure 2. Expression of KIF11 in patients with smoking lung cancer
图2. 吸烟肺癌患者中KIF11的表达

Figure 3. Expression of KIF11 in lung cancer tissues (SPX100)
图3. KIF11在肺癌组织中的表达(SPX100)
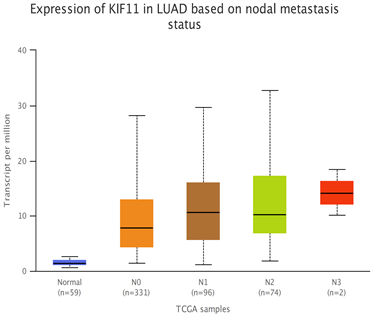
Figure 4. Expression of KIF11 in different stages (T/N) of lung adenocarcinoma
图4. 肺腺癌不同分期(T/N)中KIF11的表达情况
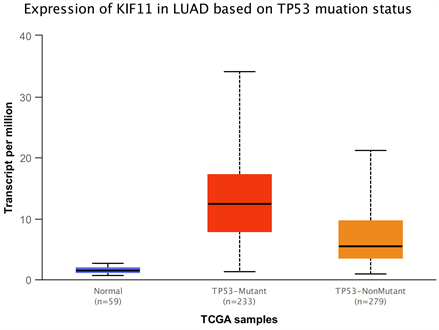
Figure 5. Lung adenocarcinoma KIF11 with P53 mutation
图5. 肺腺癌KIF11合并P53突变情况
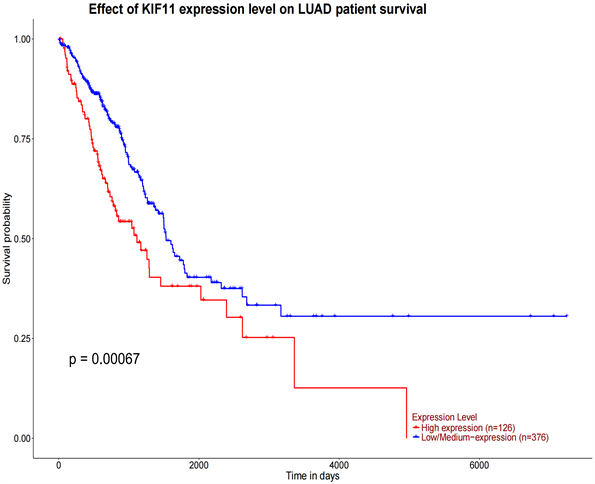
Figure 6. Association of KIF-11 expression with survival of lung adenocarcinoma
图6. KIF-11表达与肺腺癌的生存相关性
4. 讨论
非小细胞肺癌的治疗尽管取得了进展,但患者的治疗选择仍然是基础化疗,由于耐药表型的频繁出现和对肿瘤细胞缺乏选择性,化疗往往显示出非常有限的有效性。在可切除手术策略的背景下,新辅助(术前),辅助(术后)和/或围手术期给予免疫治疗抑制剂,旨在启动宿主免疫对抗现有的肿瘤新抗原,并在临床或影像学消除之前残余微病灶。生物标志物驱动的治疗也越来越多地用于手术后的辅助治疗,正在进行的临床试验正在评估它们在新辅助治疗中的应用 [3] 。因此力求更多的生物标记物驱动和免疫检查点抑制剂的研究促进肺癌精准治疗的发展。目前的指南建议对所有可操作的生物标志物和驱动因素的改变进行前期分子检测,个性化治疗模式每年都在演变 [4] 。这也推动肺腺癌进入了精准医学的前沿;因此研究肺腺癌的致病靶点以及转移机制显得至关重要。
KIF11是驱动蛋白超家族蛋白的45个家族成员之一,在有丝分裂中起运动蛋白的作用,具有高度保守的运动结构域的蛋白质,提供与微管结合的运动 [5] 。一般来说,与配对的正常组织相比,KIF11在肿瘤中显著上调。KIF11与病理分期、预后、肿瘤干度、基因组异质性、新抗原、估计、免疫检查点和药物敏感性密切相关。KIFs的运动能力在有丝分裂、减数分裂、囊泡和细胞器运输以及细胞极性的维持中发挥着至关重要的作用 [6] 。KIF11也负责在有丝分裂过程中分离重复极点并维持适当的纺锤体双极性 [7] ,非有丝分裂细胞中的分泌蛋白转运,以及调节发育中神经元的轴突生长和分支。近年来,大量研究表明,KIF11参与了多种人类癌症的生长和发展 [8] 。KIF11是N驱动蛋白中的一个成员,该驱动蛋白在分子的氨基末端区域含有运动结构域。完整的KIF11蛋白由运动结构域、颈部连接结构域和尾部结构域组成,组装成反平行四聚体结构,使它们能够捆绑和滑动平行和反平行的微管。在本研究中,我们基于机械学习数据挖掘对KIF11基因进行了全面分析,KIF11在肺癌组织中表达明显高于正常肺组织,且在预测肺腺癌预后起到重要的作用。比较研究表明,KIF11是一种强大的生物标志物,与各种癌症的免疫、靶向和化疗结果有关 [9] 。KIF11的甲基化水平在大多数癌症中降低,并且与不同人类癌症的生存概率相关。KIF11的表达在不同的分子和免疫亚型中是不同的,并且与肿瘤微环境中的免疫细胞浸润显著相关。Liu [10] 等人评估了癌症基因组图谱NSCLC数据集,发现KIF11高表达与LUAD和NSCLC患者的淋巴结转移、晚期病理分期和预后较差相关;此外,多变量分析表明,KIF11是NSCLC患者OS的独立预后因素 [11] 。此外,KIF11相互作用和共表达网络主要参与细胞周期、细胞分裂、p53信号通路、DNA修复和重组、染色质组织、抗原处理和呈递以及耐药性的调节。本课题组研究发现与正常对照组相比,TP53野生型和TP53突变型癌症患者的KIF11表达上调。此外,在大多数癌症类型中,TP53突变型癌症中KIF11的表达高于TP53野生型癌症,这些结果表明KIF11的表达与肿瘤的进展和转移密切相关。且突变p53的缺失会导致癌细胞死亡,而突变p53的异位表达会通过增加基因组的不稳定性、血管生成和侵袭 [12] 来促进生存。
5. 总结
总之:我们利用生物信息学分析,确定了KIF11在肺腺癌样本中比配对的正常组织高表达,且高KIF11与患者的高临床分期相关。高KIF11的患者比低KIF11的患者的生存结果更差。KIF11可能是一种潜在的预后和免疫疗效的生物标志物,并且文献报道在肺腺癌(LUAD)患者中,KIF11的高表达与OS较差相关 [13] 。KIF11是NSCLC中一种很有前途的诊断生物标志物和治疗靶点 [14] 。因此,靶向抑制KIF11是NSCLC患者潜在的治疗策略。
基金项目
蚌埠医学院自然科学重点项目(2021byzd202);
蚌埠医学院大学生创新创业项目(bydc2021046)。
NOTES
*通讯作者。